Л.Е. Салова, А.Т. Чанышева, М.А. Молявко
АНАЛИТИЧЕСКАЯ ХИМИЯ
Качественный кислотно-основной
Полумикроанализ

Уфа 2009
Федеральное агентство по образованию
Государственное образовательное учреждение высшего
профессионального образования
«УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Л.Е. Салова, А.Т. Чанышева, М.А. Молявко
АНАЛИТИЧЕСКАЯ ХИМИЯ
Качественный кислотно-основной
Полумикроанализ
Уфа 2009
УДК 556 (07) ББК 26.22я7
С.16
Утверждено Редакционно-издательским советом УГНТУ в качестве учебного пособия
Рецензенты:
Доктор химических наук БГПУ им.М.Акмуллы,
профессор И.М.Борисов
БашГУ доктор химических наук,
профессор Ф.Х.Кудашева
Салова Л.Е., Чанышева А,Т., Молявко М.А.
С16 Аналитическая химия. Качественный кислотно-основной полумикро-
анализ: учеб.пособие-Уфа: Изд-во УГНТУ, 2009.- с.
ISBN 978-5-7831-0865-5
Описан кислотно-основной метод анализа. Даны классификации катионов и анионов, приведены лабораторные работы, контрольные задачи, вопросы для повторения материала, схемы анализов смеси катионов, приложения. Предназначено для студентов 1 курса технологического факультета УГНТУ по курсу неорганической химии с элементами качественного анализа.
УДК 556 (07)
ББК 26.22я7
ISBN 978-5-7831-0865-5 © Уфимский государственный нефтяной
технический университет, 2009
© Салова Л.Е., Чанышева А.Т.,
Молявко М.А., 2009
Метод кислотно-основного качественного
Химического анализа неорганических веществ
Введение
Качественный анализ позволяет определить, какие элементы, молекулы входят в состав анализируемого образца или какие отсутствуют.
При анализе неорганических веществ обычно имеют дело с водными растворами солей, кислот и оснований, в растворах которых они диссоциированы на ионы. Поэтому реакции происходят между свободными ионами и открываются непосредственно не элементы, а образуемые ими ионы (катионы и анионы).
Например, для открытия хлора в HCI или в растворах хлоридов на них действуют раствором AgNO3. При этом выпадает характерный творожистый осадок белого цвета AgCI:
Ag+  + Cl- = AgCl
+ Cl- = AgCl
Сущность рассматриваемой реакции заключается во взаимодействии находящихся в растворе ионов Ag+ и Cl-. Но если бы хлор присутствовал в виде ClO3- - хлорат иона - или в виде недиссоциированных молекул хлороформа CHCl3, то эта реакция не имела бы места. Отсюда ясно, что, применяя эту реакцию, мы открываем не элемент хлор, а ион Cl-.
Если элемент образует ионы различной валентности, то для каждого из них характерны свои реакции.
Поэтому качественный анализ неорганических веществ подразделяется на анализ катионов и анализ анионов сложного вещества.
В химическом качественном анализе применяют два типа реакций:
- реакции обнаружения (открытия иона);
- реакции разделения ионов.
Реакции обнаружения – аналитический сигнал – должны сопровождаться визуальным эффектом:
- выпадение осадка определенного цвета и структуры;
- изменение цвета раствора;
- выделение газа;
- исчезновение окраски;
- растворение осадка.
Таким образом, по этим признакам судят о присутствии или отсутствии иона.
Реакции разделения применяются в систематическом анализе, когда присутствие одних ионов мешает обнаружению других ионов, при этом применяются реактивы, способные отделить один или несколько ионов:
- в виде осадка;
- путем растворения осадка.
Требования к разделению:
- реакции должны протекать быстро;
- продукты должны иметь малую растворимость для полноты осаждения;
- получающиеся осадки должны иметь кристаллическую структуру.
-
Техника выполнения реакций
Капельный анализ
Методом капельного анализа можно обнаружить одни ионы в присутствии других, не прибегая к длительным операциям отделения от мешающих ионов. При капельном анализе реакции проводят на фильтровальной бумаге, на которую наносят каплю испытуемого раствора капилляром и каплю реактива, вызывающего характерное цветное окрашивание.
Условия выполнения реакций
Проводя аналитическую реакцию, необходимо создавать определённые условия, зависящие от свойств образующихся продуктов, так как иначе результат реакции окажется недостоверным. К таким условиям относятся:
1) pH раствора – надлежащая среда – это одно из важнейших условий проведения реакции, которая в случае необходимости создаётся прибавлением к раствору кислоты или щелочи. По каплям к анализируемому раствору добавляют кислоту или щёлочь до нужной величины pH, постоянно проверяя по цветной шкале универсального индикатора;
2) температура – для получения аналитического сигнала некоторые рекции необходимо проводить при нагревании на водяной бане или пламени спиртовки, так как на холоде или при комнатной температуре они не проходят;
3) концентрация – она должна быть достаточно большая, иначе при малых значениях концентрации реакции перестают удаваться.
Причина соблюдения условия достаточной концентрации: всякое вещество может выпадать в осадок только тогда, когда оно образуется в растворе в концентрации, превышающей его растворимость при данных условиях. Если вещество очень трудно растворимо, оно выпадает в осадок уже при очень малой концентрации открываемого иона: соответствующая реакция называется чувствительной. А при значительной растворимости образующегося соединения реакция мало чувствительна и удаётся лишь при большой концентрации открываемого иона. То же относится и к реакциям, сопрвождающимся изменением окраски.
Количественно чувствительность реакций характеризуют взаимно связанными показателями: открываемым минимумом и предельным разбавлением.
Открываемый минимум – это наименьшее количество вещества или иона, которое может быть открыто посредством данной реакции, выражают его в микрограммах (m) (10-6г).
Открываемый минимум неполностью характеризует чувствительность реакции, т.к. имеет значение не только абсолютное количество, но и концентрация соответствующего вещества или иона в растворе. Поэтому указывают также и предельное разбавление, которое характеризует наименьшую концентрацию вещества (иона), при которой он может быть обнаружен. Предельное разбавление выражают отношением весовой части вещества к весовому количеству раствора (G).
Между открываемым минимумом m (выраженным в микрограммах, мкг) и предельным разбавлением (G) существует соотношение
m = V·10-6/G,
где V – объём раствора, мл.
Чувствительность реакций, служащих для открытия одного и того же иона, различна.
Например, для иона Cu2+:
| Реактив | Образующееся соединение | Эффект реакции | Открываемый минимум, мг | Предельное разбавление 1: G |
| 1. HCI | H[CuCI3] | Зелёное окрашивание раствора | 1 | 1:50000 |
| 2. NH3 | [Cu(NH3)4]CI2 | Синее окрашивание раствора | 0,2 | 1:250000 |
| 3. K4[Fe(CN)6] | Cu2[Fe(CN)6] | Коричневое окрашивание раствора/осадок | 0,02 | 1:2500000 |
Таким образом, наиболее чувствительной является реакция № 3 с K4[Fe(CN)6], позволяющая обнаружить в 50 раз меньшее количество меди в растворе, чем при действии HCI, и в 10 раз меньшее, чем при действии NH3.
Полумикроанализа
В основе многих аналитических реакций лежит реакция осаждения. К анализируемому раствору в конической пробирке по каплям добавляют соответствующий реактив. При осаждении необходимо перемешивать раствор. После выпадения осадка надо проверять полноту осаждения. Для этого после того как жидкость над осадком станет прозрачной, добавляют ещё каплю осадителя. Если в растворе не появится муть, полнота осаждения достигнута. В противном случае добавляют ещё несколько капель осадителя.
Если для проведения осаждения необходимо нагревать раствор, то пробирки помещают в водяную баню.
Для отделения осадков от растворов в качественном анализе применяют центрифугирование. Поэтому анализ проводят в конических центрифужных пробирках. После окончания центрифугирования плотный осадок остаётся на дне пробирки, а центрифугат (надосадочная жидкость) при этом осветляется и от осадка легко отделяется пипеткой или сливанием.
Если анализируют осадок, то перед растворением его промывают 2-3 раза небольшим количеством дистиллированной воды, каждый раз отделяя фильтрат центрифугированием. Для уменьшения растворимости осадков в промывную воду добавляют несколько капель осадителя. Растворение осадков проводят путём медленного (по каплям) прибавления растворителя к осадку с одновременными перемешиванием стеклянной палочкой. При необходимости смесь нагревают на водяной бане.
Требования к правилам и умениям
Прежде чем приступить к открытию ионов в контрольных задачах, студент должен:
1) научиться четко проводить общие и специфические реакции на каждый ион с соблюдением всех необходимых условий;
2) производить специфические (характерные) реакции на каждый ион в том случае, если они находятся в растворе:
а) только один;
б) в присутствии не мешающих их открытию других ионов;
в) после удаления из раствора ионов, мешающих открытию его;
3) добиваться полноты осаждения ионов, проводить проверку полноты осаждения, уметь промывать осадки после их отделения от раствора;
4) уметь пользоваться центрифугой, микроскопом, электроплиткой, водяной баней;
.
Таблица 1
Первая группа катионов
В первую, хлоридную, группу входят катионы Ag+, Pb2+, Hg22+, образующие с хлороводородной кислотой и её солями нерастворимые осадки хлоридов белого цвета AgCl, PbCl2, Hg2Cl2, и, таким образом, отделяются от сложной смеси катионов в первую очередь.
Степень окисления
Серебро (d- элемент) (5s1 4d10) во всех соединениях имеет степень окисления +1. Ион Ag+ является довольно сильным окислителем (j0 Ag+/Ag0 = +0,7986 B).
Галогениды серебра светочувствительны и, если осадок AgCl долгое время стоит на свету, то он постепенно темнеет вследствие образования металлического серебра.
Свинец (p-элемент) (6s2 6p2) может проявлять степени окисления +2 и +4. В ходе анализа приходится встречать только соединения свинца (II).
Ртуть (d- элемент) (6s2 5d10) в первой аналитической группе имеет степень окисления +1, находится в виде двухвалентного иона. Этот ион имеет состав -Hg-Hg-, поэтому в формулах (Hg2(NO3)2; Hg2Cl2) индексы при химических знаках на два сокращать нельзя. Ион ртути (I) в щелочной среде легко вступает в реакции диспропорционирования:
Hg22+ + 2e ® 2Hg0
Hg22+ - 2e ® 2Hg2+
При этом образуется ион двухвалентной ртути и металлическая ртуть.
Тот факт, что ион ртути (I) является сильным окислителем, используется в анализе для его открытия в смеси катионов первой группы (j0 Hg22+/Hg0 = = + 0,86 B).
Свойства гидроксидов
Сильные щёлочи с катионами первой группы образуют нерастворимые в воде гидроксид Pb(OH)2 и оксиды Ag2O и Hg2O. Гидроксид свинца, имеющий амфотерные свойства, при избытке щёлочи легко переходит в раствор с образованием соответствующего плюмбита.
1) 2AgNO3 + 2NaOH ® Ag2O¯ + 2NaNO3 + H2O;
бурый
2) Hg2(NO3)2 + 2NaOH ® Hg2O¯ + 2NaNO3 +H2O;
чёрный
3) Pb(NO3)2 + 2NaOH ® 2NaNO3 + Pb(OH)2¯
при избытке NaОН
Pb(NO3)2 + 4NaOH ® Na2PbO2 + 2NaNO3 + 2H2O
или Pb(NO3)2 + 4NaOH ® Na2[Pb(OH)4] + 2NaNO3.
Гидролиз солей
Соли серебра и сильных кислот имеют нейтральную реакцию - гидролизу не подвергаются.
Соли ртути (I) и свинца в результате гидролиза по катиону имеют кислую реакцию:
Pb2+ + H2O « PbOH+ + H+ рН=4
Особенно сильно подвергаются гидролизу соли ртути:
Hg22+ + H2O « Hg2O + 2H+ рН=2
1.4. Комплексообразование
Ион серебра легко вступает в комплексообразование с различными лигандами.
В ходе анализа при действии избытка раствора аммиака на нитрат, хлорид или оксид серебра образуется комплекс – аммиакат серебра. Например:
AgCl ↓ + 2NH4OH ® [Ag(NH3)2]Cl + 2H2O
Ag2O + 4NH4OH ®2[Ag(NH3)2](OH) + 3H2O
Хлорид диаминсеребра устойчив только в аммиачной среде и разлагается с выпадением белого осадка AgCl при подкислении азотной кислотой:
[Ag(NH3)2]+ + Cl- + 2H+ ® AgCl¯ + 2NH4+
Эти реакции используют в анализе для отделения иона серебра из сложной смеси катионов и открытия его.
При взаимодействии хлорида диаминсеребра с KI образуется желтоватый осадок AgI. Так как произведение растворимости AgI очень маленькой величины (ПР=1·10-16), то в присутствии иона I- аммиакатный комплекс разлагается по реакции:
[Ag(NH3)2]Cl + KI ® AgI¯ + KCl + 2NH3
жёлтый
Свинец является р-элементом и образует комплекс с гидроксид-ионом в сильнощелочной среде.
Ртуть (I) образует комплекс с ионом иода и аммиаком. При этом происходят реакции диспропорционирования - образуются комплексы ртути (II) и выпадает металлическая ртуть в виде чёрного осадка:
Hg22+ + 4I- ® [HgI4]2- + Hg0¯
Hg2Cl2 + 2NH4OH ® [Hg2NH2]Cl¯ + 2H2O + NH4Cl
[Hg2NH2]Cl¯ ® [HgNH2]Cl¯ + Hg¯
белый чёрный
Все растворы катионов первой группы бесцветны.
Техника безопасности
Соединения ртути и свинца (особенно ртути) сильно ядовиты.Ядовиты также и пары металлической ртути. В процессе работы все растворы, содержащие соединения ртути, сливать в специальный слив. После работы тщательно мыть руки с мылом. Не принимать пищу в лаборатории.
Лабораторная работа №1
«Изучение свойств катионов I аналитической группы и анализ их смеси»
Цель работы: изучение свойств солей, гидроксидов ионов Ag+, Pb2+, Hg22+; знакомство с методами разделения и обнаружения.
1.6. Общие реакции катионов I группы
Пользуясь таблицей 2, проделать реакции с каждым катионом первой группы. Уравнения всех реакций записать в тетрадь, отмечая цвет раствора и осадка. Для выполнения каждой реакции в пробирку брать 1-3 капли раствора соли данного катиона и столько же капель реактива. Если необходим избыток реактива, то его надо приливать вдвое больше.
Таблица 2
Соли серебра и ртути сливать в отдельные сливные ёмкости.
| Реактив | Условия проведения реакций | Катионы | ||
| Ag+ | Pb2+ | Hg22+ | ||
| 1.* HCl 2н -групповой реактив | - | AgCl¯ белый творожистый (ПР=1,8∙10-10) | PbCl2¯ белый (ПР=2∙10-5) | Hg2Cl2¯ белый (ПР=1,3∙10-18) |
| 2. NH4OH | избыток | [Ag(NH3)2]+ + Cl- комплексная соль раствор | Pb(OH)2¯ белый | [HgNH2]Cl↓ + Hg¯ белый чёрный |
| 3. NaOH | недостаток | Ag2O¯ бурый | Pb(OH)2¯ белый | Hg2O¯ чёрный |
| 4. NaOH | избыток | Ag2O¯ бурый | Na2[Pb(OH)4] комплексная соль раствор | Hg2O¯ чёрный |
| 5. K2CrO4 или K2Cr2O7 | 2-3 капли | Ag2CrO4¯ или Ag2Cr2O7¯ кирпично-красный | PbCrO4¯ жёлтый осадок, растворяется в NaOH, HNO3 | HgCrO4¯ красный осадок, растворяется в HNO3 |
| 6. KI | 2-3 капли | AgI¯ желтоватый, растворяется в Na2S2O3 | PbI2¯ жёлтый растворяется в горячей воде, СН3СООН | Hg2I2¯ зелёный |
| 7. H2SO4 2H | 2 капли | Ag2SO4¯ белый, растворяется в горячей воде (ПР=7,7·10-5) | PbSO4¯ белый (ПР=1,8·10-8) | Hg2SO4¯ белый (ПР=6,2·10-7) |
*К осадкам хлоридов, полученным по пункту 1, добавить избыток раствора аммиака (пункт 2). Только AgCl перейдёт в раствор по реакции
AgCl + 2NH4OH « [Ag(NH3)2]Cl + 2H2O
избыток
Раствор аммиаката серебра [Ag(NH3)2]+ оставить для обнаружения иона серебра.
Серебро
Полученный по табл. 2 (пункт 2) аммиакат серебра [Ag(NH3)2]+ разделить на две пробирки. В первую прибавлять по каплям 2н HNO3 до рН<5, при этом выпадает осадок AgCl¯ в виде белой мути. Во вторую прилить раствор KI. Выпадет желтоватый осадок AgI¯:
[Ag(NH3)2]Cl + KI + 2H2O = AgI¯ + KCl + 2NH4OH
[Ag(NH3)2]Cl + 2HNO3 = AgCl¯ + 2NH4NO3
pH = 5
Свинец
В слабокислом растворе ион Pb2+ обнаруживается действием раствора хромата калия – выпадает желтый осадок по реакции
Pb(NO3)2 + K2CrO4 → PbCrO4 ↓ +2KNO3
желтый
Если ион свинца находится в анионе комплексного соединения Na2[Pb(OH)4], то обнаружение иона свинца проводится следующим образом: к щелочному раствору соли свинца прилить K2CrO4 и затем прибавлять по каплям азотную кислоту. Когда рН станет меньше 7, выпадет желтый осадок по реакции
Na2[Pb(OH)4] + K2CrO4 + 4HNO3 ®PbCrO4¯ + 2KNO3 + 2NaNO3 + 4H2O
При нагревании осадки PbCl2, PbI2 растворяются, а при охлаждении растворов снова выпадают.
Ртуть
Ион ртути обнаруживается путём прибавления раствора аммиака к солям ртути или к осадку Hg2Cl2 до рН >7. Выпадает чёрный осадок мелкодисперсной (металлической) ртути:
Hg2(NO3)2 + 4NH4OH ® [HgNH2]NO3¯ + Hg¯ + 3NH4NO3 + 3H2O
чёрный
Hg2Cl2 + 2NH4OH ® [HgNH2]Cl¯ + Hg¯ + NH4Cl + 2H2O
чёрный
Вопросы для повторения
1. Что является групповым реагентом на катионы первой группы и как он действует на эти ионы? Написать уравнения реакций.
2. Написать реакции действия избытка щёлочи на катионы первой группы.
3. Написать реакции действия избытка аммиака на катионы первой группы.
4. При добавлении к осадку хлоридов первой группы раствора аммиака весь осадок растворился. Какой ион был в осадке? Написать уравнение реакции.
5. При добавлении избытка аммиака к раствору ионов первой группы выпал белый осадок. Какой ион присутствует в растворе?
6. Почему при добавлении раствора иодида калия к аммиакату серебра выпадает осадок иодида серебра? Написать уравнения этих реакций.
7. Какими реакциями можно отделить ион серебра от иона свинца? Написать уравнения этих реакций.
8. Какой реакцией можно отделить ион свинца от иона ртути? Написать уравнение реакции.
9. Какой ион первой группы может вступать в реакцию диспропорционирования? Написать примеры таких реакций.
10. Почему при добавлении раствора SnCl2 к раствору Hg2(NO3)2 выпадает сначала белый осадок, а затем чернеет? Написать уравнения происходящих реакций. Какие свойства в данном случае проявляет ион ртути (I)?
11. В результате чего раствор смеси солей катионов первой группы имеет кислую реакцию?
12. Свойства гидроксидов катионов I аналитической группы.
13. Реакции комплексообразования катионов I аналитической группы.
Анализируемая смесь включает
Ag + , Pb 2+ , Hg 2 2+
+HCl 2н
 |
Осадок 1 Раствор 1
АgCl /проверить
Hg2Cl2 полноту
PbCl 2 осаждения/


 + NH4OH
+ NH4OH
Осадок 2 Раствор 2
Hgº↓, [HgNH2]Cl↓, [Ag(NH3)2]Cl
 Pb(OH)2
Pb(OH)2



 +NaOH 6н
+NaOH 6н
+KI +HNO3 до рН<7
AgI↓ AgCl↓
Осадок 3 Раствор 3 желтый белый
Hgº↓ Na[Pb(OH)4] Ag+
+HNO3 до рН<7
 + K2CrO4
+ K2CrO4
Осадок 4
PbCrO4↓
желтый
Схема анализа катионов I аналитической группы
14. Составить уравнение реакции в молекулярной форме:
Sn2+ + Hg22+ ® 2Hg¯ + Sn4+
чёрный
15. Основываясь на величинах произведений растворимости хлоридов катионов I группы, сделать анализ: который из них раньше выпадет в осадок, т.е. какой менее растворим.
Вторая группа катионов
Во вторую (сульфатную) группу входят катионы Ca2+, Sr2+, Ba2+. При действии группового реагента 2н серной кислоты образуются белые осадки СаSO4, SrSO4, BaSO4 различной растворимости. Произведения растворимости их следующие: ПРСаSO4=2,4*10-5, ПРSrSO4=3,2*10-7, ПРBaSO4=2,1*10-10. Наиболее растворимый - сульфат кальция в ходе анализа осаждается серной кислотой не- полностью и попадает в другие группы. Эти сульфаты не растворяются в кислотах. В воде труднорастворимы и карбонаты этих ионов (ПРСаСO3=4,8*10-9, ПРSrСO3=1,6*10-9, ПРBaСO3=8*10-9), однако они растворимы даже в уксусной кислоте.
Степень окисления
Все металлы, образующие катионы этой группы, являются S-элементами второй группы ПСМ (ns2) и образуют соединения со степенью окисления +2. В окислительно-восстановительных процессах не участвуют.
Свойства гидроксидов
Гидроксиды этих элементов Ca(OH)2, Sr(OH)2, Ba(OH)2 являются сильными основаниями, в воде растворимость их увеличивается от Ca(OH)2 к Ba(OH)2. Получить их можно непосредственным растворением в воде оксидов или самих металлов.
Гидролиз солей
Поскольку основные свойства здесь выражены сильно, соли металлов II группы, образованные сильными кислотами, не подвергаются гидролизу и имеют в растворе реакцию, близкую к нейтральной (рН»6). Следовательно, гидролизу могут подвергаться только растворы солей слабых кислот, которые имеют щелочную реакцию.
4.4. Комплексообразование
Катионы Ca2+, Sr2+, Ba2+ как типичные S-элементы не образуют устойчивых комплексов.
Окраска соединений
Ионы Ca2+, Sr2+, Ba2+ имеют законченные 8-электронные оболочки. В водных растворах эти ионы бесцветны.
Техника безопасности
При проведении анализа второй группы катионов соблюдать общие правила по технике безопасности в химических лабораториях. Растворимые соли бария и стронция ядовиты.
Лабораторная работа №2
«Изучение свойств катионов II аналитической группы и анализ их смеси»
Цель работы: изучение свойств солей, гидроксидов ионов Ca2+, Sr2+, Ba2+; знакомство с методами разделения и обнаружения.
Барий
К 2-3 каплям растворимой соли бария прилить 3-4 капли раствора K2Cr2O7. Реакцию проводят в присутствии ацетата натрияCH3COONa. Эта реакция используется не только для открытия ионов бария, но и для отделения его от ионов кальция и стронция.
2BaCl2 + K2Cr2O7 + H2O « 2BaCrO4¯ + 2KCl + 2HCl
жёлтый
2Ba2+ + Cr2O72- + H2O « 2BaCrO4¯ + 2H+
Бихромат калия образует с ионом Ba2+ жёлтый осадок BaCrO4, а не BaCr2O7, как можно было бы ожидать. Растворимость хромата бария меньше, чем бихромата бария (ПР BaCrO4=1,8*10-14, ПР BaCr2O7=1,2*10-9), поэтому концентрация ионов CrO42-, имеющихся в растворе данного равновесия:
Cr2O72- + H2O « 2Cr2O42- + 2H+,
достаточна, чтобы образовался именно BaCrO4.
Полнее реакция осаждения хромата бария идёт в присутствии избытка ацетата натрия, понижающего концентрацию образующих катионов водорода с образованием слабой кислоты СН3СООН:
СН3СОО- + Н+ ® СН3СООН
Избыток СН3СООNа создаёт ацетатную буферную смесь, поддерживающую значение рН»5.
Нейтрализовать ионы водорода щёлочью нельзя, так как при больших значениях рН выпадает жёлтый осадок хромата стронция и реакция становится неспецифичной.
Кальций
Микрокристаллоскопическая реакция. С помощью этой реакции можно открыть ионы кальция в присутствии небольших количеств других ионов. 1 каплю раствора соли кальция нанести на предметное стекло и добавить 1 каплю H2SO4 2н и слегка подсушить на воздухе так, чтобы подсох только край капли. Образующиеся красталлы гипса CaSO4*2H2O имеют игольчатую форму (напоминающую снежинки) при рассмотрении под микроскопом (рис. 1). Открытию иона кальция мешает большая концентрация ионов Ba2+.
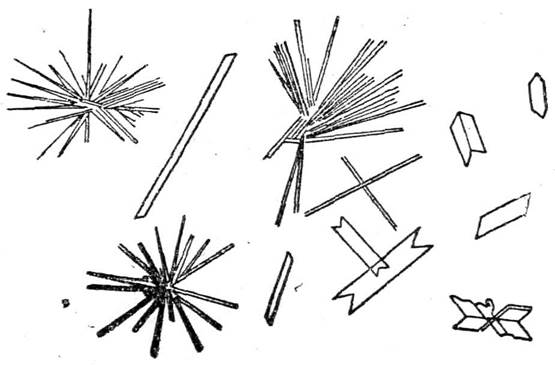
Рис. 1. Кристаллы сульфата кальция
Стронций
К двум каплям соли стронция прилить 2-3 капли раствора (NH4)2SO4. В результате реакции выпадает белый осадок SrSO4¯.
Sr(NO3)2 + (NH4)2SO4 ® SrSO4¯ + 2NH4NO3
Обнаружению ионов Sr2+ мешают ионы Ca2+ и Ba2+.
5.4.Метод выщелачивания. В ходе анализа вторую группу катионов выделяют в виде соответствующих сульфатов, а так как они не растворяются в кислотах, их сначала переводят в карбонаты выщелачиванием. Метод выщелачивания заключается в следующем: к осадку сульфатов добавляют сухую соду Na2CO3 (1,5 микрошпателя) и 2 мл воды, раствор тщательно перемешивают, кипятят в течение 5-6 минут, затем центрифугируют. Центрифугат выливают, а к осадку опять добавляют Na2CO3 и воду, греют и центрифугируют. Процесс протекает по схеме
MeSO4¯ + CO32- ®MeCO3¯ + SO42-
осадок избыток осадок
Повторить операцию 2-3 раза, осадок промывают от ионов SO42- водой и растворяют в уксусной кислоте:
 CO2
CO2
 MeCO3 + 2CH3COOH ® Me(CH3COO)2 + H2CO3
MeCO3 + 2CH3COOH ® Me(CH3COO)2 + H2CO3
H2O
Чаще всего BaSO4 полностью не превращается в карбонат, поэтому небольшая часть этого осадка может остаться. Проверить, отмыт ли осадок от ионов SO42-, можно так: к 2-3 каплям промывной воды добавить 2н НСl до рН<7 и ВаСl2. Если после этого выпадает осадок, то промыть ещё раз. После полного отмывания осадка от ионов SO42- растворить его в уксусной кислоте.
После этой операции приступают к анализу смеси второй группы катионов.
Дробное обнаружение кальция
К четырем каплям исследуемого раствора добавить 4-5 капель разбавленной серной кислоты, нагреть в водяной бане в течение двух минут, центрифугировать. Одну каплю центрифугата поместить на предметное стекло и после появления по периметру капли кристаллов рассмотреть под микроскопом.
Открытие иона бария
В отдельной пробе открыть ион бария действием K2Cr2O7 в присутствии СН3СООNa. Выпадение желтого осадка BaCrO4 говорит о наличии иона бария.
Отделение иона бария
Если открыт ион бария, то ко всему исходному раствору добавить ацетата натрия, бихромата калия до оранжевой окраски раствора над желтым осадком, нагреть, центрифугировать. Осадок BaCrO4 не исследуется.
Раствор (I) теперь содержит ионы стронция, кальция и бихромат ионы.
Обнаружение иона бария
Из раствора (1) взять 2-3 капли в отдельную пробирку и внести 2-3 капли СН3СООNa и 1 каплю K2Cr2O7. Выпадение жёлтого осадка BaCrO4 говорит о наличии иона бария:
2BaCl2 + K2Cr2O7 + 2CH3COONa + H2O ® 2BaCrO4¯ + 2KCl + 2NaCl + 2CH3COOH
Если иона бария нет, то пропустить пункт 8.8.
Обнаружение иона кальция
Если обнаружен ион бария, то к 3-4 каплям раствора (1) прибавить 2-3 капли 2н H2SO4, центрифугировать. Одну каплю центрифугата нанести на предметное стекло и, после появления по краю капли кристаллов гипса, рассмотреть их под микроскопом.
Если иона Ba2+ нет, то реакцию обнаружения иона Са2+ проводят с раствором (1) на предметном стекле с 2н H2SO4.
Отделение иона бария
Если открыт ион бария, то ко всему раствору (1) добавить СН3СООNа и K2Cr2O7 до оранжевой окраски раствора над образовавшимся осадком, нагреть, центрифугировать.Осадок BaCrO4 (5) отбросить, а раствор (5) исследовать на наличие ионов стронция.
Обнаружение иона стронция
К раствору (1) или к раствору (5) прибавить избыток насыщенного раствора (NH4)2SO4 и нагреть на водяной бане 3-5 минут. В присутствии ионов стронция выпадает белый осадок SrSO4, а ионы кальция остаются в виде растворимого комплекса: t
Sr2+ + SO42- ® SrSO4¯
белый
Ca2+ + 2SO42- « [Ca(SO4)2]2-
По выполненной работе составить подробный отчет, сделать вывод о составе полученной смеси ионов.
Третья группа катионов
В третью, амфолитную, группу катионов входят ионы Аl3+, Cr3+, Zn2+ (ионы Sn2+, Sn4+, As3+, As5+ не рассматриваются).
Групповым реагентом является раствор щёлочи, при действии избытка которого образуются растворимые в воде алюминат, хромит и цинкат, так как гидроксиды этих элементов амфотерны.
Степень окисления
Алюминий (3s23p1) и цинк (4s23d10) имеют постоянные степени окисления - три и два соответственно, и в условиях анализа в реакции окисления-восстановления не вступают.
Хром (4s13d5) - элемент VI группы ПСМ -имеет валентности II, III, VI. Соединения двухвалентного хрома неустойчивы и в условиях анализа легко превращаются в Cr3+. При окислении трёхвалентного хрома в щелочной среде перекисью водорода образуется хромат жёлтого цвета (соль хромовой кислоты - H2CrO4), в котором хром шестивалентен:
t0
2CrCl3 + 10NaOH + 3H2O ® 2Na2CrO4 + 8H2O + 6NaCl
зелёный жёлтый
 2 Cr3+ + 8OH- - 3e ® CrO42- + 4H2O
2 Cr3+ + 8OH- - 3e ® CrO42- + 4H2O
3 H2O2 + 2e ®2OH-
2Cr3+ + 10ОH- + 3H2O2 ® 2CrO42- + 8H2O
При этом окраска раствора меняется из зелёной в жёлтую. Хром (VI) присутствует в растворах в виде анионов CrO42- (щелочная среда) или Cr2O72- (кислая среда) вследствие равновесия (1).
2CrO42- +2H+ « Cr2O72- +H2O
жёлтый оранжевый
Свойства гидроксидов
Все гидроксиды катионов третьей группы амфотерны и при действии избытка сильной щёлочи на соли этих ионов идут реакции:
Al3+ + 4OH- « AlO2- + 2H2O или [Al(OH)4]-
алюминат тетрагидрооксоалюминат-ион
бесцветный
Zn2+ + 4OH- « ZnO22- + 2H2O или [Zn(OH)4]2-
цинкат тетрагидроксоцинкат-ион
бесцветный
Cr3+ + 4OH- « CrO2- + 2H2O или [Cr(OH)4]-
хромит тетрагидроксохромат (III)-ион
зелёный
С раствором аммиака соли катионов алюминия и хрома (III) образуют осадки соответствующих гидроксидов, а соль цинка, в отличие от них, в избытке NH4OH легко растворяется с образованием комплексной соли - аммиаката цинка, что делает его похожим на катионы V аналитической группы:
Zn2+ + 6NH4OH ® [Zn(NH3)4]2+ + 6H2O
Zn(OH)2¯ + 6NH4OH « [Zn(NH3)4](OH)2 + 6H2O
В анализе этой реакцией пользуются для отделения катиона Zn2+ от Al3+ и Cr3+.
Гидролиз солей
Все соли хрома, алюминия и цинка, образованные сильными кислотами, подвергаются ступенчатому гидролизу по катиону, а значит, имеют кислую реакцию:
AlCl3 + HOH « 2AlOHCl2¯ + HCl
Al3+ + HOH « AlOH2+ + H+
Zn2+ + HOH « ZnOH+ + H+
ZnOH+ + HOH « Zn(OH)2 + H+
Cr3+ +HOH «Cr(OH)2+ +H+
Алюминаты, хромиты и цинкаты также очень сильно гидролизуются и имеют щелочную реакцию, например:
CrO2- + H2O « HCrO2 + OH-
9.4. Комплексообразование
Ионы цинка и хрома (III) образуют комплексы с различными лигандами: катионные- с аммиаком и водой, анионные - с гидроксид - ионом и другими отрицательно заряженными лигандами.
Координационные числа их равны: у цинка – IV; у алюминия – IV, VI; хрома - VI.
Окраска соединений
Растворы солей алюминия и цинка бесцветны. Соединения хрома (III) в кислой среде имеют окраску от фиолетовой до зелёной, а в щелочной среде - ярко-зелёные.
Соединения хрома (VI) в кислой среде оранжевого цвета, в щелочной - жёлтого цвета.
Техника безопасности
При работе руководствоваться общими правилами работы в химической лаборатории.
Лабораторная работа № 3
«Изучение свойств катионов III аналитической группы и анализ их смеси»
Цель работы: изучение свойств солей, гидроксидов ионов Al3+, Cr3+, Zn2+; знакомство с методами разделения и обнаружения.
Таблица 4
| Реактивы | Условия проведения реакций | катионы | ||
| Al3+ | Cr3+ | Zn2+ | ||
| 1. NaOH | Недостаток | Al(OH)3¯ белый | Cr(OH)3¯ серо-зелёный | Zn(OH)2 ¯ белый |
| 2. NaOH | Избыток (до растворения осадков) | AlO2- бесцветный | CrO2- зелёный | ZnO22- бесцветный |
| 3. NaOH+H2O2 | Избыток нагреть | AlO2- бесцветный | CrO42- жёлтый | ZnO22- бесцветный |
| 4. NH4OH | Избыток | Al(OH)3¯ | Cr(OH)3¯ | [Zn(NH3)4]2+ |
| 5. Na2CO3 | Al(OH)3¯ | Cr(OH)3¯ | (ZnOH)2CO3 ¯ белый | |
Алюминий
Реакция с алюминоном. Алюминон (аммонийная соль ауринтрикарбоновой кислоты) C22H11O3(NH4)3 образует с Al(OH)3 соединение красного цвета, по структуре подобное лаку.
Выполнение реакции. К 2 каплям соли алюминия (или алюминату) прибавить 2 капли 2н раствора СН3СООН до рН<7, прилить 2 капли раствора алюминона и нагреть на водяной бане, затем прибавить раствор NH4OH (до появления запаха) и две-три капли раствора (NH4)2СO3 и прокипятить. Красные хлопья алюминиевого лака доказывают присутствие Al3+. Реакция чувствительна.
Кроме иона Al3+ лаки красного цвета с алюминоном образуют ионы Fe3+, Са2+, Cr3+. В отличие от алюминиевого лака, лак, образованный хромом, разрушается под действием избытка NH4OH. Ион Fe3+, если необходимо, cначала отделяют действием избытка щёлочи, после чего раствор подкисляют СН3СООН.
Цинк
Реакция с тетрароданомеркуриатом аммония ((NH4)2[Hg(SCN)4]) в присутствии соли кобальта (II). К 2-3 каплям (NH4)2[Hg(SCN)4] прибавить 1 каплю очень разбавленного раствора CoCl2 (0,02%) и потереть стеклянной палочкой о стенки пробирки. При этом не должен выпадать голубой осадок (рН<7). В ту же пробирку добавить 1 каплю раствора соли цинка и вновь потереть стеклянной палочкой о стенки пробирки. В присутствии иона Zn2+ быстро выпадет голубой осадок, состоящий из голубого Co[Hg(SCN)4] и белого Zn[Hg(SCN)4].
2(NH4)2[Hg(SCN)4] + ZnSO4 + CoCl2«¯Co[Hg(SCN)4]·Zn[Hg(SCN)4]+2NH4Cl+(NH4)2SO4
Роль Zn2+ заключается в том, что образуемый им белый осадок Zn[Hg(SCN)4] ускоряет (как затравка) выпадение синего осадка Co[Hg(SCN)4], который в отсутствие Zn[Hg(SCN)4] может не выпадать часами (образование пересыщенного раствора). Реакция проводится в слабокислом растворе.
Хром
Капельная реакция с бензидином. Уксуснокислый раствор бензидина C12H8(NH2)2 окисляется ионами CrO42- в соединение синего цвета. Эта реакция выполняется капельным методом после окисления Cr3+ в CrO42- действием перекиси водорода в щелочной среде.
Выполнение реакции. К 2-3 каплям соли хрома (III) прибавить раствор концентрированной щёлочи NaOH до перехода выпавшего осадка Cr(OH)3 в раствор зелёного цвета, 3-4 капли перекиси водорода и нагреть, пока окраска из зелёной не станет жёлтой (если окраска не меняется, тогда добавить ещё перекиси водорода).
t
2CrCl3 + 10 NaOH + 3H2O2 ® 2Na2CrO4 + 8H2O + 6NaCl
жёлтый
2Cr3+ + 10OH- + 3H2O2 ®2CrO42- + 8H2O
Затем на полоску фильтровальной бумаги нанести каплю полученного раствора хромата и каплю бензидина. Пятно синеет. Рассматриваемую реакцию можно использовать для дробного открытия ионов Cr3+ в присутствии других катионов. Реакции мешают ионы Co3+ и Mn4+.
Обнаружение хрома
2-3 капли исходной смеси окислить в щелочной среде H2O2 до CrO42- и открыть хром капельной реакцией с бензидином (см. п. 10.3.).
11.2 Обнаружение Al3+
В отдельной пробе открыть ион алюминия реакцией с алюминоном (см. п. 10.1.).
Обнаружение цинка
В отдельной пробе открыть ион Zn2+ реакцией с тетрароданомеркуратом аммония в присутствии соли кобальта (см. п. 10.2.).
По выполненной работе составить подробный отчет, сделать вывод о составе полученной смеси ионов.
Анализируемая смесь включает
 Al 3+ , Cr 3+ , Zn 2+
Al 3+ , Cr 3+ , Zn 2+
Дробно из исходного раствора
 t
t
Сr3++ H2O2 + NaOH→ CrO42-
CrO42- + бензидин желтый
/капельно/
 Al3+→AlO2-→ «алюминиевый лак»
Al3+→AlO2-→ «алюминиевый лак»
/реакция с алюминоном/
 Zn2+ → ZnO22-
Zn2+ → ZnO22-
/CoCl2 0,02%+
(NH4)2Hg(SCN)4/→ Co[Hg(SCN)4]∙Zn[Hg(SCN)4]
голубой осадок
Схема анализа катионов III аналитической группы
Вопросы для повторения
1. Написать реакции взаимодействия избытка щёлочи с катионами III группы.
2. Написать реакции взаимодействия избытка щёлочи и перекиси водорода с катионами III группы.
3. Написать реакции взаимодействия избытка раствора аммиака с катионами III группы.
4. Отличается ли действие небольшого количества сильной щёлочи от действия раствора аммиака на ион цинка? Написать уравнения реакций.
5. Отличается ли действие избытка щёлочи от действия раствора аммиака на раствор соли цинка? Написать уравнения реакций.
6. Почему при добавлении раствора соды к соли CrCl3 выпадает серо-зелёный осадок гидроксида хрома? Написать уравнение реакции.
7. Почему при добавлении раствора соды к соли ZnSO4 выпадает осадок основного карбоната (ZnOH)2CO3? Написать уравнение реакции.
8. Дан бесцветный раствор смеси ионов III группы. Какого иона нет в растворе?
9. Какой реакцией можно отделить ион цинка от остальных ионов третьей группы?
10. При действии щёлочи и перекиси водорода на смесь катионов III группы образуется бесцветный раствор. Какого иона нет в смеси?
11. Почему ион алюмината AlO21- надо сначала перевести в ион Al3+ перед его обнаружением алюминоном? Как это делается?
12. Как перевести ион цинката ZnO22- в ион Zn2+? Можно ли в щелочном растворе открыть ион цинка известной Вам реакцией?
13. Дан щелочной раствор ионов третьей группы ярко-зелёного цвета. Какие ионы могут быть в этом растворе?
14. Примеры комплексов катионов III группы.
15. Почему при добавлении раствора соды к соли AlCl3 выпадает белый осадок гидроксида алюминия?
Четвёртая группа катионов
В четвёртой гидроксидной группе катионов изучаются ионы Fe2+, Fe3+, Mn2+, Mg2+, Bi3+ .
Групповыми реактивами являются растворы аммиака и щёлочи, которые осаждают эти ионы в виде гидроксидов, нерастворимых в избытке реактивов.
13. Общая характеристика катионов четвёртой группы
13.1. Степень окисления
Из четвёртой аналитической группы только ион магния (3s2) не вступает в реакции окисления-восстановления и имеет постоянную степень окисления +2.
В данную группу входят ионы железа (4s23d6) со степенью окисления +2 и +3. В ходе анализа ион Fe2+ обычно окисляется до иона Fe3+ (даже кислородом воздуха). Поэтому открытие двухвалентного железа проводят в начале анализа дробным методом. Если в анализируемой смеси присутствует Fe2+, то в результате его окисления всегда будет присутствовать и ион Fe3+.
Висмут (6s2 6p3) входит в V-А группу ПСМ и может проявлять степени окисления +3 и +5. Перевести его в степень окисления +5 можно только очень сильным окислителем, поэтому в условиях анализа имеют дело только с ионом Bi3+.
Анализируемая смесь включает
Ag + ; Pb 2+ ; Hg 2 2+ ; Ca 2+ ; Ba 2+ ; Sr 2+ ; Al 3+ ; Cr 3+ ; Zn 2+
 + HCl; H2SO4
+ HCl; H2SO4
 |
Раствор 1 Осадок 1

 дробно AgCl ; Hg 2 Cl 2 ; PbCl 2 ; PbSO 4 ; BaSO 4 ; SrSO 4
дробно AgCl ; Hg 2 Cl 2 ; PbCl 2 ; PbSO 4 ; BaSO 4 ; SrSO 4
 Ca2+; Al3+; Cr3+; Zn2+ промыть; + NH4OH изб.
Ca2+; Al3+; Cr3+; Zn2+ промыть; + NH4OH изб.
 Сa2+ /микрокристаллоскопически/ Раствор 2 Осадок 2
Сa2+ /микрокристаллоскопически/ Раствор 2 Осадок 2
[Ag(NH3)2]+ Pb(OH)2; Hg0↓; SrSO4; BaSO4



 Al3+ +H+ +I- + NaOH изб.
Al3+ +H+ +I- + NaOH изб.

 /реакция с алюминоном/
/реакция с алюминоном/
t AgCl↓ AgI↓

 Cr3+ + H2O2 + OH- → CrO42- +… Раствор 3 Осадок 3
Cr3+ + H2O2 + OH- → CrO42- +… Раствор 3 Осадок 3
CrO42- + бензидин [Pb(OH)4]2-
 /капельно/ +HNO3 (pH<7) + Na2CO3
/капельно/ +HNO3 (pH<7) + Na2CO3
K2CrO4 /выщелачивание/


 Zn2+ → PbCrO4
Zn2+ → PbCrO4
/СoCl20,02% + [(NH3)2Hg(SCN)4]/ желтый Раствор 4 Осадок 4
не исследуется BaCO3↓
SrCO3↓
 Осадок 6 +CH3COOH
Осадок 6 +CH3COOH

 Осадок 7 ВaCrO4 ↓ (pH<7)
Осадок 7 ВaCrO4 ↓ (pH<7)


 SrSO4 ↓ Раствор 5 Осадок 5
SrSO4 ↓ Раствор 5 Осадок 5

 Раствор 6 K2Cr2O7 Ba2+; Sr2+ не исследуется
Раствор 6 K2Cr2O7 Ba2+; Sr2+ не исследуется
(NH4)2SO4, t CH3COONa
Раствор 7
[Ca(SO4)2]2-
Схема анализа смеси катионов I, II и III аналитических групп
Марганец (4s2 3d5) – элемент VII-В группы ПСМ – может проявлять степени окисления от +2 до +7. В анализе катионов имеем дело с ионом Mn2+ и оксидом MnO2.
В присутствии щёлочи гидроксид марганца Mn(OH)2 быстро окисляется кислородом воздуха до MnO2, что используется в анализе для его открытия:
2Mn(OH)2¯ + O2 ® 2MnO(OH)2¯ или MnO2¯
телесный воздух бурый бурый
Свойства гидроксидов
Все гидроксиды IV аналитической группы имеют основные свойства.
Гидроксид магния Mg(OH)2 – белый аморфный осадок, легко растворяется в солях аммония. Например:
Mg(OH)2¯ + 2NH4Cl « 2NH4OH +MgCl2
В присутствии ионов аммония концентрация ионов ОН- в растворе над осадком Mg(OH)2 значительно понижается, так как избыток ионов NH4+ связывает ионы ОН-, находящиеся в равновесии с осадком Mg(OH)2 (NH4++ОН-« NH4ОН), и вследствие этого произведение концентраций [Mg2+] и [OH-] становится меньше ПР Mg(OH)2 = 5·10-12, т.е. раствор по отношению к Mg(OH)2 становится ненасыщенным и осадок растворяется.
В щелочной среде серо- зеленый осадок Fe(OH)2окисляется кислородом воздуха или перекисью водорода до бурого Fe(OH)3.
 4Fe(OH)2¯ + O2 + 2H2O ® 4Fe(OH)3¯
4Fe(OH)2¯ + O2 + 2H2O ® 4Fe(OH)3¯
4 Fe(OH)2 + OH- - e ® Fe(OH)3¯
1 O2 + 2H2O + 4e ® 4OH-
2Fe(OH)2 +H2O2 ® 2Fe(OH)3¯
2  Fe(OH)2 + OH- - e ® Fe(OH)3
Fe(OH)2 + OH- - e ® Fe(OH)3
1 H2O2 + 2e ®2OH-
Гидроксид марганца Mn(OH)2 – амфотерный осадок телесного цвета. На воздухе или при действии Н2О2 быстро окисляется до MnO(OH)2 или (MnO2) – осадок бурого цвета, который плохо растворяется в кислотах – это используется для отделения его от остальных гидроксидов.
MnSO4 + H2O2 + 2NH4OH ® MnO(OH)2¯ + (NH4)2SO4 + H2O
бурый
Mn2+ + H2O2 + 2OH- ® MnO(OH)2¯ + H2O
2MnSO4 + O2 + 4NH4OH ® 2MnO(OH)2¯ + 2(NH4)2SO4
воздух бурый
2Mn2+ + O2 +4OH- ® 2MnO(OH)2¯
MnO2 или MnO(OH)2 – соединения Mn4+ - имеют амфотерный характер, но плохо растворяются и в кислотах. и в щелочах.
Гидроксид висмута Bi(OH)3 – белый осадок, растворяется в кислотах, но не растворяется в щелочах. На воздухе и при действии Н2О2 не окисляется.
В щелочной среде легко восстанавливается ионом Sn2+ до металлического висмута. Эта реакция применяется для открытия иона Bi3+.
2Bi(OH)3 + 3SnCl2 + 6NaOH ® 2Bi¯ + 3H2SnO3 + 6NaCl + 3H2O
чёрный
При нагревании гидроксид висмута (III) переходит в нерастворимый гидроксид висмутила (BiО+ - висмутил-ион):
t0
Bi(OH)3 ® BiOOH¯ + H2O
жёлтый
Гидролиз солей
Все растворимые соли сильных кислот катионов четвёртой группы подвергаются гидролизу и имеют кислую реакцию. Сильнее других гидролизуются соли висмута – это обстоятельство используется для его обнаружения. Значения рН солей IV аналитической группы:
pH(Bi3+) = 1; pH(Fe3+) = 2; pH(Mg2+) = 5;pH(Mn2+) = 6; pH(Fe2+) = 3.
Например:
BiCl3 + 2H2O « Bi(OH)2Cl¯ + 2HCl - II ступень гидролиза
Эта основная соль неустойчива и по мере образования тут же выделяет молекулу воды, образуя новую основную соль BiOCl, в которой место двух гидроксильных групп занимает атом кислорода:
Bi(OH)2Cl ® BiOCl¯ + H2O
13.4. Комплексообразование
Из катионов IV группы ярко выраженную способность к комплексообразованию проявляют ионы Fe2+ и Fe3+, что используется для их открытия в ходе анализа.
Окраска соединений
Растворы солей магния и висмута бесцветны; соли марганца (II) – бледно-розовые; железа (II) – бледно-зелёные; железа (III) – цвета ржавчины.
Техника безопасности
Руководствоваться общими правилами работы в химической лаборатории. Помнить, что соли висмута ядовиты.
Лабораторная работа № 4
«Изучение свойств катионов I V аналитической группы и анализ их смеси»
Цель работы: изучение свойств солей, гидроксидов ионов Fe2+, Fe3+, Mn2+, Mg2+, Bi3+; знакомство с методами разделения и обнаружения их.
13.7. Общие реакции катионов четвёртой группы
Проделать реакции, характеризующие свойства катионов IV группы по табл. 5. Реакции на каждый катион по пунктам 1,2,3 проводить в одной пробирке.
Таблица 5
| Реактив | Условия реакций | Катионы | ||||
| Fe2+ | Fe3+ | Mn2+ | Bi3+ | Mg2+ | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1 NH4OH | избыток | Fe(OH)2¯ грязно-зелёный | Fe(OH)3¯ бурый | Mn(OH)2¯ белый, на воздухе темнеет | Bi(OH)3¯ белый | Mg(OH)2¯ белый, растворим в NH4Cl |
| 2 NH4OH + H2O2 | нагревание | Fe(OH)3¯ | Fe(OH)3¯ | MnO2¯ бурый | Bi(OH)3¯ белый | Mg(OH)2¯ |
| 3 NH4OH + NH4Cl | сухая соль | Fe2+ | Fe(OH)3¯ | Mn2+ | Bi(OH)3¯ белый | Mg2+ |
| 4 Na2CO3 | FeCO3¯ белый | Fe(OH)СO3¯ бурый | MnCO3¯ белый | Bi(OH)CO3¯ белый | (MgOH)2CO3¯ белый | |
| 5 Na2HPO4 | Fe3(PO4)2¯ белый | FePO4¯ желтоватый | Mn3(PO4)2¯ белый | BiPO4¯ белый | MgHPO4¯ белый | |
| 6 K3[Fe(CN)6] | KFe[Fe(CN)6] ¯ синий (турнбуллева синь) | - | Mn3[Fe(CN)6]2¯ бурый | Bi(OH)3¯ | - | |
| 7 K4[Fe(CN)6] | Fe2[Fe(CN)6] ¯ белый, на воздухе синеет (окисляется) | KFe[Fe(CN)6] ¯ Синий (берлинская лазурь) | Mn2[Fe(CN)6] ¯ зелёный | BiOCl¯ гидролиз | - | |
Магний
Реакция с гидрофосфатом натрия Na2HPO4. Гидрофосфат натрия образует с солями магния в присутствии NH4OH и NH4Cl (аммиачного буфера) белый кристаллический осадок фосфата магния-аммония. Образующиеся кристаллы имеют характерную форму в виде звёздочек и древовидных образований (рис. 2).
Проведению этой реакции мешают все ионы тяжёлых металлов, также образующие в этих условиях осадки фосфатов.
Выполнение реакции. К 2 каплям исследуемого раствора прилить 2-3 капли 2н раствора HCl и 1-2 капли Na2HPO4, нагреть, после этого по каплям прилить раствор NH4OH, перемешивая содержимое пробирки после каждой капли. В присутствии ионов магния образуется белый осадок:

Рис. 2. Кристаллы магний- аммоний фосфата
MgSO4 + Na2HPO4 + NH4OH ® MgNH4PO4¯ + Na2SO4 + H2O
Mg2+ + HPO42- + NH4OH ® MgNH4PO4¯ + H2O
Раствор с осадком поместить на предметное стекло; рассмотреть под микроскопом и сделать вывод. Для получения кристаллов правильной формы необходимо соблюдать условия медленной кристаллизации, а именно: после подкисления раствора соли магния соляной кислотой медленно прибавить Na2HPO4 и по каплям прибавлять раствор NH4OH до рН@9. Если рН>10, то вместо MgNH4PO4¯ выпадет малохарактерный осадок Mg3(PO4)2¯.
Марганец
Капельная реакция с бензидином. Бензидин окисляется соединениями марганца (IV) с образованием окрашенных в синий цвет продуктов.
Выполнение реакции: на фильтровальную бумагу нанести каплю соли Mn2+ и каплю 2н NaOH, образующийся Mn(OH)2 быстро окисляется кислородом воздуха, пятно на бумаге при этом буреет:
2Mn(OH)2 + O2 ® 2MnO(OH)2¯
бурый
Затем в центр пятна нанести каплю раствора уксуснокислого бензидина, при этом Mn4+ окислит его и пятно посинеет, что свидетельствует о присутствии катиона Mn2+:
C12H8(NH2)2 + MnO(OH)2 + 2CH3COOH ® C12H8(NH)2 + Mn(CH3COO)2 +3H2O
синий
Мешают только ионы кобальта. В их присутствии щелочную среду создают раствором аммиака с хлоридом аммония.
14.3. Железо (II)
Реакция с гексацианоферратом (III) калия (красной кровяной солью). Ионы железа (II) с K3[Fe(CN)6] в кислой среде образуют мелкий осадок синего цвета:
FeSO4 + K3[Fe(CN)6] ® KFe[Fe(CN)6]¯ + K2SO4
синий
Осадок не растворяется в кислотах и не разлагается щелочами. Реакции мешают ионы Mn2+, Zn2+, Co2+, Ni2+, которые образуют с данным реактивом осадки, окрашенные в бурые или жёлтые цвета, и маскируют синюю окраску осадка в зелёную.
Выполнение реакции. К 1-2 каплям кислого раствора соли железа (II) (рН<7) прилить 1 каплю гексацианоферрата (III) калия. Моментально образуется осадок турнбуллевой сини.
Железо (III)
Реакция с гексацианоферратом (II) калия (жёлтой кровяной солью). По этой реакции в кислой среде образуется тёмно-синий осадок комплексной соли - берлинской лазури, нерастворимой в кислотах и разлагающейся в щелочах с выделением Fe(OH)3¯:
FeCl3 + K4[Fe(CN)6] ® KFe[Fe(CN)6] ¯ + 3KCl
тёмно-синий
Выполнение реакции. К 1-2 каплям соли железа (III) прибавить 1-2 капли 2н раствора HCl и 1 каплю K4[Fe(CN)6], при этом выпадает тёмно-синий осадок.
Реакция пригодна для обнаружения иона Fe3+ в смеси со всеми катионами.
Реакция с роданидом калия или аммония. Ионы трёхвалентного железа в кислой среде с роданидом калия или аммония образуют кроваво-красный роданид железа (III):
FeCl3 + 3KSCN ®[ Fe(SCN)3]0 + 3KCl
красный
Этой реакции мешают анионы, образующие с ионами Fe3+ более устойчивые комплексные соединения, например, [FeF6]3-, которые маскируют красное окрашивание.
Выполнение реакции: к 1-2 каплям соли железа (III) прилить 1-2 капли 2н раствора HСl и добавить 1-2 капли KSCN или NH4SCN. Появляется кроваво-красное окрашивание.
Висмут
Восстановление иона висмута станнитом натрия Na2SnO2 в щелочной среде до металлического висмута. Висмут осаждается в виде мелкодисперсного осадка чёрного цвета, а станнит натрия превращается в станнат.
Выполнение реакции. К 2 каплям раствора (свежеприготовленного) SnCl2 прибавить по каплям концентрированный раствор NaOH до полного растворения осадка гидроксида олова:
SnCl2 + 4NaOH ® Na2SnO2 + 2NaCl + 2H2O;
затем к полученному раствору станнита прибавить 1 каплю соли висмута:
2Bi(NO)3 + 6NaOH +3Na2SnO2 ®2Bi0¯ + 3Na2SnO3 + 3H2O+ 6NaNO3
чёрный
2Bi3+ + 3SnO22- + 6OH- ® 2Bi + 3SnO32- + 3H2O
 2 Bi3+ + 3e ® Bi0
2 Bi3+ + 3e ® Bi0
3 SnO22- + 2OH- - 2e ® SnO32- + H2O
Реакция с иодидом калия KI. При действии соли Bi3+ на раствор KI образуется чёрный осадок BiI3¯, который растворим в избытке KI с образованием комплексных ионов оранжевого цвета:
1) Bi3+ + 3I- ® BiI3¯
чёрный
2) BiI3¯ + KI ® K[BiI4]
оранжевый
тетраиодовисмутат (III) калия
При сильном разбавлении вместо BiI3¯ выпадает оранжевый осадок основной соли висмута:
[BiI4]- + H2O ® BiOI¯ + 3I- + 2H+
оранж.
Реакции мешает катион Fe3+:
2Fe3+ + 2I- ® 2Fe2+ + I2¯
бурый
Выполнение реакции. К 1-2 каплям соли висмута прилить 2-3 капли раствора KI. Сначала наблюдается выпадение осадка BiI3¯ чёрного цвета, а затем, в избытке KI, его растворение с переходом в комплексную соль оранжевого цвета K[BiI4].
Вопросы для повторения
1. Какие вещества получаются при добавлении раствора щёлочи к смеси катионов четвёртой группы? Написать уравнения реакций.
2. Какие вещества получаются при добавлении растворов щёлочи и перекиси водорода к смеси катионов IV группы? Написать уравнения реакций.
3. Раствор смеси катионов четвёртой группы бесцветен. Какие ионы могут присутствовать в данной смеси?
4. При смешивании одинаковых объёмов растворов солей четвёртой группы катионов выпадает белый осадок. Присутствие какого иона можно предположить? Написать уравнение реакции происходящего процесса.
5. Раствор смеси катионов IV группы имеет сильнокислую реакцию. За счёт какого процесса это происходит? О наличии каких ионов в смеси это говорит?
6. При добавлении к смеси катионов IV группы группового реагента IV группы (раствора аммиака) выпал осадок белого цвета. Каких ионов не может быть в смеси?
7. Почему при выполнении капельной реакции на ион марганца после добавления щёлочи бензидин надо добавлять только через несколько минут? Написать уравнения происходящих реакций.
8. Можно ли открыть ион двухвалентного железа после обработки смеси катионов IV группы растворами щёлочи и перекиси водорода, а затем растворения полученного осадка в азотной кислоте?
9. Почему гидроксид магния растворяется в аммиачной буферной смеси? Написать уравнение реакции.
10. Почему ион магния нельзя открыть в присутствии других катионов четвёртой группы?
Анализируемая смесь включает
Fe2+; Fe3+; Mn2+; Mg2+; Bi3+

 Раствор 1 Осадок 1
Раствор 1 Осадок 1
 Fe2+; Fe3+; Mn2+; Mg2+ BiOCl↓
Fe2+; Fe3+; Mn2+; Mg2+ BiOCl↓
 белый
белый

 + Na2SnO2 (до рН>7)
+ Na2SnO2 (до рН>7)
 Fe2+ : K3[Fe(CN)6]→ KFe[Fe(CN)6] Biº↓
Fe2+ : K3[Fe(CN)6]→ KFe[Fe(CN)6] Biº↓
 синий черный
синий черный
Fe3+ : KSCN→ [Fe(SCN)3]º
красный
 Мn2+ : + капельная реакция
Мn2+ : + капельная реакция
 с бензидином → синее окрашивание
с бензидином → синее окрашивание
t
Mg2+ : +NH4OH + NH4Cl→
 +H2O2 сух.
+H2O2 сух.
Раствор 2 Осадок 2
 Mg2+ Fe(OH)3; MnO2↓; Bi(OH)3↓
Mg2+ Fe(OH)3; MnO2↓; Bi(OH)3↓
(NH4+)
Открытие Mg2+
Схема анализа катионов IV аналитической группы
11. Почему перед отделением иона магния аммиачной буферной смесью смесь катионов надо окислить перекисью водорода?
12. Какие ионы четвёртой группы можно открыть дробным методом? Какие осложнения могут при этом быть?
13. При добавлении щёлочи к одному из ионов четвёртой группы сначала выпадает светлый осадок. Затем он постепенно буреет. Какой это ион? Напишите уравнения происходящих реакций.
14. При добавлении к раствору соли двухвалентного железа щёлочи выпадает осадок грязно-зелёного цвета, а не белого, как описано в книге. Объясните это явление.
15. К смеси ионов четвёртой группы добавили раствор щёлочи и перекиси водорода – выпал осадок белого цвета. Какие ионы могут присутствовать в данной смеси?
16. Способы открытия катиона висмута (III).
РН смеси
Если среда сильнокислая, то можно предположить наличие катионов Al3+, Cr3+, Fe3+, Bi3+.
Если среда слабокислая, ближе к нейтральной, то в задаче могут быть катионы Fe2+, Mg2+, Mn2+, Zn2+, так как соли этих ионов менее гидролизованы.
Анализ осадка (2)
В осадок (2) перешли катионы IV группы в виде:
- Fe(OH)3¯ (если в растворе присутствовал ион Fe2+, то он окислился действием NaOH и H2O2 до Fe(ОН)3;
- MnO2¯ (окислился ион Mn2+);
- Mg(OH)2¯;
- Bi(OH)3¯.
16.10. Отделение иона Mg2+ от осадка 2
К осадку 2 добавить две ложечки(шпателя) сухого NH4Cl, прилить 2 мл Н2О и, помешивая, нагревать смесь около 6 минут, затем центрифугировать. Полученный осадок (3) оставить для п.13.
16.11. Обнаружить в растворе (3) ион Mg2+ реакцией с Na2HPO4.
16.12. Анализ раствора 2 - дробное обнаружение катионов III группы:
а) Al3+: 3 капли раствора (2) подкислить СН3СООН (до рН<7) и открыть ион алюминия алюминоном:
AlO2- + 4H+ ® Al3+ + 2H2O
NH4OH, t0
Al3+ +NH4OH+ алюминон ® “красный лак” на осадке Al(OH)3;
б) в отдельной пробе сильнощелочного раствора (2) открыть ион хрома реакцией с бензидином;
в) Zn2+: 2 капли раствора (2) подкислить 2н раствором HСl до рН<7, и в отдельной пробирке приготовить затравку: смесь солей (NH4)2[Hg(SCN)4] и CoCl2. Содержимое обеих пробирок объеденить, стенки пробирки потереть палочкой, по выпадению голубого осадка сделать вывод о наличии иона Zn2+.
Анализ осадка 3
В осадке (3) можно проверить наличие катионов железа (III) и висмута (III). Для этого к осадку (3) прилить 6-8 капель 2н раствора HNO3. Смесь перемешать, центрифугировать. Осадок (4) не исследуется. Полученный раствор (4) разделить на две пробирки: в одной проверить наличие Fe3+, в другой - Bi3+ соответствующими реакциями.
По выполненной работе составить подробный отчёт, сделать вывод о составе полученной смеси ионов.
Анализируемая смесь включает

 Cr3+; Al3+; Zn2+; Fe2+; Fe3+; Mn2+; Mg2+; Bi3+
Cr3+; Al3+; Zn2+; Fe2+; Fe3+; Mn2+; Mg2+; Bi3+
 раствор 1 осадок 1 2н HCl а) Na2SnO2→Bi↓
раствор 1 осадок 1 2н HCl а) Na2SnO2→Bi↓
дробно ВiOCl↓ →

 б) KI→BiI3↓→K[BiI4]
б) KI→BiI3↓→K[BiI4]
 Fe2+ + K[Fe(CN)6]2-→FeK[Fe(CN)6]
Fe2+ + K[Fe(CN)6]2-→FeK[Fe(CN)6]
Раствор 1
 NaOH; H2O2; t0
NaOH; H2O2; t0
 Fe3+ + SCN-→[Fe(SCN)6]3-
Fe3+ + SCN-→[Fe(SCN)6]3-
OH-
 Mn2+ → Mn4+ + бензидин раствор 2 осадок 2
Mn2+ → Mn4+ + бензидин раствор 2 осадок 2
 /капельная реакция/ Fe(OH)3↓
/капельная реакция/ Fe(OH)3↓
 [H+] MnO2↓
[H+] MnO2↓
AlO2- → Al3+ Bi(OH)3↓
 алюминон Mg( OH)2↓
алюминон Mg( OH)2↓
 NH4OH
NH4OH
NH4Cl сухой;
CrO42- + H2O; t0
 бензидин /капельно/
бензидин /капельно/
[H+]
ZnO22-→ Zn2+ раствор 3
 /CoCl2 0,02%+ [(NH3)2Hg(SCN)4]/ осадок 3 Mg2+; NH4+
/CoCl2 0,02%+ [(NH3)2Hg(SCN)4]/ осадок 3 Mg2+; NH4+
MnO2↓ Na2HPO4;
Fe(OH)3↓ t0
Bi(OH)3↓
 HNO3 MgNH4PO4↓
HNO3 MgNH4PO4↓
 /микроскоп/
/микроскоп/
раствор 4 осадок 4
Fe3+ MnO2↓
Bi3+
Схема анализа смеси катионов III и IV аналитических групп
Пятая группа катионов
К пятой (аммиакатной) группе катионов относятся ионы Сu2+, Ni2+, Co2+. Групповым реактивом является избыток раствора аммиака. При этом образуются растворимые в воде аммиакатные комплексы: [Cu(NH3)4]2+, [Ni(NH3)6]2+, [Co(NH3)6]2+.
Степень окисления
Медь(4s1 3d10) образует соединения со степенью окисления I и II. В условиях анализа будем иметь дело с соединениями двухвалентной меди.
Кобальт (4s2 3d7) может иметь степени окисления II и III. В кислой среде более устойчивы соединения кобальта (II). В щелочной среде Со(ОН)2 окисляется перекисью водорода в Со(ОН)3. Очень легко кислородом воздуха окисляются комплексные соединения Со(II) в соответствующие комплексы Со(III).
У никеля (4s2 3d8) наиболее устойчива степень окисления II, как в простых соединениях, так и в комплексах. При действии перекиси водорода Ni(OH)2 не окисляется.
17.2. Свойства гидроксидов
Все гидроксиды катионов пятой группы имеют основный характер. Действие щёлочи на соли этих катионов приводит к образованию следующих осадков:
Cu2+ + 2OH- ® Cu(OH)2¯
голубой
Co2+ + OH- + Cl- ® Co(OH)Cl¯
синий
Co(OH)Cl¯ + OH- ® Co(OH)2¯+ Cl-
розовый
Ni2+ + 2OH- ® Ni(OH)2¯
зелёный
При действии раствора аммиака, взятого в эквивалентном количестве, также образуются осадки соответствующих гидроксидов или основных солей, а избыток аммиака приводит к образованию растворов комплексных соединений:
CuSO4 + 4NH4OH ® [Cu(NH3)4]SO4 + 4H2O
Ni(NO3)2 + 6NH4OH ® [Ni(NH3)6](NO3)2 + 6H2O
CoCl2 + 6NH4OH ® [Co(NH3)6]Cl2 + 6H2O
Гидроксид меди тёмно-голубого цвета при нагревании разлагается с образованием оксида меди чёрного цвета, который нерастворим в NH4OH:
t
Cu(OH)2 ® CuO¯ + H2O
Гидроксид никеля Ni(OH)2 светло-зелёного цвета под действием сильных окислителей (Br2, Cl2 и т.д.) переходит в гидроксид Ni(OH)3 чёрного цвета:
2Ni(OH)2¯ + Br2 + 2NaOH ® 2Ni(OH)3¯ + 2NaBr
Гидроксид кобальта Co(OH)2, а также основные соли кобальта на воздухе постепенно окисляются в Co(OH)3:
4Co(OH)2¯ + 2H2O + O2 ® 4Co(OH)3¯
розовый тёмно-бурый
Гидролиз солей
Все растворы солей катионов пятой группы и сильных кислот имеют кислую реакцию в результате гидролиза по катиону. Действие раствора соды на растворы этих солей в результате гидролиза приводит к образованию осадков основных карбонатов:
2Мe2+ + CO32- + 2H2O ® (MeOH)2CO3¯+ 2H+
17.4. Комплексообразование
Все катионы пятой группы являются d-элементами ПСМ и поэтому легко вступают в реакции комплексообразования с различными лигандами.
Координационные числа их обычно равны 4 и 6.
Большое значение имеет образование комплексных соединений с роданид-, цианид-ионами, а также с диметилглиоксимом. Применение реакций комплексообразования для данной группы позволяет маскировать мешающие ионы.
Окраска соединений
Растворы солей меди имеют различные оттенки: от голубого до зелёного. Соли кобальта имеют розовую окраску, никеля - зелёную.
Техника безопасности
Реакции с концентрированным раствором аммиака выполнить под тягой.
Растворение осадков в азотной кислоте проводить под тягой, т.к. выделяются ядовитые оксиды азота.
Лабораторная работа № 5
«Изучение свойств катионов V аналитической группы и анализ их смеси»
Цель работы: изучение свойств солей, гидроксидов ионов Сu2+, Ni2+, Co2+; знакомство с методами разделения и обнаружения.
Медь
Реакция с гексацианоферратом (II) калия K4[Fe(CN)6]. Данная реакция очень чувствительна. Другие катионы пятой группы также образуют с этим реагентом осадки (см. табл. 6).
Выполнение реакции 2-3 капли раствора соли меди (II) подкислить 2н H2SO4 до рН<7 и прилить 2-3 капли K4[Fe(CN)6]. В присутствии меди (II) выпадает красно - бурый осадок гексацианоферрата (II) меди:
2Сu2+ + [Fe(CN)6]4- ® Cu2[Fe(CN)6]¯
Реакция с роданидом калия KSCN или аммония NH4SCN. Соль меди (II) с KSCN образует чёрный осадок роданида двухвалентной меди Cu(SCN)2¯:
Сu(NO3)2 + 2KSCN ® Cu(SCN)2¯ + 2KNO3
чёрный
В ходе анализа черный осадок Cu(SCN)2 превращают в белый CuSCN, применяя восстановитель Na2SO3. Это проводят для маскировки Сu2+ при обнаружении Co2+.
Выполнение реакции. 2-3 капли соли меди (II) подкислить до рН£7 и присыпать несколько кристалликов KSCN или NH4SCN. При этом выпадает чёрный осадок роданида меди (II), затем в пробирку присыпать несколько кристалликов сухого сульфита натрия Na2SO3. Происходящая ОВ реакция приводит к образованию белого осадка CuSCN¯:
2Cu(SCN)2¯ + Na2SO3 + H2O ® 2CuSCN¯ + Na2SO4 + 2HSCN
чёрный сухой белый
 2 Cu2+ + е ® Cu1+
2 Cu2+ + е ® Cu1+
1 SO32- + H2O - 2e ® SO42- + 2H+
Кобальт
Реакция с роданидом калия KSCN или аммония NH4SCN. Соль кобальта (II) при рН=4-5 с сухим роданидом калия или аммония даёт неустойчивый в воде комплекс синего цвета:
СoCl2 + 4KSCN ® K2[Co(SCN)4] + 2KCl
синий раствор
Образующийся комплекс более устойчив в органическом растворителе - изоамиловом спирте. Реакции мешают ионы Fe3+ и Cu2+, дающие с роданидом комплексы соответственно красного и чёрного цвета. Роданид железа можно замаскировать прибавлением NaF или NH4F, а роданид меди обесцветить восстановлением Na2SO3.
Выполнение реакции: к 2 каплям соли кобальта (II) добавить 3-4 капли изоамилового спирта и несколько кристалликов роданида калия, пробирку встряхнуть и дать расслоиться жидкости. Верхний (органический) слой окрашивается в синий цвет. Нижний (водный) окрашивается в розовый вследствие разложения комплекса. Реакцию можно применять для дробного обнаружения кобальта в смеси с другими катионами.
Никель
Реакция с диметилглиоксимом (реактивом Чугаева). Диметилглиоксим образует с ионом Ni2+ в аммиачной среде (рН»9) характерный ало-красный осадок внутрикомплексной соли. Аммиак связывает выделяющиеся ионы водорода и равновесие сдвигается вправо:
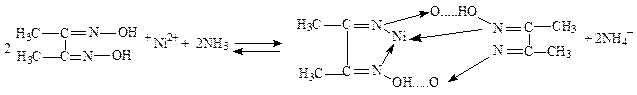
Реакции мешают ионы Cu2+, Fe3+. Если проводить её капельным методом, то она очень специфична.
Выполнение реакции. В центр фильтровальной бумаги помещают:
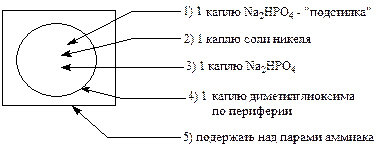
В присутствии Ni2+ образуется ярко-розовое окрашивание.
Роль Na2HPO4 заключается в том, что он связывает мешающие катионы в труднорастворимые фосфаты (Сu3(PO4)2; FePO4), которые остаются в центре пятна. А более растворимый Ni3(PO4)2 располагается по периферии пятна, где и открывается диметилглиоксимом.
 Анализируемая смесь включает
Анализируемая смесь включает
Ni 2+ , Co 2+ , Cu 2+
Дробно из исходного раствора

Ni2+- + 2H2Dm → Ni[HDm]2
/капельно/ диметиглиоксим комплекс розового цвета
/реактив Чугаева/
 Сo2++4SCN- → [Co(SCN)4]2-
Сo2++4SCN- → [Co(SCN)4]2-
голубой комплекс
 Сu2+ + [Fe(CN)6]4-→ Cu2[Fe(CN)6]↓
Сu2+ + [Fe(CN)6]4-→ Cu2[Fe(CN)6]↓
«шоколад»
Схема анализа катионов V аналитической группы
Вопросы для повторения
1. Написать уравнения реакций, происходящих при добавлении раствора щёлочи к смеси катионов пятой группы.
2. Какие вещества получатся, если к смеси катионов пятой группы прибавить небольшое количество аммиака? Написать уравнения реакций.
3. Какие вещества получаются при добавлении избытка аммиака к смеси катионов пятой группы?
4. Написать уравнения реакций, происходящих при добавлении растворов щёлочи и перекиси водорода.
5. Напишите уравнения реакций ионов V группы с эквивалентным количеством и избытком раствора аммиака.
6. При действии на смесь катионов пятой группы избытка аммиака образуется сине-фиолетовый раствор. Какой ион присутствует в смеси? Напишите уравнение реакции.
7. При действии щёлочи на смесь катионов пятой группы выпал осадок голубого цвета. Какие ионы могут быть в смеси, если при нагревании осадок:
а) чернеет; б) розовеет? Напишите уравнения реакций.
8. Предложите схему анализа смеси катионов V группы.
9. Напишите реакцию растворения основного карбоната никеля в избытке раствора аммиака.
10. Каких катионов пятой группы нет в растворе, если при добавлении тиосульфата натрия к кислому раствору и нагревании не образуется чёрного осадка?
11. Подберите коэффициенты: t
CuSO4 + Na2S2O3 +H2O ® Cu2S¯ + S¯ + H2SO4
12. Какой осадок выпадает при добавлении раствора соды к соли меди? Напишите уравнение реакции. Дайте объяснение.
13. Объясните, почему раствор смеси катионов пятой группы имеет кислую реакцию? Напишите уравнения реакций.
14. Какая реакция происходит при открытии иона никеля диметилглиоксимом? Почему нужна щелочная среда?
15. Напишите реакции взаимодействия иона кобальта с перекисью водорода в щелочной среде и растворения получившегося осадка в соляной кислоте.
16. Напишите реакцию, позволяющую открыть и замаскировать ион меди (II).
Шестая группа катионов
Шестую группу образуют катионы К+, NH4+ которые не осаждаются ни кислотами, ни щелочами. Эта группа не имеет группового реагента. Открывают их дробным методом в начале анализа.
Лабораторная работа № 6
«Изучение свойств катионов VI аналитической группы и анализ их смеси»
Цель работы: изучение свойств солей, гидроксидов ионов К+, NH4+ ; знакомство с методами разделения и обнаружения.
Калий
Реакция с гексанитрокобальтатом (III) натрия Na3[Co(NO2)6]. Данный реагент с катионами калия образует жёлтый кристаллический осадок двойной комплексной соли кобальта (III):
2KCl + Na3[Co(NO2)6] ® K2Na[Co(NO2)6]¯ + 2NaCl
гексанитрокобальтат (III)
калия-натрия
2K+ + Na+ + [Co(NO2)6]3- ® K2Na[Co(NO2)6]¯
ярко-жёлтый
Реакцию можно проводить в пробирке или на стекле. Выполнение реакции: к капле раствора соли калия приливают 1-2 капли раствора Na3[Co(NO2)6], дают постоять, образуется хорошо различимый осадок ярко-жёлтого цвета, нерастворимый в уксусной кислоте.
Аммоний
Реакция со щёлочью NaOH. Взаимодействие солей аммония с NaOH или КОН приводит к выделению аммиака при нагревании:
t
NH4Cl + NaOH ® NH3 + H2O + NaCl
Выполнение реакции рассмотрено ниже.
Реакция с реактивом Несслера. Реактив Несслера - щелочной раствор комплексной соли тетраиодомеркурата (II) калия K2[HgI4]+KOH. При взаимодействии реагента с солями аммония образуется красно-бурый осадок по реакции:
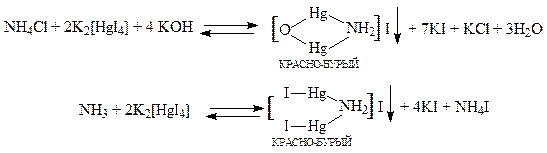
Реактив Несслера содержит щёлочь, которая с большинством катионов даёт осадок труднорастворимых гидроксидов, многие из которых окрашены.
Их образование мешает наблюдению осадка, образующегося в присутствии иона NH4+. Для устранения этого недостатка реакцию проводят в газовой камере.
Выполнение реакции:
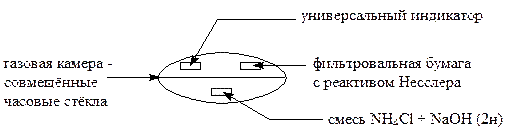
На одно часовое стекло нанести 2 капли соли аммония и 2 капли 2н раствора NaOH; на другое стекло поместить универсальный индикатор, смоченный водой, и фильтровальную бумагу, смоченную реактивом Несслера. Бумажки не должны соприкасаться. Накрыть вторым стеклом первое, камеру поместить на ладонь. Через некоторое время фильтровальная бумага, смоченная реактивом Несслера, окрашивается в бурый цвет, а универсальный индикатор синеет вследствие образования гидроксид - ионов по реакции
NH3 + H2O ® NH4OH ® NH4+ + OH-
V и VI аналитических групп
Внешний вид
Так как соли катионов пятой группы окрашены, то по окраске раствора смеси можно предположить о наличии тех или иных ионов пятой группы. Катионы шестой группы бесцветны.
Анализ смеси производится дробным методом.
22.2. Открытие и отделение иона NH4+
В отдельной пробе (2-3 капли задачи) открыть катион аммония в газовой камере реакциями со щёлочью и реактивом Несслера. Сделать вывод.
Если открыт ион NH4+ , то его необходимо удалить, так как он мешает открытию иона К+. Для удаления иона аммония пользуются летучестью солей аммония при нагревании в щелочной среде.
Открытие иона калия
Обнаружить ион калия мешают катионы тяжёлых металлов: Cu2+, Co2+, Ni2+. Поэтому их нужно сначала отделить.
Для этого к 5-6 каплям анализируемой смеси добавить один шпатель сухой соды Na2CO3, смесь, перемешивая, нагревать 6-10 минут. При этой операции катионы пятой группы переходят в осадок (1) в виде гидроксокарбонатов, а ион NH4+ удаляется в виде NH3. В растворе (1), после центрифугирования, открывают ион калия реакцией с гексанитрокобальтатом (III) натрия (после доведения рН раствора до 4 или 5 путём добавления СН3СООН). Для ускорения выпадения осадка реакционную смесь нужно нагреть. Образование жёлтого осадка K2Na[Co(NO2)6] свидетельствует о присутствии иона К+.
Открытие иона никеля
Капельной реакцией с диметилглиоксимом открыть катион никеля. Ярко-розовое окрашивание свидетельствует о наличии иона никеля.
22.5. Открытие иона меди
В отдельной пробе открыть ион меди (II) реакцией с гексацианоферратом (II) калия. Образование красно-коричневого осадка (напоминающего шоколад) говорит о присутствии катиона меди.
Открытие иона кобальта
Если открыт ион меди (II), то его присутствие будет мешать обнаружению иона кобальта. Поэтому к 2-3 каплям анализируемой смеси добавить 4 капли изоамилового спирта, затем сухой KSCN. В присутствии чёрного осадка Cu(SCN)2 не виден синий комплекс кобальта K2[Co(SCN)4]. Чтобы избавиться от чёрного цвета, нужно добавить несколько кристалликов сухого Na2SO3, пробирку встряхнуть. Появление синего кольца свидетельствует о присутствии катиона Со2+.
По выполненной работе составить подробный отчет, сделать вывод о составе полученной смеси ионов.
Вопросы для повторения
1. Почему метод анализа называется кислотно-основным? Какие кислоты и щелочи применяются для разделения катионов по группам?
2. Полученная задача содержит белый осадок и имеет кислую реакцию. Какие соли могут входить в осадок?
3. Какие катионы открываются дробным методом в начале задачи?
4. Раствор смеси катионов шести групп бесцветен. Каких ионов не может быть в задаче?
5. К смеси катионов шести групп (задача без осадка) добавили соляной кислоты. Осадок не выпал. Каких ионов нет в смеси? К каким группам они относятся?
6. К смеси катионов шести групп (задача без осадка) добавили серную кислоту. Осадок не выпал. Каких ионов нет в смеси? К каким группам они относятся?
7. К смеси катионов шести групп (задача без осадка) добавили избыток щелочи. Осадок сначала выпал, а потом полностью растворился. Какие ионы могут находиться в смеси? Написать уравнения реакций.
8. К смеси катионов шести групп (задача без осадка) добавили избыток раствора аммиака. Осадок сначала выпал, а потом полностью растворился. Какие ионы могут находиться в смеси? Написать уравнения реакций.
9. В смеси находятся ионы Ag+, Ba2+, Mn2+. Какими реакциями можно разделить эти ионы? Написать уравнения всех реакций.
10. В смеси находятся ионы Ag+, Ba2+, Fe2+. Укажите все возможные способы разделения этих ионов и напишите все уравнения реакций.
11. В смеси находятся ионы Нg22+, Cr3+.Напишите реакции разделения этих ионов.
12. Какими реакциями можно отделить друг от друга ионы Ba2+, Zn2+, Fe2+, Co2+? Написать уравнения всех реакций.
13. Какими реакциями можно разделить катионы Bi3+, Cu2+ и Na+? Напишите уравнения всех реакций.
14. Каким способом можно разделить ионы Fe2+, Cd2+ и Cr3+? Написать уравнения реакций.
15. Каким путем можно разделить ионы Ag+ и Ba2+, если они находятся в виде осадков AgCl и BaSO4? Написать уравнения реакций.
16. Осадок содержит труднорастворимые соли PbSO4 и SrSO4. Как можно разделить ионы Pb2+ и Sr2+? Можно ли открыть эти ионы при их совместном присутствии?
17. Дана задача на шесть групп в виде раствора, имеющего сильнощелочную реакцию. Какие ионы и в виде каких соединений могут быть в смеси?
18. Осадок содержит Fe(OH)3, Cd(OH)3, Ag2O. Какими реакциями можно отделить друг от друга ионы Fe3+, Cd2+, Ag+? Написать уравнения всех реакций.
Анионы
Анионы делятся на три группы:
I группа : SO42-, CO32-, PO43-. Групповым реагентом является хлорид бария при рН»7. При этом образуются белые осадки;
II группа : Cl-, I-, S2-. Групповым реагентом является раствор AgNO3 в присутствии азотной кислоты (рН£2). При этом выпадают белый (AgCl), желтоватый (AgI) и чёрный (Ag2S) осадки.
III группа: анион NO3-, группового реагента нет.
В большинстве случаев анионы можно открывать дробным методом, поэтому групповые реагенты применяются только для обнаружения той или иной группы анионов.
Лабораторная работа № 7
«Изучение свойств анионов и анализ их смеси»
Цель работы: изучение свойств солей ионов SO42-, СО32-, РО43-, Cl-, I-, S2-, NO3- ; знакомство с методами разделения и обнаружения.
Реакции обнаружения анионов
25.1. Сульфат-ион SO42-
Реакция с хлоридом бария в кислой среде.2-3 капли исследуемого раствора подкислить соляной кислотой и прибавить 2-3 капли хлорида бария. В присутствии сульфат-иона выпадает белый, нерастворимый в кислой среде осадок BaSO4. Мешает ион S2-.
25.2. Карбонат-ион СО32-
Реакция с известковой водой: в одно колено двойной пробирки налить 0,5 мл известковой воды Са(ОН)2, а в другое - пять капель исследуемого раствора и соляной кислоты. Закрыть пробирку пробкой. Известковая вода в присутствии углекислого газа мутнеет:
СО32-+ 2Н+ ® СО2 + Н2О
СО2 + Са(ОН)2 ® СаСО3¯ + Н2О
Реакция с соляной кислотой: несколько капель задачи осторожно упарить на предметном стекле и на сухой остывший осадок прилить раствор HCl. Интенсивное выделение пузырьков газа СО2 свидетельствует о наличии карбонат-ионов.
25.3 Фосфат-ион РО43-
Открывается реакцией с молибденовой жидкостью. К 1-2 каплям исследуемого раствора прилить 8-10 капель молибденовой жидкости (раствор (NH4)2MoO4 в HNO3), нагреть в водяной бане. Через некоторое время выпадает кристаллический осадок фосфоромолибдата аммония:
PO43- + 3NH4+ + 12 MоO42- + 24H+ ® (NH4)3[PMо12O40]¯ + 12H2O
Осадок выпадает только при большом избытке молибденовой жидкости. Мешают реакции ионы-восстановители: S2- , Cl-.
25.4. Хлорид-ион Cl-
Реакция с нитратом серебра: к 2-3 каплям исследуемого раствора прилить азотной кислоты до рН=2, 2-3 капли нитрата серебра AgNO3. Выпадает белый творожистый осадок AgCl. Мешают ионы S2- и I-.
25.5. Иодид ион I-
Окисление нитритом натрия. В пробирку прилить 3-4 капли исследуемого раствора, подкислить кислотой до рН<7 и бросить несколько кристалликов NaNO2. Выделяется свободный иод - раствор окрашивается в бурый цвет или выпадают кристаллы тёмно серого цвета:
NO2- + 2H+ + 2I- ® I2 + NO + H2O
Выделяющийся газ NO окисляется на воздухе до NO2 бурого цвета. Так как оксиды азота ядовиты, реакцию следует проводить в вытяжном шкафу.
25.6. Сульфид ион S2-
Реакция с нитропруссидом натрия: к 1-2 каплям исходного раствора прилить щёлочи до рН>7 и 1-2 капли нитропруссида натрия Na2[Fe(CN)5NO]. Раствор окрашивается в красно-фиолетовый цвет. Реакция с ионом S2- идёт только в щелочной среде:
Na2[Fe(CN)5NO] + Na2S ® Na4[Fe(CN)5NOS]
Ионы S2- можно обнаружить по запаху сероводорода при подкислении раствора соляной кислотой.
25.7. Нитрат-ион NO3-
Реакция с солью Мора
На предметное стекло насыпать горкой сухой соли Мора (NH4)2SO4хFeSO4. С одной стороны этой горки налить 1 каплю концентрированной серной кислоты, а с другой - исследуемый раствор. В середине появляется тёмное пятно:
6Fe2+ + 2NO3- + 8H+ ® 6Fe3+ + 2NO + 4H2O
NO + Fe2+ + SO42- ® [Fe(NO)SO4]
Реакции мешают иодид-ионы, поэтому их сначала удаляют.
Реакция с дифениламином. Если отсутствует иодид-ион I-, то к 2 каплям исследуемого раствора прилить 2 капли дифениламина. Если наблюдается посинение раствора, то нитрат-ион присутствует.
Таблица 7
Вопросы для повторения
1. Назовите анионы-восстановители. Напишите реакцию восстановления одним из этих анионов перманганата калия в кислой среде.
2. Дан кислый раствор на смесь анионов. Каких анионов не может быть в этой смеси?
3. Смесь растворов солей натрия и разных кислот имеет нейтральную реакцию. Какие анионы могут находиться в смеси? Почему?
4. К раствору, содержащему смесь анионов, добавили кислоту до рН<7. Начали выделяться пузырьки газа. Какие анионы могут быть в растворе?
5. К раствору, содержащему смесь анионов в кислой среде, прилили нитрат серебра, осадок не выпал. Каких ионов нет в смеси? К какой группе они относятся?
6. Напишите реакцию восстановления перманганата калия сульфид-ионом в кислой среде.
7. Напишите реакцию восстановления перманганата калия сульфит-ионом в кислой среде.
8. Напишите реакцию восстановления перманганата калия гидроксид-ионом в кислой среде.
9. К раствору, содержащему смесь анионов, в нейтральной среде прилили хлорид бария, осадок не выпал. Каких ионов нет в смеси?
10. Смесь растворов солей натрия и разных кислот имеет щелочную реакцию. Какие анионы могут присутствовать в растворе?
11. К раствору, содержащему смесь анионов, добавили нитрат серебра. Выпал черный осадок. Какой анион присутствует в смеси?
12. К раствору, содержащему смесь анионов, добавили нитрат серебра. Выпал светлый осадок. Какого аниона нет в смеси?
13. Можно ли обнаружить карбонат-ион в присутствии сульфат-иона? Почему?
14. К смеси анионов добавили кислый раствор перманганата калия. Раствор обесцветился. Какие анионы могут присутствовать в смеси?
15. К смеси анионов добавили кислый раствор перманганата калия. Раствор не обесцветился. Каких анионов нет в смеси?
Анализ индивидуальной соли
Задача может быть в виде раствора или в виде сухой соли.
Анализ раствора
Обратить внимание на окраску раствора. Определить рН раствора и сделать соответствующие выводы.
Проба на катионы VI группы
К 2 каплям задачи прилить 2 капли Na2CO3 до рН>7. Если нет осадка или мути - могут присутствовать катионы только VI группы. В этом случае по очереди открывают ионы NH4+ и К+ в исследуемом растворе.
Если при действии раствора Na2CO3 выпадает осадок, то присутствует один из катионов группы, кроме шестой. Чтобы определить, к какой группе относится катион, к отдельным пробам прибавляют последовательно групповые реагенты на I-V группы.
Проба на катионы I группы
К 2 каплям задачи прибавить 2 капли НСl. Если образуется муть или осадок, то в задаче есть катионы I группы. В этом случае начинают последовательно открывать катионы Pb2+, Hg22+, Ag+.
Прба на катионы II группы
К двум каплям задачи прилить 2 капли серной кислоты. Если через 6-10 минут образуется муть, то в задаче присутствуют катионы II группы. В этом случае начинают последовательно открывать катионы Ва2+, Sr2+, Са2+.
Проба на катионы V группы
К 2 каплям задачи прилить по каплям концентрированный раствор аммиака до сильного запаха. Если ранее появившийся осадок растворяется, то в задаче присутствуют катионы V группы.
Обнаружение аниона соли
Открыв катион соли и учитывая растворимость солей в воде, кислотах, рН раствора соли, нетрудно определить, к какой группе относится анион. Неплохо воспользоваться групповыми реактивами для обнаружения I и II групп анионов. Затем по очереди открывают анионы данной группы, используя специфические реактивы. Если присутствуют тяжёлые катионы, то их надо удалить действием раствора соды, а затем в центрифугате открывать анионы.
Анализ сухой соли
Анализ начинают с подбора растворителя: взять для пробы минимальное количество сухой соли(1-2 кристаллика) и около 10 капель растворителя. Сначала нужно попытаться растворить соль в холодной воде,а если не растворяется, то нагреть.
Если в воде соль не растворится, то растворять её в кислоте, постепенно повышая силу кислоты (в уксусной, соляной, азотной кислотах на холоде и при нагревании). Иногда соль растворяется в щёлочи или её надо переводить в раствор выщелачиванием насыщенным раствором соды (BaSO4, SrSO4). Добившись растворения, готовят раствор (примерно 10%) и анализируют его.
По выполненной работе составить подробный отчет, сделать вывод о составе полученной смеси ионов.
Контрольные задачи
1. Для смеси катионов написать реакции:
а) разделение на отдельные ионы;
б) обнаружение каждого иона;
в) действие избытка NaOH или NH4OH на каждый ион.
2. Написать реакцию обнаружения аниона.
| Номер варианта | Катионы | Анионы |
| 1 | NH4+, Zn2+, Fe3+, Mg2+ | SO42- |
| 2 | K+, Al3+, Bi3+, Cu2+ | SO32- |
| 3 | Ag+, Ba2+, Mn2+, Zn2+ | CO32- |
| 4 | Pb2+, Al3+, Sr2+, K+ | Cl- |
| 5 | Hg22+, Ba2+, Zn2+, Mg2+ | I- |
| 6 | Ag+, Zn2+, Al3+, Ni2+ | S2- |
| 7 | Pb2+, Ca2+, Cr3+, Cu2+ | NO3- |
| 8 | K+, Bi3+, Co2+, Fe3+ | NO2- |
| 9 | Ag+, Ba2+, Al3+, Cr2+ | S2- |
| 10 | Ca2+, Pb2+, Cr3+, NH4+ | SO32- |
| 11 | Hg22+, Cr3+, NH4+, Mn2+ | CO32- |
| 12 | Pb2+, Zn2+, Mg2+, NH4+ | SO42- |
| 13 | Cu2+, Ba2+,Cr3+, Mn2+ | PO43- |
| 14 | Ni2+, Cu2+, Mg2+, K+ | Cl- |
| 15 | Ag+, Ba2+, Bi3+, Mg2+ | I- |
Приложения
Произведение растворимости
некоторых малорастворимых электролитов при 25 0С
| Электролит | ПР | Электролит | ПР |
| 1 | 2 | 3 | 4 |
| AgBr | 5,3х10-13 | Fe(OH)3 | 4х10-38 |
| Ag2CO3 | 8,2х10-12 | FePO4 | 1,3х10-22 |
| AgCl | 1,8х10-10 | FeS | 5х10-18 |
| Ag2CrO4 | 1,1х10-12 | Hg2Cl2 | 1,3х10-18 |
| AgI | 8,3х10-17 | HgS | 1,6х10-52 |
| Ag2S | 6,3х10-50 | K2Na[Co(NO2)6] | 2,2х10-11 |
| Ag2SO4 | 1,6х10-5 | MgCO3 | 4х10-5 |
| Ag3PO4 | 1,3х10-20 | Mg(OH)2 | 5х10-12 |
| Al(OH)3 | 5х10-33 | MgNH4PO4 | 2,5х10-13 |
Продолжение
| 1 | 2 | 3 | 4 |
| AlPO4 | 5,7х10-19 | Mg3(PO4)2 | 1х10-13 |
| BaCO3 | 5,1хх10-9 | MnCO3 | 1,8х10-11 |
| BaCrO4 | 1,2х10-10 | Mn(OH)2 | 4х10-14 |
| BaSO4 | 1,1х10-10 | MnS | 2,5х10-10 |
| Ba3(PO4)2 | 6х10-39 | Ni(OH)2 | 2х10-15 |
| BiOOH | 4х10-10 | PbBr2 | 9,1х10-6 |
| BiOCl | 1,8х10-31 | PbCO3 | 7,5х10-14 |
| BeCO3 | 1х10-3 | PbCl2 | 1,56х10-5 |
| CaCO3 | 4,8х10-9 | PbF2 | 2,7х10-8 |
| CaF2 | 4х10-11 | PbI2 | 1,1х1010-9 |
| CaHPO4 | 2,7х10-7 | PbS | 2,5х10-27 |
| Ca(H2PO4)2 | 1х10-3 | PbSO4 | 1,6х10-8 |
| CaSO4 | 9,1х10-8 | Pb3(PO4)2 | 7,9х10-43 |
| Ca3(PO4)2 | 2х10-29 | Sb2S3 | 1,6х10-93 |
| CaS | 7,9х10-27 | SrCO3 | 1,1хх10-10 |
| CoCO3 | 1,4х10-13 | SrCrO4 | 3,6х10-5 |
| Co(OH)2 | 2х10-16 | SrF2 | 2,5х10-9 |
| α-CoS | 4х10-21 | SrSO4 | 3,2х10-7 |
| β-CoS | 2х10-25 | ZnCO3 | 1,4х10-14 |
| CrPO4 | 1х10-17 | Zn(OH)2 | 5х10-17 |
| CuCO3 | 2,5х10-10 | α-ZnS | 1,6х10-24 |
| Cu(OH)2 | 1,6х10-19 | β-ZnS | 2,5х10-22 |
| CuS | 6,3х10-36 | Zn3(PO4)2 | 9,1х10-33 |
| Сu2[Fe(CN)6] | 1,3х10-16 | ||
| Fe(OH)2 | 5х10-16 |
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Алексеев В.Н. Курс качественного химического полумикроанализа. -М.: Химия,1979.- 584 с.
2. Бессероводородные методы качественного полумикроанализа /под общ. ред. Крешкова А.П. –М.: Высш.шк. 1971. -222 с.
3. Васильев В.П. Аналитическая химия: В четырех частях. –М.: Высш.шк., 2004.
4. Васильев А.М. Сборник задач по аналитической химии.–М.: Госхимиздат.- 1985, 275 с.
5. Золотов Ю.А. Основы аналитической химии.кн.1.-М.: Высш.шк.,2004.-360 с.
6. Лурье Ю.Ю. Справочник по аналитической химии. –М.: Химия 1971.- 453 с.
7. Мурашова В.И., Тананаева А.Н., Ховякова Р.Ф. Качественный химический дробный анализ. –М.: Химия, 1976.- 279 с.
8. Харитонов Ю.Я. Аналитическая химия. Аналитика 1. Общие теоретические основы. Качественный анализ. –М.: Высш. шк.,2001.- 615с.
Содержание
| Введение | 3 |
| Техника выполнения реакций | 4 |
| Условия выполнения реакций | 4 |
| Дробный и систематический анализ | 6 |
| Классификация катионов в качественном химическом кислотно-основном полумикроанализе | 6 |
| Методика выполнения основных операций полумикроанализа | 7 |
| Первая группа катионов | 9 |
| Анализ смеси катионов I аналитической группы (схема) | 12 |
| Вторая группа катионов | 15 |
| Анализ катионов II аналитической группы (схема) | 18 |
| Анализ раствора смеси катионов I и II аналитических групп (без сульфатов) | 20 |
| Третья группа катионов | 22 |
| Анализ смеси катионов III группы (схема) | 27 |
| Анализ смеси катионов I, II и III групп (схема) | 29 |
| Четвёртая группа катионов | 30 |
| Анализ смеси катионов IV группы (схема) | 37 |
| Анализ раствора смеси катионов III и IV аналитических групп (схема) | 40 |
| Пятая группа катионов | 43 |
| Анализ смеси катионов V группы (схема) | 48 |
| Шестая группа катионов | 49 |
| Анализ раствора смеси катионов V и VI аналитических групп (схема) | 50 |
| Анализ смеси катионов IV, V и VI аналитических групп (схема) | 51 |
| Анализ смеси катионов шести групп (схема) | 54 |
| Анионы | 60 |
| Анализ смеси анионов I, II, III групп | 63 |
| Анализ индивидуальной соли | 64 |
| Контрольные задачи | 66 |
| Приложения | 66 |
| Библиографический список | 72 |
Учебное издание
Салова Леонора Евгеньевна, Чанышева Альфия Тагировна,
Молявко Мария Александровна
Аналитическая химия
Л.Е. Салова, А.Т. Чанышева, М.А. Молявко
АНАЛИТИЧЕСКАЯ ХИМИЯ
Дата: 2019-02-02, просмотров: 533.