Степень окисления
Все металлы, образующие катионы этой группы, являются S-элементами второй группы ПСМ (ns2) и образуют соединения со степенью окисления +2. В окислительно-восстановительных процессах не участвуют.
Свойства гидроксидов
Гидроксиды этих элементов Ca(OH)2, Sr(OH)2, Ba(OH)2 являются сильными основаниями, в воде растворимость их увеличивается от Ca(OH)2 к Ba(OH)2. Получить их можно непосредственным растворением в воде оксидов или самих металлов.
Гидролиз солей
Поскольку основные свойства здесь выражены сильно, соли металлов II группы, образованные сильными кислотами, не подвергаются гидролизу и имеют в растворе реакцию, близкую к нейтральной (рН»6). Следовательно, гидролизу могут подвергаться только растворы солей слабых кислот, которые имеют щелочную реакцию.
4.4. Комплексообразование
Катионы Ca2+, Sr2+, Ba2+ как типичные S-элементы не образуют устойчивых комплексов.
Окраска соединений
Ионы Ca2+, Sr2+, Ba2+ имеют законченные 8-электронные оболочки. В водных растворах эти ионы бесцветны.
Техника безопасности
При проведении анализа второй группы катионов соблюдать общие правила по технике безопасности в химических лабораториях. Растворимые соли бария и стронция ядовиты.
Лабораторная работа №2
«Изучение свойств катионов II аналитической группы и анализ их смеси»
Цель работы: изучение свойств солей, гидроксидов ионов Ca2+, Sr2+, Ba2+; знакомство с методами разделения и обнаружения.
Общие реакции катионов II группы
Проделать реакции катионов с веществами, представленными в табл. 3. Записать уравнения реакций.
Таблица 3
| Реактив | Катионы | ||
| Ca2+ | Sr2+ | Ba2+ | |
| 1. H2SO4 | CaSO4¯ белый, выпадает не сразу | SrSO4¯ белый | BaSO4¯ белый |
| 2. Na2CO3 | CaCO3¯ белый | SrCO3¯ белый | BaCO3¯ белый |
| 3. K2CrO4 (pH=7) | - | SrCrO4¯ жёлтый | BaCrO4¯ жёлтый |
| 4. K2Cr2O7+ CH3COONa | - | - | BaCrO4¯ жёлтый |
Реакции обнаружения катионов второй группы
Барий
К 2-3 каплям растворимой соли бария прилить 3-4 капли раствора K2Cr2O7. Реакцию проводят в присутствии ацетата натрияCH3COONa. Эта реакция используется не только для открытия ионов бария, но и для отделения его от ионов кальция и стронция.
2BaCl2 + K2Cr2O7 + H2O « 2BaCrO4¯ + 2KCl + 2HCl
жёлтый
2Ba2+ + Cr2O72- + H2O « 2BaCrO4¯ + 2H+
Бихромат калия образует с ионом Ba2+ жёлтый осадок BaCrO4, а не BaCr2O7, как можно было бы ожидать. Растворимость хромата бария меньше, чем бихромата бария (ПР BaCrO4=1,8*10-14, ПР BaCr2O7=1,2*10-9), поэтому концентрация ионов CrO42-, имеющихся в растворе данного равновесия:
Cr2O72- + H2O « 2Cr2O42- + 2H+,
достаточна, чтобы образовался именно BaCrO4.
Полнее реакция осаждения хромата бария идёт в присутствии избытка ацетата натрия, понижающего концентрацию образующих катионов водорода с образованием слабой кислоты СН3СООН:
СН3СОО- + Н+ ® СН3СООН
Избыток СН3СООNа создаёт ацетатную буферную смесь, поддерживающую значение рН»5.
Нейтрализовать ионы водорода щёлочью нельзя, так как при больших значениях рН выпадает жёлтый осадок хромата стронция и реакция становится неспецифичной.
Кальций
Микрокристаллоскопическая реакция. С помощью этой реакции можно открыть ионы кальция в присутствии небольших количеств других ионов. 1 каплю раствора соли кальция нанести на предметное стекло и добавить 1 каплю H2SO4 2н и слегка подсушить на воздухе так, чтобы подсох только край капли. Образующиеся красталлы гипса CaSO4*2H2O имеют игольчатую форму (напоминающую снежинки) при рассмотрении под микроскопом (рис. 1). Открытию иона кальция мешает большая концентрация ионов Ba2+.
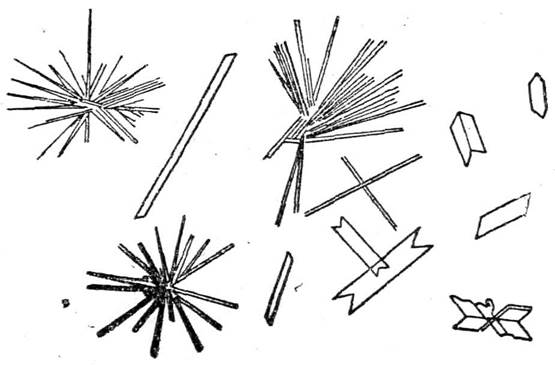
Рис. 1. Кристаллы сульфата кальция
Стронций
К двум каплям соли стронция прилить 2-3 капли раствора (NH4)2SO4. В результате реакции выпадает белый осадок SrSO4¯.
Sr(NO3)2 + (NH4)2SO4 ® SrSO4¯ + 2NH4NO3
Обнаружению ионов Sr2+ мешают ионы Ca2+ и Ba2+.
5.4.Метод выщелачивания. В ходе анализа вторую группу катионов выделяют в виде соответствующих сульфатов, а так как они не растворяются в кислотах, их сначала переводят в карбонаты выщелачиванием. Метод выщелачивания заключается в следующем: к осадку сульфатов добавляют сухую соду Na2CO3 (1,5 микрошпателя) и 2 мл воды, раствор тщательно перемешивают, кипятят в течение 5-6 минут, затем центрифугируют. Центрифугат выливают, а к осадку опять добавляют Na2CO3 и воду, греют и центрифугируют. Процесс протекает по схеме
MeSO4¯ + CO32- ®MeCO3¯ + SO42-
осадок избыток осадок
Повторить операцию 2-3 раза, осадок промывают от ионов SO42- водой и растворяют в уксусной кислоте:
 CO2
CO2
 MeCO3 + 2CH3COOH ® Me(CH3COO)2 + H2CO3
MeCO3 + 2CH3COOH ® Me(CH3COO)2 + H2CO3
H2O
Чаще всего BaSO4 полностью не превращается в карбонат, поэтому небольшая часть этого осадка может остаться. Проверить, отмыт ли осадок от ионов SO42-, можно так: к 2-3 каплям промывной воды добавить 2н НСl до рН<7 и ВаСl2. Если после этого выпадает осадок, то промыть ещё раз. После полного отмывания осадка от ионов SO42- растворить его в уксусной кислоте.
После этой операции приступают к анализу смеси второй группы катионов.
Дата: 2019-02-02, просмотров: 420.