Механизм индукции цитохрома Р450 1А1
Поможем в ✍️ написании учебной работы
 Рис. 4. ПАУ-соединения - типичные индукторы CYP1А Лигандами для AhR яляются планарные молекулы типа ПАУ. Позднее был найден еще более мощный индуктор, 2,3,7,8- тетрахлордибензо-р-диоксин (ТХДД), способный из-за высокой аффинности к Ah-рецептору вызывать индукцию в дозах, на порядок меньших, чем для других ПАУ. Наличие в клетке рецептора для соединения, произведенного человеком относительно недавно, остается загадкой для исследователей. Возможно, что ТХДД мимикрирует какое-то эндогенное природное соединение, способное связываться с Ah-рецептором. Такие соединения были найдены в некоторых растениях. Как показали эксперименты с нокаутными мышами, возможно также существование и эндогенного лиганда, схожего по структуре с ТХДД.
Рис. 4. ПАУ-соединения - типичные индукторы CYP1А Лигандами для AhR яляются планарные молекулы типа ПАУ. Позднее был найден еще более мощный индуктор, 2,3,7,8- тетрахлордибензо-р-диоксин (ТХДД), способный из-за высокой аффинности к Ah-рецептору вызывать индукцию в дозах, на порядок меньших, чем для других ПАУ. Наличие в клетке рецептора для соединения, произведенного человеком относительно недавно, остается загадкой для исследователей. Возможно, что ТХДД мимикрирует какое-то эндогенное природное соединение, способное связываться с Ah-рецептором. Такие соединения были найдены в некоторых растениях. Как показали эксперименты с нокаутными мышами, возможно также существование и эндогенного лиганда, схожего по структуре с ТХДД. 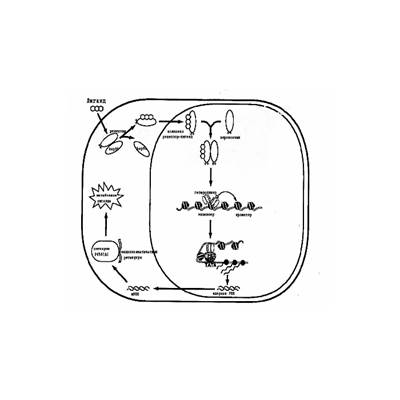 Рис. 5. Схема индукции цитохрома Р4501А1 Общепринятая на сегодняшний день схема активации гена CYP1А1 приведена на рис. 5. В отсутствие индуктора Ah-рецептор связан с белком теплового шока hsp90, который представляет собой компонент системы шейперонов, регулирующих стероид - и диоксин-зависимые пути передачи сигнала. В этом случае взаимодействия белок-белок осуществляются через PAS-домен Ah-рецептора. Точная роль hsp90 в индукции CYP1А1 не определена, хотя полагают, что он поддерживает конфигурацию Ah-рецептора в состоянии, способствующем взаимодействию с лигандом. В цитоплазме Ah-рецептор и hsp90 также взаимодействуют с белком 37-38кД, гомологичным FK506-связывающим белкам, имеющим три тетратрикопептидных повтора. Усиление экспрессии этого белка сопровождается почти 2-х кратным усилением индукции CYP1А1. Роль этого белка в индукции CYP1А1 также неясна. Возможно, он может влиять на взаимодействие Ah-рецептора с лигандом и/или способствовать его транслокации в ядро. Ah-рецептор относится к семейству факторов транскрипции, названных “helix-loop-helix/PAS”, т.е. спираль-петля-спираль, содержащих PAS домен, благодаря которому осуществляется взаимодействие с другим белковым фактором ARNT (Ah Receptor Nuclear Translocator), что необходимо для активации транскрипции гена CYP1А. В результате гетеродимеризации этих белков, которая происходит в ядре, образуется ДНК связывающий фактор транскрипции. ARNT экспрессируется во многих тканях. Нокаутные по этому белку мыши погибали на 10-ый день развития, что, возможно, отражает участие ARNT как фактора транскрипции в сигнальной трансдукции. Гетеродимеризации ARNT и Ah-рецептора осуществляется через HLH и PAS домены, в результате чего положительно заряженные области белков могут распознать XRE элементы ДНК. Исследование ДНК-белковых взаимодействий показало, что ARNT связывается с 5’ GTG 3’ областью ХRЕ, а Ah – с соседним нуклеотидом. Промотор содержал несколько сайтов связывания для базальных факторов транскрипции, включая ТАТА-связывающие белки (ТВР). Анализ мутаций в области промотора показал, что ТВР-связывающие сайты также необходимы для транскрипции гена CYP1А1. Когда энхансеры неактивны, промотор не функционирует, следовательно, взаимодействие белков с проксимальными элементами гена является индуцибельным и зависит от активации Ah-рецептора и ARNT белка. Эти результаты представляются интересными, так как из них следует несколько важных выводов: 1. Промотор находится под контролем энхансера; 2. Должен существовать механизм, поддерживающий промотор в неактивном состоянии; 3. Взаимодействие энхансера с промотором является необходимым этапом в активации транскрипции гена CYP1А1. Таким образом, Ah-рецептор и ARNT белок усиливают транскрипцию гена CYP1А1. Показано также, что с XRE могут взаимодействовать также молекулы, не относящиеся к рецепторам. К настоящему времени сформировалось представление о том, что события, следующие после связывания комплекса с-Src-Ah-рецептор с лигандом, могут протекать в двух независимых направлениях: 1. Этот комплекс может транслоцироваться в ядро, как это уже было описано выше, и связываться со специфическими XRE (DRE)-элементами; 2. Активация Ah-рецептора усиливает активность тирозинкиназ, в результате чего возрастает транспорт глюкозы, усиливаются процессы фосфорилирования, а также активность липопротеинлипазы. Этот, так называемый DRE-независимый путь играет существенную роль в развитии токсических процессов, вызванных диоксинами и другими ПАУ-соединениями. Cуществует также негативная регуляция, в том числе в различных тканях и видах животных. Было показано, что некоторые ДНК-связывающие белки могут конкурировать за связывание с цис-активными элементами. Обнаружены также цис-активные негативные элементы, которые ингибируют конститутивную и индуцируемую транскрипцию гена CYP1А1. Молекулярные механизмы этого явления остаются невыясненными. Помимо того, что Ah-рецептор регулирует экспрессию генов CYP1А, он также определяет токсичность многих ПАУ-соединений. Исследования по изучению зависимости структура-активность с использованием инбредных линий мышей, различающихся по чувствительности к индукции этими соединениями, показали, что многие галогенированные полициклические углеводороды, связываясь с Ah-рецептором, индуцируют не только CYP1А, но и проявляют высокую токсичность. Эти данные, дополненные экспериментами с Ah-нокаутными мышами, которые оказались устойчивыми к токсическому действию ТХДД, подтвердили гипотезу, что ксенобиотики, подобные ТХДД, реализуют биохимические и токсические эффекты через Ah-рецептор. Наличие этого белка, содержание которого широко варьирует для многих видов животных и во многих тканях, а также его способность связываться с лигандами и активировать экспрессию многих генов, дало возможность предположить, что токсическое действие ПАУ осуществляется через изменение экспрессии генов в чувствительных клетках.
Рис. 5. Схема индукции цитохрома Р4501А1 Общепринятая на сегодняшний день схема активации гена CYP1А1 приведена на рис. 5. В отсутствие индуктора Ah-рецептор связан с белком теплового шока hsp90, который представляет собой компонент системы шейперонов, регулирующих стероид - и диоксин-зависимые пути передачи сигнала. В этом случае взаимодействия белок-белок осуществляются через PAS-домен Ah-рецептора. Точная роль hsp90 в индукции CYP1А1 не определена, хотя полагают, что он поддерживает конфигурацию Ah-рецептора в состоянии, способствующем взаимодействию с лигандом. В цитоплазме Ah-рецептор и hsp90 также взаимодействуют с белком 37-38кД, гомологичным FK506-связывающим белкам, имеющим три тетратрикопептидных повтора. Усиление экспрессии этого белка сопровождается почти 2-х кратным усилением индукции CYP1А1. Роль этого белка в индукции CYP1А1 также неясна. Возможно, он может влиять на взаимодействие Ah-рецептора с лигандом и/или способствовать его транслокации в ядро. Ah-рецептор относится к семейству факторов транскрипции, названных “helix-loop-helix/PAS”, т.е. спираль-петля-спираль, содержащих PAS домен, благодаря которому осуществляется взаимодействие с другим белковым фактором ARNT (Ah Receptor Nuclear Translocator), что необходимо для активации транскрипции гена CYP1А. В результате гетеродимеризации этих белков, которая происходит в ядре, образуется ДНК связывающий фактор транскрипции. ARNT экспрессируется во многих тканях. Нокаутные по этому белку мыши погибали на 10-ый день развития, что, возможно, отражает участие ARNT как фактора транскрипции в сигнальной трансдукции. Гетеродимеризации ARNT и Ah-рецептора осуществляется через HLH и PAS домены, в результате чего положительно заряженные области белков могут распознать XRE элементы ДНК. Исследование ДНК-белковых взаимодействий показало, что ARNT связывается с 5’ GTG 3’ областью ХRЕ, а Ah – с соседним нуклеотидом. Промотор содержал несколько сайтов связывания для базальных факторов транскрипции, включая ТАТА-связывающие белки (ТВР). Анализ мутаций в области промотора показал, что ТВР-связывающие сайты также необходимы для транскрипции гена CYP1А1. Когда энхансеры неактивны, промотор не функционирует, следовательно, взаимодействие белков с проксимальными элементами гена является индуцибельным и зависит от активации Ah-рецептора и ARNT белка. Эти результаты представляются интересными, так как из них следует несколько важных выводов: 1. Промотор находится под контролем энхансера; 2. Должен существовать механизм, поддерживающий промотор в неактивном состоянии; 3. Взаимодействие энхансера с промотором является необходимым этапом в активации транскрипции гена CYP1А1. Таким образом, Ah-рецептор и ARNT белок усиливают транскрипцию гена CYP1А1. Показано также, что с XRE могут взаимодействовать также молекулы, не относящиеся к рецепторам. К настоящему времени сформировалось представление о том, что события, следующие после связывания комплекса с-Src-Ah-рецептор с лигандом, могут протекать в двух независимых направлениях: 1. Этот комплекс может транслоцироваться в ядро, как это уже было описано выше, и связываться со специфическими XRE (DRE)-элементами; 2. Активация Ah-рецептора усиливает активность тирозинкиназ, в результате чего возрастает транспорт глюкозы, усиливаются процессы фосфорилирования, а также активность липопротеинлипазы. Этот, так называемый DRE-независимый путь играет существенную роль в развитии токсических процессов, вызванных диоксинами и другими ПАУ-соединениями. Cуществует также негативная регуляция, в том числе в различных тканях и видах животных. Было показано, что некоторые ДНК-связывающие белки могут конкурировать за связывание с цис-активными элементами. Обнаружены также цис-активные негативные элементы, которые ингибируют конститутивную и индуцируемую транскрипцию гена CYP1А1. Молекулярные механизмы этого явления остаются невыясненными. Помимо того, что Ah-рецептор регулирует экспрессию генов CYP1А, он также определяет токсичность многих ПАУ-соединений. Исследования по изучению зависимости структура-активность с использованием инбредных линий мышей, различающихся по чувствительности к индукции этими соединениями, показали, что многие галогенированные полициклические углеводороды, связываясь с Ah-рецептором, индуцируют не только CYP1А, но и проявляют высокую токсичность. Эти данные, дополненные экспериментами с Ah-нокаутными мышами, которые оказались устойчивыми к токсическому действию ТХДД, подтвердили гипотезу, что ксенобиотики, подобные ТХДД, реализуют биохимические и токсические эффекты через Ah-рецептор. Наличие этого белка, содержание которого широко варьирует для многих видов животных и во многих тканях, а также его способность связываться с лигандами и активировать экспрессию многих генов, дало возможность предположить, что токсическое действие ПАУ осуществляется через изменение экспрессии генов в чувствительных клетках.Дата: 2019-02-02, просмотров: 720.