Хлорид цинка и нитрат хрома ( III ) образованы сильной кислотой и слабым основанием, поэтому реакци я среды кисл ая , pH < 7.
К NO 3
К OH + HNO 3
Сильн . сильн
Нитрат калия образован сильным основанием и сильной кислотой, гидролизу не подвергается, поэтому реакция среды – нейтральная, рН = 7.
3. Написать полное молекулярное уравнение по данному сокращенному ионно-молекулярному уравнению:
Ca 2+ + C О 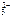 → CaC О3↓.
→ CaC О3↓.
Ответ: для написания молекулярного уравнения ионы Ca 2+ и C О 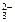 берем из растворимых солей (см. таблицу растворимости). Вторая образующаяся в результате реакции соль в молекулярном уравнении должна быть растворима.
берем из растворимых солей (см. таблицу растворимости). Вторая образующаяся в результате реакции соль в молекулярном уравнении должна быть растворима.
С aCl 2 + Na 2 CO 3 → CaCO 3 ↓ + 2 NaCl
растворимая растворимая осадок растворима
соль соль соль
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ
УРОВЕНЬ А
Расположить перечисленные вещества в порядке уменьшения степени окисления хрома:
Cr 2 O 3 – CrCl 2 – K 2 Cr 2 O 7 .
Ответ: алгебраическая сумма степеней окисления отдельных атомов, образующих молекулу, с учетом стехиометрических индексов равна нулю.
Cr Х С l 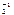 С r
С r 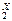 O
O 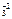
Х + (–1) ∙ 2 = 0 Х ∙ 2 + (–2) ∙ 3 = 0
Х = +2 Х = +3
K 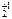 Cr
Cr 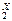 O
O 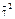
(+1) ∙ 2 + Х ∙ 2 + (–2) · 7 = 0
Х = +6
K2Cr 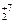 O7 – Cr
O7 – Cr 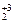 O3 – Cr+2Cl2.
O3 – Cr+2Cl2.
2. Составить уравнения для следующих процессов и назвать их:
а ) Ni0 → Ni+2
б ) 2I- → I2
в ) Cu+2 → Cu0
Ответ:
а) Ni 0 – 2е = Ni +2 – процесс окисления;
б) 2 I  – 2е = I 2 0 – процесс окисления;
– 2е = I 2 0 – процесс окисления;
в) Cu +2 + 2е = Cu 0 – процесс восстановления.
3. Какие свойства (окислительные или восстановительные) проявляют PbO 2 ; H 2 S ; KMnO 4 ?
Ответ: окислители – атомы, молекулы или ионы, присоединяющие электроны, а восстановители – отдающие электроны. Поэтому чем выше степень степень окисления иона, тем сильнее он проявляет окислительные свойства, а чем ниже степень окисления иона – тем сильнее его восстановительные свойства.
Pb +4 O 2 – окислитель H 2 S -2 – восстановитель
KMn +7 O 4 – окислитель
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.
КОРРОЗИЯ МЕТАЛЛОВ.
УРОВЕНЬ А
1. Железная деталь находится в кислой коррозионной среде. Определить, какими из металлов возможно осуществить анодную защиту детали: а) Ti ; б) Ni ; в) Cu ; г) Zn .
Ответ обосновать значениями стандартных электродных потенциалов.
Ответ: по табл. 11.1 определяем стандартные электродные потенциалы титана, никеля, меди, цинка и железа ( II ):
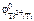 = –1,63 В;
= –1,63 В; 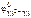 = -0,25 В;
= -0,25 В; 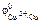 = +0,34 В;
= +0,34 В;
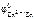 = –0,76В;
= –0,76В; 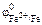 = –0,44 В.
= –0,44 В.
Так как анодную защиту железной детали можно осуществить металлами с 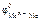 <
< 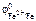 , то искомыми металлами являются а) Ti ; г) Zn .
, то искомыми металлами являются а) Ti ; г) Zn .
2. Написать уравнение Нернста для определения электродного потенциала металлического и водородного электродов. Указать единицы измерения.
Ответ: 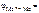
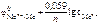 , В;
, В;
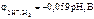 .
.
3. Из приведенного ряда металлов выбрать те, которые могут служить катодом при стандартных условиях в гальванических элементах, анод у которых цинковый: а) Mn ; б) Bi ; в) Al ; г) Sn .
Дата: 2018-12-28, просмотров: 303.