Ответ:
ΔраствН °(298К) = 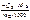 =
= 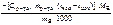 , кДж/моль.
, кДж/моль.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
УРОВЕНЬ А
1. Написать формулу связи Кр с термодинамическими функциями.
Ответ: ∆ r G º (298 K ) = ∆ r H º (298 K ) – T ∆ r S º (298 K ) = –2,3 RT lg Kp .
2. Написать формулу зависимости скорости реакции от температуры и Еакт.
Ответ: 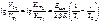 .
.
Написать формулу зависимости скорости реакции от присутствия в системе катализатора.
Ответ: 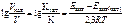 .
.
6. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
УРОВЕНЬ А
1. Написать формулы закона Рауля для водных растворов неэлектролитов и электролитов (давление насыщенного пара).
Ответ:
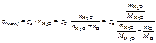 , кПа
, кПа
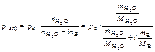 , кПА.
, кПА.
2. Написать формулы закона Рауля для водных растворов неэлектролитов и электролитов: а) изменения температур кипения растворов; б) изменения температур замерзания растворов.
Ответ:
а) 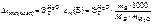 ;
;
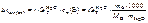 ;
;
б) 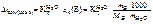 ;
;
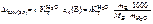
Написать формулы закона Вант-Гоффа для водных растворов неэлектролитов и электролитов.
Ответ:
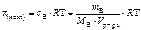 , кПа;
, кПа;
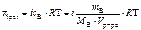 , кПа.
, кПа.
РАСТВОРЫ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ. ИОННО-МОЛЕКУЛЯРНЫЕ УРАВНЕНИЯ
УРОВЕНЬ А
1. Написать выражение ПР и привести их табличное значение для следующих соединений PbCl 2 и Ag 2 S .
Ответ: PbCl 2( к) <=> Pb 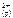 + 2 Cl
+ 2 Cl 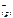 ;
;
ПР 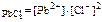 = 2 ∙ 10-5;
= 2 ∙ 10-5;
Ag2S( к ) <=> 2 Ag 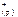 +S
+S 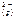 ;
;
ПР 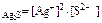 = 5,7 ∙ 10-51,
= 5,7 ∙ 10-51,
т.е. растворимость Ag 2 S значительно меньше растворимости PbCl 2 .
2. Написать уравнения диссоциации, выражения констант диссоциации и привести их табличное значение для H 2 S .
Ответ: поскольку H 2 S – слабый электролит, то процесс диссоциации является обратимым и протекает ступенчато:
| 1-я ступень: H 2 S <=> H + + HS - ; | |
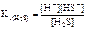 =6,0·10-8. =6,0·10-8.
| |
| 2-я ступень: HS - <=> Н+ + S 2- ; | |
 =1,0·10-14. =1,0·10-14.
|
Поскольку 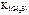 больше
больше 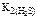 в 6∙106 раз, то можно считать, что диссоциация H 2 S протекает в основном по первой ступени.
в 6∙106 раз, то можно считать, что диссоциация H 2 S протекает в основном по первой ступени.
3. Определить силу электролитов и написать уравнения диссоциации сильных электролитов:
Zn(OH)2; HCl; H3PO4; NaOH; HCN.
Ответ : поскольку к сильным относятся кислоты HCl, HBr, HJ, HNO3, H2SO4, HClO4, а к сильным основаниям относятся LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, то
Zn ( OH )2 – слабый электролит; HCl – сильный электролит; H 3 PO 4 – слабый электролит; NaOH – сильный электролит, HCN – слабый электролит.
Диссоциация сильных электролитов на ионы протекает нацело:
HCl = H+ + Cl-;
NaOH = Na+ + OH-.
8. ГИДРОЛИЗ СОЛЕЙ
УРОВЕНЬ A
1. Какие из перечисленных солей подвергаются гидролизу: NH 4 NO 2 , Na 2 CO 3 , Al 2 ( SO 4 )3, NaNO 3 ?
О твет : любую соль можно представить как продукт взаимодействия кислоты и основания:
NH4NO2 Na2CO3
NH4OH + HNO2 NaOH + H2CO3
слаб . слаб . сильн . слаб .
Al2 (SO4)3 NaNO3
Al(OH)3 + H2SO4 NaOH + HNO3
слаб . сильн . сильн. сильн.
Гидролизу подвергаются соли, которые образованы при взаимодействии слабой кислоты и слабого основания; слабой кислоты и сильного основания; сильной кислоты и слабого основания; это соли N H 4 NO 2 , Na 2 CO 3 , Al 2 ( SO 4 )3. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются ( NaNO 3 ).
2. Указать реакцию среды водных растворов солей K 2 SO 3 , ZnCl 2 , Cr ( NO 3 )3, KNO 3 .
Ответ :
K2SO3
KOH + H2SO3
сильн . слаб.
Реакция среды определяется сильным электролитом, участвующим в образовании соли. Сульфит калия образован слабой кислотой и сильным основанием, поэтому реакция среды щелочная, рН > 7.
ZnCl2 Cr(NO3)3
Zn(OH)2 + HCl Cr(OH)3 + HNO3
Дата: 2018-12-28, просмотров: 309.