1) Cs 2 O ; 2) BeO ; 3) SO 2 ; 4) ВаО.
Ответ: 1) Cs 2 O – основной оксид; 2) BeO – амфотерный оксид;
3) SiO 2 – кислотный оксид; 4) ВаО – основной оксид.
2. Указать тип предложенных солей:
1) FeOHCl ; 2) Al 2 ( SO 4 )3; 3) NaHS ; 4) Na 2 SiO 3 .
Ответ: 1) FeOHCl – основная соль; 2) Al 2 ( SO 4 )3 – средняя соль;
3) NaHS – кислая соль; 4) Na 2 SiO 3 –средняя соль.
3. Написать формулы кислот, которым соответствуют следующие ангидриды:
1) N 2 O 5 ; 2) SnO 2 ; 3) SO 3 ; 4) As 2 O 3 .
Ответ: Элемент, образующий ангидрид, проявляет одинаковую степень окисления и в ангидриде, и в соответствующей ему кислоте:
1) N+52O5 – HN+5O3; 2) Sn+4O2 – H2Sn+4O3;
3) S+6O3 – H2S+6O4; 4) As+32O3 – H3As+3O3.
2. ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
УРОВЕНЬ А
1.Определить число моль эквивалентов металла, содержащегося в 40 г Са.
Ответ:
nэк(Ме) = 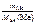 , моль;
, моль;
Мэк(Ме) = 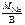 , г/моль,
, г/моль,
где В – валентность металла.
МСа = 40 г/моль, В Са = 2 (см. Периодическую систему элементов);
Мэк(Са) = 40/2 = 20 г/моль. Тогда в 40 г Са содержится nэк(Ме) =
= 40 : 20 = 2 моль эквивалентов металла.
2.Определить молярную массу эквивалента оксида хрома (III).
Ответ:
Мэк(Сr2O3) = Мэк(Сr) + Mэк(О);
Мэк(Сr) = 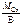 ,
,
где В – валентность хрома, равная 3.
Мэк(О) = 8 г/моль;
Мэк(Сr2O3) = 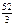 + 8 = 17,33 г/моль.
+ 8 = 17,33 г/моль.
3.Определить молярную массу эквивалента карбоната натрия.
Ответ:
Мэк(Na2CO3) = 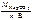 ,
,
где n – число атомов натрия в молекуле соли;
В – валентность натрия, равная 1.
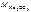 = 2·23+12+3·16 = 106 г/моль.
= 2·23+12+3·16 = 106 г/моль.
Мэк(Na2CO3) = 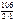 =53 г/моль.
=53 г/моль.
СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ
УРОВЕНЬ А
Записать выражение массовой доли растворенного вещества. Указать единицу измерения.
Ответ:
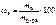 , %.
, %.
Записать выражение молярной доли растворенного вещества.
Ответ:
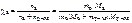 .
.
Записать выражение молярной концентрации вещества. Указать единицу измерения.
Ответ:
с в = 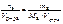 , моль/л.
, моль/л.
Записать выражение молярной концентрации эквивалентов вещества. Указать единицу измерения.
Ответ:
с эк (в) = 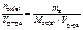 , моль/л.
, моль/л.
Записать выражение моляльности вещества в растворе. Указать единицу измерения.
с m (в) = 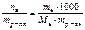 , моль/кг.
, моль/кг.
Записать выражение титра раствора вещества. Указать единицу измерения.
Ответ:
T в = 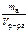 , г/см3.
, г/см3.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
УРОВЕНЬ А
1. Указать, какие из приведенных реакций являются эндотермическими:
а) Mn (к) + 1/2 O 2(г) = MnO (к) ;
б) 1/2 N 2(г) + 3/2 H 2(г) = NH 3(г) ;
в) 1/2 N 2(г) + 1/2 O 2(г) = NO (г) .
Решение
Так как данные реакции являются реакциями образования 1 моль сложного вещества из простых веществ, то изменение энтальпии приведенных процессов есть стандартная энтальпия образования этих веществ. Для определения теплового эффекта (изменения энтальпии) реакции из таблицы выписываем значения стандартных энтальпий образования: MnO (к) ), NH 3(г) , NO (г) :
ΔfH о (298 К, MnO (к) ) = –384,93 кДж/моль;
ΔfH о (298 К, NH 3(г) ) = –46,2 кДж/моль;
ΔfH о = (298 К, NO (г) ) = 90,3 кДж/моль.
Реакции а, б имеют отрицательные значения изменения энтальпии, а реакция в – положительное значение изменения энтальпии. Эндотермическими являются те реакции, изменения энтальпии которых имеют положительные значения.
Ответ: в).
2. Без использования табличных данных определить, для каких из перечисленных реакций изменение энтропии имеет положительное значение:
а) CO (г) + H 2(г) = C (к) + H 2 O (г) ;
б) 2 Cu ( NO 3 )2(к) = 2 CuO (к) + 4 NO 2(г) + O 2(г) ;
в) 2 PbS (к) + 3 O 2(г) = 2 PbO (к) + 2 SO 2(г) .
Решение
Так как наибольшее значение стандартной энтропии имеют вещества, находящиеся в газообразном состоянии, то энтропия увеличивается, если в ходе реакции возрастает число газовых моль (реакция б)). При протекании реакций а и в наблюдается уменьшение числа газовых моль системы. Следовательно, изменение энтропии данных реакций имеет отриательное значение.
Ответ: б).
Дата: 2018-12-28, просмотров: 336.