ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
УРОВЕНЬ А
Указать химический характер предложенных оксидов:
1) Cs 2 O ; 2) BeO ; 3) SO 2 ; 4) ВаО.
Ответ: 1) Cs 2 O – основной оксид; 2) BeO – амфотерный оксид;
3) SiO 2 – кислотный оксид; 4) ВаО – основной оксид.
2. Указать тип предложенных солей:
1) FeOHCl ; 2) Al 2 ( SO 4 )3; 3) NaHS ; 4) Na 2 SiO 3 .
Ответ: 1) FeOHCl – основная соль; 2) Al 2 ( SO 4 )3 – средняя соль;
3) NaHS – кислая соль; 4) Na 2 SiO 3 –средняя соль.
3. Написать формулы кислот, которым соответствуют следующие ангидриды:
1) N 2 O 5 ; 2) SnO 2 ; 3) SO 3 ; 4) As 2 O 3 .
Ответ: Элемент, образующий ангидрид, проявляет одинаковую степень окисления и в ангидриде, и в соответствующей ему кислоте:
1) N+52O5 – HN+5O3; 2) Sn+4O2 – H2Sn+4O3;
3) S+6O3 – H2S+6O4; 4) As+32O3 – H3As+3O3.
2. ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
УРОВЕНЬ А
1.Определить число моль эквивалентов металла, содержащегося в 40 г Са.
Ответ:
nэк(Ме) = 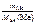 , моль;
, моль;
Мэк(Ме) = 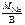 , г/моль,
, г/моль,
где В – валентность металла.
МСа = 40 г/моль, В Са = 2 (см. Периодическую систему элементов);
Мэк(Са) = 40/2 = 20 г/моль. Тогда в 40 г Са содержится nэк(Ме) =
= 40 : 20 = 2 моль эквивалентов металла.
2.Определить молярную массу эквивалента оксида хрома (III).
Ответ:
Мэк(Сr2O3) = Мэк(Сr) + Mэк(О);
Мэк(Сr) = 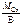 ,
,
где В – валентность хрома, равная 3.
Мэк(О) = 8 г/моль;
Мэк(Сr2O3) = 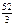 + 8 = 17,33 г/моль.
+ 8 = 17,33 г/моль.
3.Определить молярную массу эквивалента карбоната натрия.
Ответ:
Мэк(Na2CO3) = 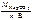 ,
,
где n – число атомов натрия в молекуле соли;
В – валентность натрия, равная 1.
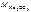 = 2·23+12+3·16 = 106 г/моль.
= 2·23+12+3·16 = 106 г/моль.
Мэк(Na2CO3) = 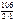 =53 г/моль.
=53 г/моль.
СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ
УРОВЕНЬ А
Записать выражение массовой доли растворенного вещества. Указать единицу измерения.
Ответ:
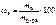 , %.
, %.
Записать выражение молярной доли растворенного вещества.
Ответ:
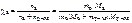 .
.
Записать выражение молярной концентрации вещества. Указать единицу измерения.
Ответ:
с в = 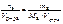 , моль/л.
, моль/л.
Записать выражение молярной концентрации эквивалентов вещества. Указать единицу измерения.
Ответ:
с эк (в) = 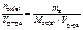 , моль/л.
, моль/л.
Записать выражение моляльности вещества в растворе. Указать единицу измерения.
с m (в) = 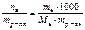 , моль/кг.
, моль/кг.
Записать выражение титра раствора вещества. Указать единицу измерения.
Ответ:
T в = 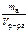 , г/см3.
, г/см3.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
УРОВЕНЬ А
1. Указать, какие из приведенных реакций являются эндотермическими:
а) Mn (к) + 1/2 O 2(г) = MnO (к) ;
б) 1/2 N 2(г) + 3/2 H 2(г) = NH 3(г) ;
в) 1/2 N 2(г) + 1/2 O 2(г) = NO (г) .
Решение
Так как данные реакции являются реакциями образования 1 моль сложного вещества из простых веществ, то изменение энтальпии приведенных процессов есть стандартная энтальпия образования этих веществ. Для определения теплового эффекта (изменения энтальпии) реакции из таблицы выписываем значения стандартных энтальпий образования: MnO (к) ), NH 3(г) , NO (г) :
ΔfH о (298 К, MnO (к) ) = –384,93 кДж/моль;
ΔfH о (298 К, NH 3(г) ) = –46,2 кДж/моль;
ΔfH о = (298 К, NO (г) ) = 90,3 кДж/моль.
Реакции а, б имеют отрицательные значения изменения энтальпии, а реакция в – положительное значение изменения энтальпии. Эндотермическими являются те реакции, изменения энтальпии которых имеют положительные значения.
Ответ: в).
2. Без использования табличных данных определить, для каких из перечисленных реакций изменение энтропии имеет положительное значение:
а) CO (г) + H 2(г) = C (к) + H 2 O (г) ;
б) 2 Cu ( NO 3 )2(к) = 2 CuO (к) + 4 NO 2(г) + O 2(г) ;
в) 2 PbS (к) + 3 O 2(г) = 2 PbO (к) + 2 SO 2(г) .
Решение
Так как наибольшее значение стандартной энтропии имеют вещества, находящиеся в газообразном состоянии, то энтропия увеличивается, если в ходе реакции возрастает число газовых моль (реакция б)). При протекании реакций а и в наблюдается уменьшение числа газовых моль системы. Следовательно, изменение энтропии данных реакций имеет отриательное значение.
Ответ: б).
Ответ:
ΔраствН °(298К) = 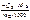 =
= 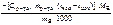 , кДж/моль.
, кДж/моль.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
УРОВЕНЬ А
1. Написать формулу связи Кр с термодинамическими функциями.
Ответ: ∆ r G º (298 K ) = ∆ r H º (298 K ) – T ∆ r S º (298 K ) = –2,3 RT lg Kp .
2. Написать формулу зависимости скорости реакции от температуры и Еакт.
Ответ: 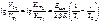 .
.
УРОВЕНЬ А
1. Написать формулы закона Рауля для водных растворов неэлектролитов и электролитов (давление насыщенного пара).
Ответ:
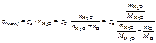 , кПа
, кПа
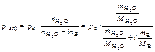 , кПА.
, кПА.
2. Написать формулы закона Рауля для водных растворов неэлектролитов и электролитов: а) изменения температур кипения растворов; б) изменения температур замерзания растворов.
Ответ:
а) 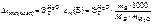 ;
;
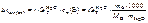 ;
;
б) 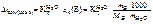 ;
;
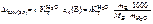
УРОВЕНЬ А
1. Написать выражение ПР и привести их табличное значение для следующих соединений PbCl 2 и Ag 2 S .
Ответ: PbCl 2( к) <=> Pb 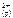 + 2 Cl
+ 2 Cl 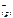 ;
;
ПР 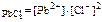 = 2 ∙ 10-5;
= 2 ∙ 10-5;
Ag2S( к ) <=> 2 Ag 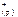 +S
+S 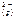 ;
;
ПР 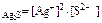 = 5,7 ∙ 10-51,
= 5,7 ∙ 10-51,
т.е. растворимость Ag 2 S значительно меньше растворимости PbCl 2 .
2. Написать уравнения диссоциации, выражения констант диссоциации и привести их табличное значение для H 2 S .
Ответ: поскольку H 2 S – слабый электролит, то процесс диссоциации является обратимым и протекает ступенчато:
| 1-я ступень: H 2 S <=> H + + HS - ; | |
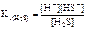 =6,0·10-8. =6,0·10-8.
| |
| 2-я ступень: HS - <=> Н+ + S 2- ; | |
 =1,0·10-14. =1,0·10-14.
|
Поскольку 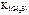 больше
больше 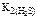 в 6∙106 раз, то можно считать, что диссоциация H 2 S протекает в основном по первой ступени.
в 6∙106 раз, то можно считать, что диссоциация H 2 S протекает в основном по первой ступени.
3. Определить силу электролитов и написать уравнения диссоциации сильных электролитов:
Zn(OH)2; HCl; H3PO4; NaOH; HCN.
Ответ : поскольку к сильным относятся кислоты HCl, HBr, HJ, HNO3, H2SO4, HClO4, а к сильным основаниям относятся LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, то
Zn ( OH )2 – слабый электролит; HCl – сильный электролит; H 3 PO 4 – слабый электролит; NaOH – сильный электролит, HCN – слабый электролит.
Диссоциация сильных электролитов на ионы протекает нацело:
HCl = H+ + Cl-;
NaOH = Na+ + OH-.
8. ГИДРОЛИЗ СОЛЕЙ
УРОВЕНЬ A
1. Какие из перечисленных солей подвергаются гидролизу: NH 4 NO 2 , Na 2 CO 3 , Al 2 ( SO 4 )3, NaNO 3 ?
О твет : любую соль можно представить как продукт взаимодействия кислоты и основания:
NH4NO2 Na2CO3
NH4OH + HNO2 NaOH + H2CO3
слаб . слаб . сильн . слаб .
Al2 (SO4)3 NaNO3
Al(OH)3 + H2SO4 NaOH + HNO3
слаб . сильн . сильн. сильн.
Гидролизу подвергаются соли, которые образованы при взаимодействии слабой кислоты и слабого основания; слабой кислоты и сильного основания; сильной кислоты и слабого основания; это соли N H 4 NO 2 , Na 2 CO 3 , Al 2 ( SO 4 )3. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются ( NaNO 3 ).
2. Указать реакцию среды водных растворов солей K 2 SO 3 , ZnCl 2 , Cr ( NO 3 )3, KNO 3 .
Ответ :
K2SO3
KOH + H2SO3
сильн . слаб.
Реакция среды определяется сильным электролитом, участвующим в образовании соли. Сульфит калия образован слабой кислотой и сильным основанием, поэтому реакция среды щелочная, рН > 7.
ZnCl2 Cr(NO3)3
Zn(OH)2 + HCl Cr(OH)3 + HNO3
Сильн . сильн
Нитрат калия образован сильным основанием и сильной кислотой, гидролизу не подвергается, поэтому реакция среды – нейтральная, рН = 7.
3. Написать полное молекулярное уравнение по данному сокращенному ионно-молекулярному уравнению:
Ca 2+ + C О 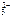 → CaC О3↓.
→ CaC О3↓.
Ответ: для написания молекулярного уравнения ионы Ca 2+ и C О 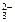 берем из растворимых солей (см. таблицу растворимости). Вторая образующаяся в результате реакции соль в молекулярном уравнении должна быть растворима.
берем из растворимых солей (см. таблицу растворимости). Вторая образующаяся в результате реакции соль в молекулярном уравнении должна быть растворима.
С aCl 2 + Na 2 CO 3 → CaCO 3 ↓ + 2 NaCl
растворимая растворимая осадок растворима
соль соль соль
УРОВЕНЬ А
Ответ: окислители – атомы, молекулы или ионы, присоединяющие электроны, а восстановители – отдающие электроны. Поэтому чем выше степень степень окисления иона, тем сильнее он проявляет окислительные свойства, а чем ниже степень окисления иона – тем сильнее его восстановительные свойства.
Pb +4 O 2 – окислитель H 2 S -2 – восстановитель
KMn +7 O 4 – окислитель
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.
КОРРОЗИЯ МЕТАЛЛОВ.
УРОВЕНЬ А
1. Железная деталь находится в кислой коррозионной среде. Определить, какими из металлов возможно осуществить анодную защиту детали: а) Ti ; б) Ni ; в) Cu ; г) Zn .
УРОВЕНЬ А
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
УРОВЕНЬ А
1. Назвать следующие комплексные соединения: K 3 [ Fe ( CN )6]; [ PtCl 3 ( NH 3 )3] Cl ; [ Co ( NO 2 )3( NH 3 )3].
Ответ:
а) K 3 [ Fe ( CN )6] – гексацианоферрат ( III ) калия.
б) [ Pt ( NH 3 )3 Cl 3 ] Cl – хлорид трихлоротриамминплатины ( IV ).
в) [ Co ( NH 3 )3( NO 2 )3] – тринитротриамминкобальт.
Ответ :
Fe2+ + 6CN- <=> [Fe(CN)6]4-;
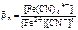 .
.
Pt4+ + 2NH3 + 2Cl- <=> [Pt(NH3)2Cl 2]2+;
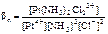 .
.
ЖЕСТКОСТЬ ВОДЫ
УРОВЕНЬ А
1. Какие из указанных соединений: Fe ( HCO 3 )2, CaCl 2 , MgSO 4 , Ca ( HCO 3 )2, Fe ( NO 3 )2, Mg ( HCO 3 )2, обусловливают:
а) постоянную жесткость воды;
б) временную жесткость воды?
Ответ: а) постоянная (некарбонатная) жесткость воды обусловлена присутствием в воде CaCl2, MgSO4, Fe(NO3)2;
б) временная (карбонатная) жесткость воды обусловлена присутствием в воде гидрокарбонатов Fe(HCO3)2, Ca(HCO3)2, Mg(HCO3)2.
УРОВЕНЬ А
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
УРОВЕНЬ А
Дата: 2018-12-28, просмотров: 302.