Содержание
| Пояснительная записка | 4 стр. |
| Лекция №1. Введение. Предмет и задачи микробиологии. История развития. | 7 стр. |
| Лекция № 2. Основные принципы классификации микроорганизмов. | 22 стр. |
| Лекция №3. Морфология и ультраструктура бактерий | 28 стр. |
| Лекция № 4 Морфология грибов, спирохет, простейших, риккетсий, микоплазм, вирусов. | 43 стр. |
| Лекция 5. Морфология вирусов. Вирусы бактерий - бактериофаги | 53 стр. |
| Лекция 6. Микроэкология. Роль микроорганизмов в круговороте веществ. Нормальная микрофлора организма человека. | 65 стр |
| Лекция 7 Действие физических и химических факторов на микроорганизмы. | 75 стр. |
| Лекция 8 Антибиотики. | 80 стр. |
| Использованная и рекомендуемая литература | 92 стр. |
Пояснительная записка
Основная цель лекционного курса по разделу «Общая микробиология» - формирование у будущего лаборанта - микробиолога научного мировоззрения о многообразии микроорганизмов и их роли в общебиологических процессах.
В задачи курса входит изучение студентами:
- принципов систематики, морфологии и физиологии, широты распространения микроорганизмов в природе
- особенностей биологии и экологии микроорганизмов;
- роли микробов в превращении веществ в природе и эффекты действия факторов внешней среды на прокариотические клетки,
- методов индикации и идентификации патогенных бактерий,
- основ учения об инфекции и иммунитете
- микроскопических, бактериологических, серологических, иммунологических, биологических методов исследования, используемых при диагностике инфекционных болезней.
В результате изучения курса студенты должны знать:
- теоретические основы жизнедеятельности микроорганизмов, их взаимодействия друг с другом и с организмом человека и животных
- основные биологические свойства патогенных микробов,
- принципы и способы диагностики и специфической профилактики инфекционных болезней.
Освоение программы, в соответствии с профессиональным модулем «Теория и практика лабораторных микробиологических исследований», рассчитано на 6 семестров.
Раздел «Общая микробиология » предусматривает 46 лекционных часов, распределенных на первые 3 семестра.
В 4, 5, 6 семестрах предусмотрено изучение частной микробиологии и вирусологии.
План лекций по дисциплине: Теория и практика лабораторных микробиологических исследований
(раздел «Общая микробиология», 3 семестр).
| Наименование тем лекций в соответствии с профессиональным модулем (ПМ.04) | Содержание учебного материала, | объем часов |
| 1 | 2 | 3 |
Курс 3 семестр
Лекция №1.
Развитие микробиологии.
За относительно короткий срок развития микробиология обогатила медицину блестящими достижениями и ее применение стало необходимым в разнообразных областях медицинской теории и практики. Практически нет ни одной отрасли медицины, не связанной с микробиологией, в которую, помимо бактериологии, сейчас входят вирусология, иммунология, микология, протозоология и паразитология.
Донаучный этап.
Задолго до открытия микроорганизмов человек сталкивался с процессами их жизнедеятельности. Люди использовали брожение теста и виноградного сока, сквашивание молока, получение пива, уксуса, при силосовании кормов, мочке льна. Издавна знакомы человечеству и повальные заболевания, уносившие население целых городов. Однако люди не знали вызывающих их истинных причин. Это не мешало делать наблюдения и использовать ряд этих процессов в быту. Ряд философов и естествоиспытателей делали умозрительные заключения о причинах тех или иных явлений.
Уже в трудах Гиппократа (460 - 377 д.н.э.) появляются предположения о связи заразных болезней и особых болезнетворных испарений, названных им «миазмами». В трудах Лукреция (95-55 д. н.э.) и Галена (131-211 д.н.э.) была высказана гипотеза о живой природе возбудителей заразных заболеваний.
Народы Азии имели определённые представления о заразности лепры (проказы) и проводили изоляцию больных. Авиценна считал, что причиной заразных болезней являются невидимые существа, передающиеся через воду и воздух.
Имея подобную гипотезу, наиболее близко к открытию микромира подошел итальянский врач Джироламо Фракасторо (1478—1553), предположивший, что инфекции вызывают маленькие тельца, передающиеся при контакте и сохраняющиеся на вещах больного. Он создал учение о живом «контагии» - о мельчайших и недоступных нашим чувствам частицах, которые, проникая, вызывают болезнь.
Гипотезу о том, что эти частицы живые существа, высказал в начале 17 века немецкий учёный, иезуит Афанасий (Анасиус) Кирхер (1602 -1680). Однако в то время невозможно было удостовериться в правильности идей Фракасторо и распространение получили совершенно иные гипотезы. Бактериальную природу инфекционных заболеваний многие учёные продолжали отвергать и после революционных открытий Пастера и Коха так, в 1892 Макс Петтенкофер, уверенный в том что холеру вызывают миазмы, выделяемые окружающей средой, и пытаясь доказать свою правоту, проглотил при свидетелях-медиках культуру холерных вибрионов.
 Рис. 1 Джиро́ламо Фракасто́ро (1478 - 1553) — венецианский врач и писатель.
Рис. 1 Джиро́ламо Фракасто́ро (1478 - 1553) — венецианский врач и писатель.
 Рис. 2 Атанасиус Кирхер (1602 – 1680) - немецкий учёный, иезуит, занимавшийся физикой, естественными науками, лингвистикой, древностями, теологией, математикой.
Рис. 2 Атанасиус Кирхер (1602 – 1680) - немецкий учёный, иезуит, занимавшийся физикой, естественными науками, лингвистикой, древностями, теологией, математикой.
Физиологический этап.
Последующее развитие микробиологии и становление ее как науки связаны с именем французского ученого Л. Пастера (1822—1895). Первые работы Пастер (химик по образованию) посвятил изучению асимметрии виннокислых солей и уже в этой области приобрел известность, открыв явление изомерии. Но во всем мире он получил признание благодаря изучению микробиологии, сделав ряд открытий. Именно его труды дали научные доказательства значения микроорганизмов в возникновении заразных заболеваний и обоснование для развития методов борьбы с ними.
Основные этапы деятельности Л. Пастера.
- Описал процессы брожения и гниения, показал, что они вызываются микроорганизмами, 1857.
- Впервые выявил новую форму жизни микроорганизмов – анаэробную, не требующую кислорода, а иногда даже гибнущей под его воздействием.
- Доказал, что самопроизвольного зарождения жизни не существует, в 1860-х показал что стерилизация делает брожение невозможным. Опыты Пастера показали, что микроорганизмы попадают в питательную среду из воздуха. Этот вопрос волновал учёных на протяжении долгого времени. ( Хотя ещё в 1775 г. русский исследователь М.М. Тереховский высказал мнение, что микроскопические существа не возникают путём самозарождения, но вопрос возникновения живого из неживого оставался спорным.) Так принцип omne vivum ex vivo (всё живое из живого) окончательно победил в биологии.
- Занимался болезнями вина и пива, 1865.
- Изучил болезни шелковичных червей, которые наносили огромный урон экономике Франции, нашёл причину поражения червей – их заболевания также были вызваны микробами, нашёл средство борьбы с ними, 1868.
- Разработал метод уничтожения микроорганизмов, при воздействии на них высокой температурой. Этот метод обеспложивания называют стерилизацией. Для пищевых продуктов, которые при кипячении изменяют свои свойства, он предложил более «мягкую» обработку, которую назвали пастеризацией.
- Доказал, что заразные болезни человека являются результатом жизнедеятельности микроорганизмов, это дало начало новой науке медицинской микробиологии.
- Создал вакцину (vacca – лат. корова) этим термином Пастер назвал ослабленную культуру микроорганизмов, введение которой не вызывает заболевание, но делает людей и животных невосприимчивыми к заболеванию. Пастер является основоположником профилактических прививок. В 1885г. предложил прививку против бешенства. Для создания этой вакцины он использовал материал от бешенной собаки, так как в чистом виде возбудителя бешенства не удавалось увидеть под микроскопом или вырастить на питательной среде. Первым от бешенства был вакцинирован ребенок, искусанный бешенной собакой, что спасло его от смерти. Следующим шагом была вакцинация русских крестьян, пришедших пешком в Париж, после укусов бешенного волка. На основе этого были созданы вакцины против сибирской язвы и холеры животных.
- Кроме того, в 1877 г. разработал метод получения чистых культур бактерий вне организма или той естественной природной среды, где микробы находятся, открыл новую эпоху в микробиологии и обеспечил ее развитие в ближайшие годы. Пастеру принадлежит честь открытия возбудителя куриной холеры, родильной горячки, септицемии, остеомиелита, одного из возбудителей газовой гангрены.
На основании открытий Пастера английский учёный Д. Листер в 1867 г. создал методы антисептики и септики – промывания ран и перевязочных материалов раствором карболовой кислоты, чтобы предотвратить микробное заражение.
1880-е и 1890-е ( «Золотой век» микробиологии) ознаменовались для микробиологии всплеском числа открытий. Во многом это было связано с подробной разработкой методологии. Прежде всего, здесь следует отметить вклад Роберта Коха (1843-1910), создавшем в конце 1870-х – начале 1880-х ряд новых методов и общих принципов ведения исследовательской работы. Впервые ввел в практику плотные питательные среды ( до этого использовались только жидкие питательные среды), позволившие получить отдельные колонии и чистую культуру. В 1887 году введены в практику чашки Петри. Кох впервые предложил использовать анилиновые красители для окраски бактерий (ранее использованные в ботанике), применил иммерсионную систему и микрофотографию, вел освещение при микроскопировании, используя конденсор Аббе.
Он открыл возбудителя туберкулёза, названного в честь учёного полочкой Коха (1882) и возбудителя холеры (1883)
Коху принадлежат также знаменитые постулаты:
- возбудитель заболевания должен регулярно обнаруживаться у пациента
- он должен быть выделен в чистую культуру
- выделенный организм должен вызывать у подопытных животных те же симптомы, что и у больного человека
Эти принципы были приняты не только в медицине, но и в экологии для определения вызывающих те или иные процессы организмов. Методы выращивания и выделения микроорганизмов, которые разработал Кох, привели к целому ряду других открытий и обогащению методологии: так в 1884 Ганс Кристиан Грам использовал метод дифференцирующего окрашивания бактерий (Метод Грама), Сергей Николаевич Виноградский в 1891 применил первую элективную среду. За следующие годы было описано больше видов чем за все предыдущее время, выделены возбудители опаснейших заболеваний, обнаружены новые процессы, производимые бактериями и неизвестные в других царствах природы. Были описаны возбудители дифтерии (Э. Клебс и Ф. Леффлер), брюшного тифа (К. Эберт и Г. Гаффки), столбняка (А. Николайер и С. Китазато), дизентерии (А.В. Григорьев и К. Шига) и другие. Открытие некоторых возбудителей инфекций, связаны и с драматическими страницами в истории медицины, так в1874 году профессор Казанского университета Г.Н. Минх заразил себя кровью больного возвратным тифом, доказав этим, что возбудитель данного заболевания находится в крови, он так же высказал предположение, что передаётся это заболевание через кровососущих насекомых. Через два года врач О.О. Мочутковский, повторив опыт Минха заразил себя кровью больных сыпным и возвратным тифом и подтвердил, что возбудители этих инфекционных заболеваний находятся в крови.
 Рис. 7 Луи́ Пасте́р (1822 - 1895) — французский микробиолог и химик, член Французской академии (1881).
Рис. 7 Луи́ Пасте́р (1822 - 1895) — французский микробиолог и химик, член Французской академии (1881).
 Рис. 8 Ге́нрих Ге́рман Ро́берт Кох (1843 - 1910) — немецкий микробиолог. За исследования туберкулёза награждён Нобелевской премией по физиологии и медицине в 1905 году.
Рис. 8 Ге́нрих Ге́рман Ро́берт Кох (1843 - 1910) — немецкий микробиолог. За исследования туберкулёза награждён Нобелевской премией по физиологии и медицине в 1905 году.
 Рис. 9 Серге́й Никола́евич Виногра́дский (1856 -1953) — выдающийся русский микробиолог, основатель экологии микроорганизмов и почвенной микробиологии.
Рис. 9 Серге́й Никола́евич Виногра́дский (1856 -1953) — выдающийся русский микробиолог, основатель экологии микроорганизмов и почвенной микробиологии.
 Рис. 10 Ганс Кристиан Йоахим Грам (1853 - 1938) — датский бактериолог.
Рис. 10 Ганс Кристиан Йоахим Грам (1853 - 1938) — датский бактериолог.
Иммунологический этап.
К началу данного периода учёными были разработаны научные основы, а их классические работы привели к созданию учения о фагоцитозе. Теория фагоцитоза была предложена И. И. Мечниковым в 1883 г. на VII съезде русских естествоиспытателей и врачей в Одессе. В противовес односторонней этиологической направленности мнения Коха и его учеников И. И. Мечников впервые научно аргументировал роль и активность самого организма в инфекционном процессе, объединив бактериологию с патологией, создав новое направление в медицине. В 1886 г. И. И. Мечников организовал и возглавил первую в России бактериологическую станцию в Одессе. Общественная деятельность И. И. Мечникова навлекла на него преследования царского правительства, и в 1888 г. ученый вынужден был покинуть родину. Последние 20 лет жизни он работал в Париже в Институте Пастера, но, оставаясь русским подданным, ученый - патриот часто приезжал в Россию, содействовал развитию отечественной медицинской науки. Совместно с французским микробиологом Эмилем Ру в 1903 г. И. И. Мечников разработал метод воспроизведения экспериментального сифилиса. Учение о фагоцитозе явилось основой для понимания сущности воспаления как активной реакции организма против микробов, в которой фагоцитарная активность клеток организма обеспечивает устойчивость, сформировавшуюся в процессе эволюционного развития человека. Одновременно с И. И. Мечниковым невосприимчивость к инфекционным болезням исследовал Пауль Эрлих (1854—1915), создавший гуморальную теорию иммунитета (от humor — жидкость). Эта теория основывалась на накапливающихся фактах, свидетельствующих о защитной роли сыворотки крови, которая содержит особые вещества — антитела. Были получены антитоксические сыворотки против ядов дифтерийной, столбнячной палочки, возбудителя ботулизма и др., примененные в лечении соответствующих заболеваний. Длительная и упорная борьба мнений между сторонниками клеточной и гуморальной теорий иммунитета стимулировала проведение большого числа исследований, результатом которых явились создание более совершенных лабораторных методов диагностики инфекционных болезней, получение вакцин для профилактики и другие полезные для практики предложения, а главное — установление общепризнанного теперь факта, что невосприимчивость к инфекционным заболеваниям зависит как от клеточного (фагоцитарного), так и от гуморального факторов. За разработку учения об иммунитете И. И. Мечников и П. Эр лих в 1908 г. были удостоены Нобелевской премии.
Современная иммунология родилась как учение о невосприимчивости к инфекционным заболеваниям. Многочисленные исследования в области иммунологии на протяжении нескольких десятилетий показали, что иммунитет является функцией не только фагоцитов. Главное значение иммунитета состоит в распознавании «своего» и «чужого». Эта идея, сыгравшая огромную роль в расширении границ иммунологии, принадлежит Ф. Бернету — известному австралийскому ученому, одному из крупнейших иммунологов современности.
Русскому ученому Д. И. Ивановскому принадлежит честь открытия фильтрующихся вирусов (1892). Опыты Д. И. Ивановского по методу выполнения были простыми: сок, выжатый из листьев табака, пораженных мозаичной болезнью, фильтровался через специальные каолиновые фильтры и фильтратом заражались свежие листья, в результате чего у растения развивалось заболевание. Год описания этих опытов (1892) считают годом открытия вирусов, а Д. И. Ивановского — первооткрывателем их и основоположником вирусологии, которая сейчас сформировалась в самостоятельную науку. Вслед за установленнием Д. И. Ивановским вирусной природы болезней растений были открыты вирусы, патогенные для животных и человека. Большим успехом отечественной вирусологии является история борьбы с трансмиссивными энцефалитами. Используя достижения науки, в 1937 г. группа ученых под руководством Л. А. Зильбера па Дальнем Востоке выделила вирус клещевого энцефалита, изучила основные закономерности патогенеза, патоморфологии и иммунологии этого заболевания и доказала роль клещей в передаче инфекции. Уже в 1940 г. были созданы высокоэффективные средства профилактики (инактивированная мозговая формолвакцина) и терапии (препараты специфического лошадиного гаммаглобулина, а также гаммаглобулина, приготовленного из сыворотки людей, проживающих в эпидемических очагах). Изучение очагов клещевого и японского энцефалита в природе привело к созданию теории природной очаговости инфекционных болезней. В 1955 г. американский ученый Дж. Солк получил инактивированную вакцину против полиомелита, а затем А. Сэбин селекционировал живую вакцину. Исключительно важное место в работах отечественных вирусологов занимает изучение гриппа — наиболее распространенной и сейчас инфекционной болезни человека. Изучение гриппа было начато в 1933—1934 гг. Вирусолог В. М. Жданов посвятил свои работы, разрешению проблем гриппа, созданию классификации вирусов, изучению эволюции инфекционных вирусных болезней. Вирусологи внесли много нового в изучение онкогенных вирусов. Ими были разработаны вопросы иммунологии рака, вирусной трансформации клетки и многие другие. Л. А. Зильбером была сформулирована первая вирусогенетическая теория возникновения опухолей. Основы современной химиотерапии были заложены П. Эрлихом, который показал, что растворимые свинцовые соли, введенные в организм, не распределяются в нем равномерно, а способны концентрироваться в определенных органах и клетках. Он сделал очень важное заключение, что некоторые химические вещества имеют химическое сродство к определенным тканям и клеткам. Этот подход к лечению инфекционных заболеваний Эрлих называл химиотерапией и считал, что химия поможет найти «волшебную пулю», которая способна убить микробы, не повреждая клетки организма человека. Наблюдая антагонизм микробов, некоторые исследователи пытались выделять вещества, продуцируемые микробами - антагонистами в окружающую среду, в частности зеленой плесенью, лечебные свойства которой были известны еще в XIX веке. Но практического выхода эти работы не получили и вскоре были забыты.
Английский ученый Александр Флеминг в 1928 г. наблюдал зоны лизиса стафилококка в чашках, случайно проросших зеленой плесенью. Выделенный штамм плесени губительно действовал и на другие микробы. Однако выделить активное начало зеленой плесени — пенициллин — удалось только в 1940 г. В чистом виде пенициллин был получен группой английских химиков во главе с Г. Флори и Э. Чейном. Организация производства и широкое внедрение пенициллина в медицинскую практику потребовали согласованных усилий ученых разных специальностей. В Советском Союзе активные штаммы, продуцирующие пенициллин, были изучены 3. В. Ермольевой в 1942 г. Открытие пенициллина и широкое внедрение его в практику положило начало новой эры в развитии медицины — эры антибиотиков. В 1943 г. С. Ваксмаи из почвенного микроба Actinomyces globisporus получил новый антибиотик стрептомицин, который оказался эффективным средством в лечении туберкулеза. 1945 г. был ознаменован открытием хлорамфеникола и хлортетрациклина— антибиотиков, эффективных в отношении как грамположительных, так и грамотрицательных бактерий. Затем были получены так называемые антибиотики широкого спектра действия.
 Рис. 11 Илья́ Ильи́ч Ме́чников (1845 - 1916) - российский и французский биолог (зоолог, эмбриолог, иммунолог, физиолог и патолог). Лауреат Нобелевской премии в области физиологии и медицины (1908).
Рис. 11 Илья́ Ильи́ч Ме́чников (1845 - 1916) - российский и французский биолог (зоолог, эмбриолог, иммунолог, физиолог и патолог). Лауреат Нобелевской премии в области физиологии и медицины (1908).
 Рис. 12 Пауль Эрлих (1854 - 1915) — немецкий врач, иммунолог, бактериолог, химик, основоположник химиотерапии. Лауреат Нобелевской премии (1908).
Рис. 12 Пауль Эрлих (1854 - 1915) — немецкий врач, иммунолог, бактериолог, химик, основоположник химиотерапии. Лауреат Нобелевской премии (1908).
 Рис.13 Дмитрий Иосифович Ивановский (1864 - 1920) — русский физиолог растений и микробиолог, основоположник вирусологии.
Рис.13 Дмитрий Иосифович Ивановский (1864 - 1920) — русский физиолог растений и микробиолог, основоположник вирусологии.
 Рис.14 Алекса́ндр Фле́минг (1881 - 1955) — британский бактериолог. Открыл лизоцим и впервые выделил исторически первый антибиотик. В 1945 Флеминг, Флори и Чейн были удостоены Нобелевской премии в области физиологии и медицины.
Рис.14 Алекса́ндр Фле́минг (1881 - 1955) — британский бактериолог. Открыл лизоцим и впервые выделил исторически первый антибиотик. В 1945 Флеминг, Флори и Чейн были удостоены Нобелевской премии в области физиологии и медицины.
Начиная с 40—50-х годов XX в. микробиология и иммунология вступили в молекулярно-генетический этап развития. За последние три десятилетия в результате развития нового этапа в микробиологии — генетики микроорганизмов — возникла молекулярная биология как новая отрасль знаний, в задачу которой входит изучение структуры белка, нуклеиновых кислот и пр. Создание электронного микроскопа сделало видимым мир вирусов и макромолекулярных соединений. Генетика бактерий пролила свет на когда-то запутанные проблемы их изменчивости, внесла поистине революционизирующий вклад в генетику в целом, «вскормила» целую область биохимии, что в значительной степени обусловило рождение молекулярной биологии и биотехнологии. Расшифровка генома кишечной палочки сделала возможными искусственное конструирование генов и пересадку отдельных генов из одних клеток в другие. К настоящему времени генная инженерия внесла принципиально новые идеи и методы в производство широкого спектра биологически активных веществ.
Основными технологическими принципами, используемыми в биотехнологии, являются: а) брожение (ферментация); б) биоконверсия (превращение одного вещества в другое); в) культивирование бактерий, вирусов, растительных и животных клеток; г) генетическая инженерия, к ней относится и процесс искусственного создания микробов с необходимыми свойствами.
Лекция № 2.
Бактериоциногеновары.
Для видовой идентификации бактерий необходимо знать следующие их свойства:
1) морфологические (форму и структуру бактериальной клетки);
2) тинкториальные (способность окрашиваться различными красителями);
3) культуральные (характер роста на питательной среде);
4) биохимические (способность утилизировать различные субстраты);
Антигенные.
Виды, связанные генетическим родством, объединяют в роды, роды – в семейства, семейства – в порядки. Более высокими таксономическими категориями являются классы, отделы, подцарства и царства. Согласно современной систематике патогенные микроорганизмы относятся к царству прокариот, патогенные простейшие и грибы – к царству эукариот, вирусы объединяются в отдельное царство – Vira. Все прокариоты, имеющие единый тип организации клеток, объединены в один отдел – Bacteria. Однако отдельные их группы отличаются структурными и физиологическими особенностями. На этом основании выделяют:
1) собственно бактерии;
2) актиномицеты;
3) спирохеты;
4) риккетсии;
5) хламидии;
Микоплазмы.
Наибольшую известность получила фенотипическая классификация бактерий, основанная на строении их клеточной стенки, включённая, в частности, в IX издание Определителя бактерий Берги (1984—1987). Крупнейшими таксономическими группами в ней стали 4 отдела: Gracilicutes (грамотрицательные), Firmicutes (грамположительные), Tenericutes (микоплазмы; отдел с единственным классом Mollicutes) и Mendosicutes (археи). В последнее время всё большее развитие получает филогенетическая классификация бактерий, основанная на данных молекулярной биологии. Филогенетическая классификация отчасти повторяет фенотипическую, так, группа Gracilicutes присутствует и в той и в другой. В то же время систематика грамотрицательных бактерий была полностью пересмотрена, архебактерии и вовсе выделены в самостоятельный таксон высшего ранга, часть таксономических групп разбита на части и перегруппирована, в одни группы объединены организмы с совершенно разными экологическими функциями, что вызывает ряд неудобств и недовольство части научного сообщества. Объектом нареканий становится и то, что проводится фактически классификация молекул, а не организмов.
В настоящее время для систематики микроорганизмов используется ряд таксономических систем.
1. Нумерическая таксономия. Признает равноценность всех признаков. Для ее применения необходимо иметь информацию о многих десятках признаков. Видовая принадлежность устанавливается по числу совпадающих признаков.
2. Серотаксономия. Изучает антигены бактерий с помощью реакций с иммунными сыворотками. Наиболее часто применяется в медицинской бактериологии. Недостаток – бактерии не всегда cодержат видоспецифический антиген.
3. Хемотакcономия. Применяются физико-химические методы, с помощью которых исследуется липидный, аминокислотный состав микробной клетки и определенных ее компонентов.
4. Генная систематика. Основана на способности бактерий с гомологичными ДНК к трансформации, трансдукции и конъюгации, на анализе внехромосомных факторов наследственности – плазмид, транспозонов, фагов.
При изучении, идентификации и классификации микроорганизмов чаще всего изучают следующие (гено- и фенотипические) характеристики:
1. Морфологические - форма, величина, особенности взаиморасположения, структура.
2. Тинкториальные- отношение к различным красителям (характер окрашивания), прежде всего к окраске по Граму. По этому признаку все микроорганизмы делят на грамположительные и грамотрицательные.
Морфологические свойства и отношение к окраску по Граму позволяют как правило отнести изучаемый микроорганизм к крупным таксонам- семейству, роду.
3. Культуральные - характер роста микроорганизма на питательных средах.
4. Биохимические - способность ферментировать различные субстраты (углеводы, белки и аминокислоты и др.), образовывать в процессе жизнедеятельности различные биохимические продукты за счет активности различных ферментных систем и особенностей обмена веществ.
5.Антигенные- зависят преимущественно от химического состава и строения клеточной стенки, наличия жгутиков, капсулы, распознаются по способности макроорганизма (хозяина) вырабатывать антитела и другие формы иммунного ответа, выявляются в иммунологических реакциях.
6.Физиологические- способы углеводного (аутотрофы , гетеротрофы), азотного (аминоавтотрофы , аминогетеротрофы) и других видов питания, тип дыхания (аэробы, микроаэрофилы, факультативные анаэробы, строгие анаэробы).
7.Подвижность и типы движения.
8.Способность к спорообразованию, характер спор.
9.Чувствительность к бактериофагам, фаготипирование.
10.Химический состав клеточных стенок- основные сахара и аминокислоты, липидный и жинокислотный состав.
11.Белковый спектр (полипептидный профиль).
12.Чувствительность к антибиотикам и другим лекарственным препаратам.
13.Генотипические (использование методов геносистематики).
В последние десятилетия для классификации микроорганизмов, помимо их фенотипических характеристик (см. пп.1- 12), все более широко и эффективно используются различные генетические методы (изучение генотипа- генотипических свойств). Используются все более совершенные методы- рестрикционный анализ, ДНК- ДНК гибридизация, ПЦР, сиквенс и др. В основе большинства методов лежит принцип определения степени гомологии генетического материала (ДНК, РНК). При этом чаще исходят из условного допущения, что степень гомологии более 60% ( для некоторых групп микроорганизмов- 80%) свидетельствует о принадлежности микроорганизмов к одному виду (различные генотипы - один геновид), 40- 60%- к одному роду.
Идентификация.
Основные фено- и генотипические характеристики, используемые для классификации микроорганизмов, используются и для идентификации, т.е. установления их таксономического положения и прежде всего видовой принадлежности- наиболее важного аспекта микробиологической диагностики инфекционных заболеваний. Идентификация осуществляется на основе изучения фено- и генотипических характеристик изучаемого инфекционного агента и сравнения их с характеристиками известных видов. При этой работе часто применяют эталонные штаммы микроорганизмов, стандартные антигены и иммунные сыворотки к известным прототипным микроорганизмам. У патогенных микроорганизмов чаще изучают морфологические, тинкториальные, культуральные, биохимические и антигенные свойства.
Номенклатура- название микроорганизмов в соответствии с международными правилами. Для обозначения видов бактерий используют бинарную латинскую номенклатуру род/вид, состоящую из названия рода (пишется с заглавной буквы) и вида (со строчной буквы). Примеры- Shigella flexneri, Rickettsia sibirica.
Специализированные термины.
Совокупность основных биологических свойств бактерий можно определить только у чистой культуры – это бактерии одного вида, выращенные на питательной среде.
Культура – скопление микробных клеток, может быть чистой и смешанной (бактерии разного вида, выращенные на питательной среде).
Колония (клон) – потомство одной микробной клетки.
Штамм – вид микроорганизмов, выделенный из разных источников.
Вопросы для контроля знаний:
1. Назвать основные таксономические единицы классификации бактерий
2. Что такое вид ?
3. Что такое штамм?
4. Понятие о вариантах, примеры
5. Что такое идентификация микроорганизмов
6. Понятие о морфологических свойствах
7. Понятие о бинарной номенклатуре
8. Что такое культура ?
9. Что такое чистая культура?
10. Что такое колония?
Лекция №3.
Формы бактерий
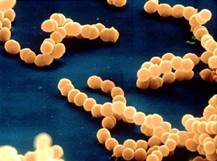
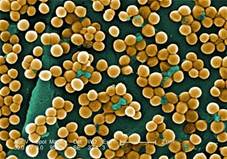
Шаровидные бактерии.
Шаровидные бактерии, или кокки.
Форма шаровидная или овальная. По характеру расположения клеток в мазках выделяют:
Микрококки – отдельно расположенные клетки.
Диплококки – располагаются парами.
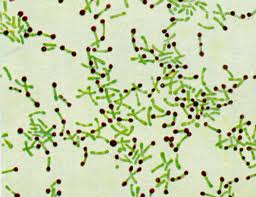
Стрептококки – клетки округлой или вытянутой формы, составляющие цепочку.
Сарцины – располагаются в виде «пакетов» из 8 и более кокков.
Стафилококки – кокки, расположенные в виде грозди винограда в результате деления в разных плоскостях.
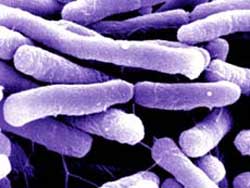 Палочковидные бактерии (кишечная палочка).
Палочковидные бактерии (кишечная палочка).
Палочковидные бактерии
Форма палочковидная, концы клетки могут быть заостренными, закругленными, обрубленными, расщепленными, расширенными. Палочки могут быть правильной и неправильной формы, в том числе ветвящиеся, например у актиномицетов.
По характеру расположения клеток в мазках выделяют:
Монобактерии – расположены отдельными клетками.
Диплобактерии – расположены по две клетки.
Стрептобактериии – после деления образуют цепочки клеток.
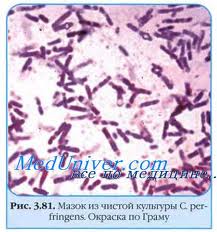
Палочковидные бактерии могут образовывать споры: бациллы (аэробные бактерии) и клостридии (анаэробные бактерии).
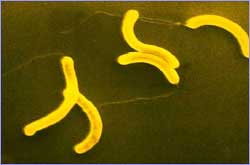 Извитые бактерии (холерный вибрион).
Извитые бактерии (холерный вибрион).
Извитые бактерии
Форма - изогнутое тело в один или несколько оборотов.
Вибрионы – изогнутость тела не превышает одного оборота.
Спирохеты – изгибы тела в один или несколько оборотов.
Строение. Бактериальная клетка состоит из клеточной стенки, цитоплазматической мембраны, цитоплазмы с включениями и так называемым нуклеоидом. Имеются дополнительные структуры: капсула, микрокапсула, жгутики, пили. Некоторые бактерии в неблагоприятных условиях способны образовывать споры.
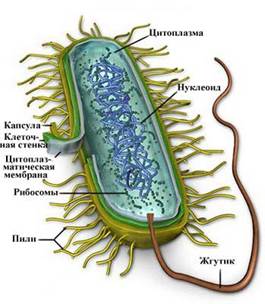 Строение бактериальной клетки
Строение бактериальной клетки
Клеточная стенка важный структурный элемент бактериальной клетки, однако не обязательный. Искусственным путём были получены формы с частично или полностью отсутствующей клеточной стенкой (L-формы), которые могли существовать в благоприятных условиях, однако иногда утрачивали способность к делению. Известна также группа природных не содержащих клеточной стенки бактерий — микоплазмов.
Клеточная стенка выполняет следующие функции:
1) защитную - осуществление фагоцитоза;
2) регуляцию осмотического давления;
3) рецепторную;
4) принимает участие в процессах питания деления клетки;
5) антигенную (определяется продукцией эндотоксина – основного соматического антигена бактерий);
6) стабилизирует форму и размер бактерий;
7) обеспечивает систему коммуникаций с внешней средой;
8) косвенно участвует в регуляции роста и деления клетки.
У бактерий существует два основных типа строения клеточной стенки, свойственных грамположительным и грамотрицательным видам. Такое название они получили после того, как в конце XIX века датский врач Ханс Кристиан Грам обнаружил, что если бактерии обработать сначала красителем кристаллическим фиолетовым, а затем йодом, то бесцветные в обычных условиях клетки окрашиваются. Но у одних бактерий образуется прочная фиолетовая окраска (их назвали грамположительными), а у других (грамотрицательных) краситель смывается этиловым спиртом, поэтому их докрашивают фуксином Циля и они приобретают розовую окраску.
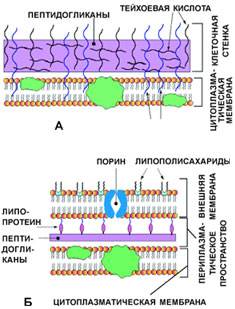 Строение клеточной стенки.
Строение клеточной стенки.
А - грамположительные бактерии, Б - грамотрицательные бактерии
Клеточная стенка имеет два слоя:
1) наружный – пластичный;
2) внутренний – ригидный, состоящий из муреина.
Клеточная стенка грамположительных бактерий представляет собой гомогенный слой толщиной 20—80 нм, построенный в основном из пептидогликана (муреина), с меньшим количеством тейхоевых кислот и небольшим количеством полисахаридов, белков и липидов (так называемый липополисахарид). В клеточной стенке имеются поры диаметром 1—6 нм, которые делают её проницаемой для ряда молекул.
У грамотрицательных бактерий пептидогликановый слой неплотно прилегает к ЦПМ и имеет толщину лишь 2—3 нм. Он окружён наружной мембраной, имеющей, как правило, неровную, искривлённую форму. Между ЦПМ, слоем пептидогликана и внешней мембраной имеется пространство, называемое периплазматическим, и заполненное раствором, включающим в себя транспортные белки и ферменты. Клеточная стенка проницаема: через нее питательные вещества свободно проходят в клетку, а продукты обмена выходят в окружающую среду. Крупные молекулы с большим молекулярным весом не проходят через оболочку.
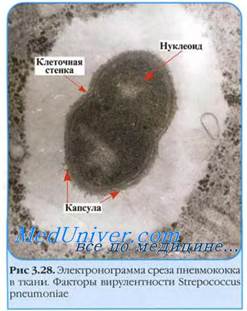
Капсула. Клеточная стенка многих бактерий сверху окружена слоем слизистого материала — капсулой. Толщина капсулы может во много раз превосходить диаметр самой клетки, а иногда она настолько тонкая, что ее можно увидеть лишь через электронный микроскоп — микрокапсула. Капсула не является обязательной частью клетки, она образуется в зависимости от условий, в которые попадают бактерии. Она служит защитным покровом клетки и участвует в водном обмене, предохраняя клетку от высыхания.
Среди бактерий различают:
1) истиннокапсульные бактерии (род Klebsiella) – сохраняют капсулообразование и при росте на питательных средах, а не только в макроорганизме;
2) ложнокапсульные – образуют капсулу только при попадании в макроорганизм
 .
.
 Капсулы вокруг клеток Clostridium. Увел. X 2200.
Капсулы вокруг клеток Clostridium. Увел. X 2200.
Капсула играет роль антигена, может быть фактором вирулентности (патогенности).
По химическому составу капсулы чаще всего представляют собой полисахариды. Иногда они состоят из гликопротеидов (сложные комплексы сахаров и белков) и полипептидов (род Bacillus), в редких случаях — из клетчатки (род Acetobacter).
Цитоплазма и ЦПМ. Все содержимое клетки, за исключением ядра и клеточной стенки, называется цитоплазмой. В жидкой, бесструктурной фазе цитоплазмы (матриксе) находятся рибосомы, мембранные системы, митохондрии, пластиды и другие структуры, а также запасные питательные вещества. Цитоплазма обладает чрезвычайно сложной, тонкой структурой (слоистая, гранулярная). Внешний липопротеидный слой протопласта бактерий, обладающий особыми физическими и химическими свойствами, называется цитоплазматической мембраной (ЦПМ). Она имеет обычное строение: два слоя фосфолипидов (25–40 %) и белки. ЦПМ выполняет очень важную роль — регулирует поступление веществ в клетку и выделение наружу продуктов обмена.
Между плазматической мембраной и клеточной стенкой имеется связь в виде десмозов — мостиков. Через мембрану питательные вещества могут поступать в клетку в результате активного биохимического процесса с участием ферментов. Кроме того, в мембране происходит синтез некоторых составных частей клетки, в основном компонентов клеточной стенки и капсулы. Наконец, в ЦПМ находятся важнейшие ферменты (биологические катализаторы). Упорядоченное расположение ферментов на мембранах позволяет регулировать их активность и предотвращать разрушение одних ферментов другими. С мембраной связаны рибосомы — структурные частицы, на которых синтезируется белок. Мембрана состоит из липопротеидов. Она достаточно прочна и может обеспечить временное существование клетки без оболочки. ЦПМ составляет до 20% сухой массы клетки.
ЦПМ и цитоплазму объединяют вместе в понятие протопласт. ЦПМ - это жидкокристаллическая структура, состоящая из билипидного слоя и белковых молекул. 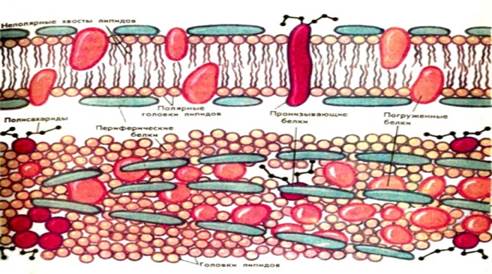
Назначение:
• Механическая защита клетки от внешней среды
• Не дает цитоплазме растечься
• Химическая регуляция процессов внутри кл.
• Принимает активное участие в питании, дыхании, выделении
• Антигенная функция
Гомогенная фракция цитоплазмы, содержащая набор растворимых РНК, белков, продуктов и субстратов метаболических реакций, названа цитозолем. Другая часть цитоплазмы представлена различными структурными элементами.
Одним из основных отличий клетки бактерий от клетки эукариот является отсутствие ядерной мембраны и, строго говоря, отсутствие вообще внутрицитоплазматических мембран, не являющихся производными ЦПМ. Однако у разных групп прокариот (особенно часто у грамположительных бактерий) имеются локальные впячивания ЦПМ — мезосомы, выполняющие в клетке разнообразные функции и разделяющие её на функционально различные части.

Одни из этих структур — аналоги митохондрий. Другие выполняют функции эндоплазматической сети или аппарата Гольджи. Путем инвагинации цитоплазматической мембраны образуется также фотосинтезирующий аппарат бактерий.
Рибосомы являются центрами синтеза белка в клетке.
При этом они часто соединяются между собой, образуя агрегаты, называемые полирибосомами или полисомами. Рибосомы представляют собой рибонуклеопротеиновые частицы размером 20 нм, состоящие из двух субъединиц – 30 S и 50 S. Перед началом синтеза белка происходит агрегация -объединение этих субъединиц в одну – 70 S. В отличие от клеток эукариотов рибосомы бактерий не объединены в эндоплазматическую сеть. 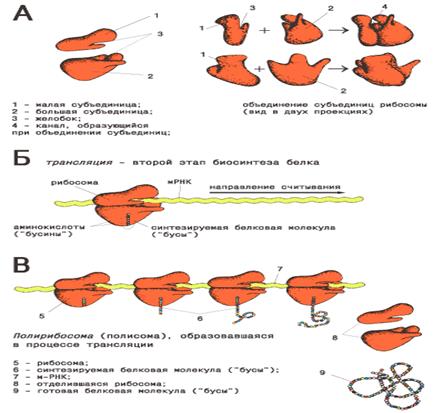
Включения. В цитоплазме клеток бактерий часто содержатся гранулы различной формы и размеров. Однако их присутствие нельзя рассматривать как какой-то постоянный признак микроорганизма, обычно оно в значительной степени связано с физическими и химическими условиями среды. Многие цитоплазматические включения состоят из соединений, которые служат источником энергии и углерода. Эти запасные вещества образуются, когда организм снабжается достаточным количеством питательных веществ, и, наоборот, используются, когда организм попадает в условия, менее благоприятные в отношении питания.
У многих бактерий гранулы состоят из крахмала или других полисахаридов — гликогена и гранулезы. У некоторых бактерий при выращивании на богатой сахарами среде внутри клетки встречаются капельки жира. Другим широко распространенным типом гранулярных включений является волютин (метахроматиновые гранулы).. 
Эти гранулы состоят из полиметафосфата (запасное вещество, включающее остатки фосфорной кислоты). Полиметафосфат служит источником фосфатных групп и энергии для организма Бактерии чаще накапливают волютин в необычных условиях питания.
Ядерный аппарат. В центральной части клетки локализовано ядерное вещество — дезоксирибонуклеиновая кислота (ДНК). У бактерий нет такого ядра, как у высших организмов (эукариотов), а есть его аналог — «ядерный эквивалент» — нуклеоид, который является эволюционно более примитивной формой организации ядерного вещества. Нуклеоид – ядерное вещество, распыленное в цитоплазме клетки. Не имеет ядерной мембраны, ядрышек. В нем локализуется ДНК, представленная двухцепочечной спиралью. Обычно, замкнута в кольцо и прикреплена к цитоплазматической мембране. Содержит около 60 млн. пар оснований. Это чистая ДНК, она не cодержит белков гистонов. Их защитную функцию выполняют метилированные азотистые основания. В нуклеоиде закодирована основная генетическая информация, т. е. геном клетки.
Наряду с нуклеоидом в цитоплазме могут находиться автономные кольцевые молекулы ДНК с меньшей молекулярной массой – плазмиды . В них также закодирована наследственная информация, но она не является жизненно необходимой для бактериальной клетки.
Жгутики. На поверхности некоторых бактерий имеются придаточные структуры; наиболее широко распространенными из них являются жгутики — органы движения бактерий. Есть у подвижных бактерий. Это особые белковые выросты на поверхности бактериальной клетки, содержащие белок – флагелин. Жгутики связаны с бактериальным телом при помощи двух дисков: наружный находится в клеточной стенке, а внутренний – ЦПМ. В результате их энергичного движения, напоминающего штопор или греблю, жидкость движется вдоль жгутиков и бактерий, развивается скорость до 50 мкм/с.
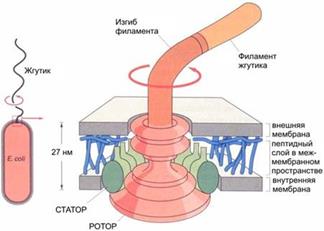 Строение бактериального жгутика на примере бактерии Esherichia Coli
Строение бактериального жгутика на примере бактерии Esherichia Coli
Количество и расположение жгутиков может быть различным. Различают:
1) монотрихи (имеют один жгутик); А
2) лофотрихи (имеют пучок жгутиков на одном конце клетки); В
3) амфитрихи (имеют по одному жгутику на каждом конце); С
4) перитрихи (имеют несколько жгутиков, расположенных по периметру). Д
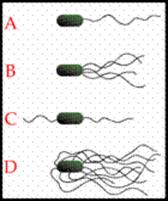 Типы расположения жгутиков: A-Монотрихи; B-Лофотрихи; C-Амфитрихи; D-Перитрихи.
Типы расположения жгутиков: A-Монотрихи; B-Лофотрихи; C-Амфитрихи; D-Перитрихи.
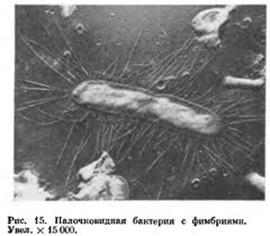
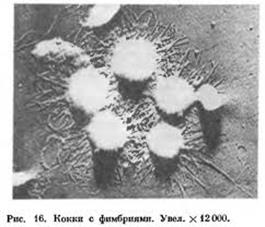
Помимо жгутиков, поверхность многих бактерий покрыта цитоплазматическими выростами — микроворсинками. Обычно это волоски (числом от 10 до нескольких тысяч) толщиной 3-25 нм и длиной до 12 мкм. Микроворсинки встречают как у подвижных, так и у неподвижных бактерий. Эти выросты способствуют увеличению площади поверхности бактериальной клетки, что дает ей дополнительные преимущества в утилизации питательных веществ из окружающей среды. Известны специализированные микроворсинки — фимбрии и пили.
Фимбрии бактерий [от лат. fimbria, бахрома]. Многие грамотрицательные бактерии имеют длинные и тонкие микроворсинки, пронизывающие клеточную стенку. Образующие их белки формируют спиралевидную нить. Основная функция фимбрии — прикрепление бактерий к субстратам (например, к поверхности слизистых оболочек), что делает их важным фактором колонизации и патогенности.
F-пили бактерий [от англ. fertility, плодовитость, + лат. pilus, волосок], или «секс-пили», — жёсткие цилиндрические образования, участвующие в конъюгации бактерий. Пили впервые обнаружены у Escherichia coli K12, то есть у штаммов, содержащих F-фактор Обычно клетка снабжена 1-2 пилями, имеющими вид полых белковых трубочек длиной 0,5-10 мкм; нередко они имеют шаровидное утолщение на конце. Большинство F-пилей образует специфический белок — пилин. Образование пилей кодируют плазмиды. Их идентифицируют с помощью донорспецифических бактериофагов, адсорбирующихся на пилях и лизирующих клетки.
F-пили обеспечивают контакт между бактериальными клетками в процессе конъюгации. Через них идет обмен генетической информацией от донора к реципиенту. Донор– обладает F-пили. Реципиент – не имеет F-пили.

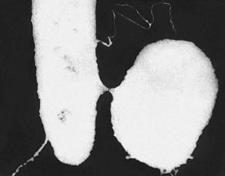 Электронномикроско
Электронномикроско
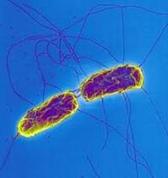
пическое изображение конъюгации у кишечной палочки;
удлинённая клетка — донор, круглая — реципиент.
Споры и спорообразование. Споры – это особые формы существования некоторых бактерий при неблагоприятных условиях внешней среды. Споры бактерий - своеобразная форма покоящихся бактерий, форма сохранения наследственной информации в неблагоприятных условиях внешней среды и не является способом размножения, как у грибов. Спорообразование присуще грамположительным бактериям. В отличие от вегетативных форм споры более устойчивы к действию химических, термических факторов. Чаще всего споры образуют бактерии рода Bacillus и Clostridium.
Бациллы являются аэробами или факультативными анаэробами. Крупные и среднего размера прямые или слабоизогнутые палочки, способные к образованию устойчивых к неблагоприятным воздействиям эндоспор (экстремальным температурам, высушиванию, ионизирующим излучениям, химическим агентам). Диаметр споры, как правило, не превышают поперечник палочки. Не надо путать с термином, характеризующим форму микроорганизма - баци́лла (палочка) (лат. bacilli, ед. ч. bacillum илиbacillus — «палочка») — палочковидная бактерия.
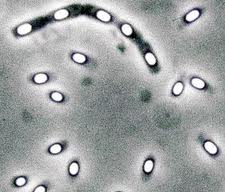
Клостридии (лат. Clostridium) — род грамположительных, облигатно анаэробных бактерий, способных продуцировать эндоспоры. Отдельные клетки — удлинённые палочки, название рода происходит от греческого κλοςτεδ (веретено). Многие виды, которые были отнесены к клостридиям по этому морфологическому признаку, позже были реклассифицированы. Эндоспоры могут располагаться центрально, эксцентрально и терминально. Диаметр эндоспор часто превышают диаметр клетки.

У грамотрицательных бактерий также обнаружена способность сохраняться в неблагоприятных условиях в виде некультивируемых форм. При этом нет типичного спорообразования, но в таких клетках замедлены метаболические процессы, невозможно сразу получить рост на питательной среде. Но при попадании в макроорганизм они превращаются в исходные формы. 
Рис. 23 Расположение спор.
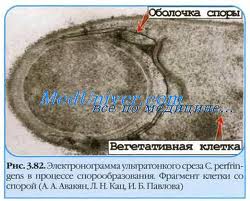
Процесс спорообразования заключается в утолщении всех оболочек клетки. Они становятся плотными, клетка теряет воду, замедляются все ее пластические процессы. Выделяют стадии образования споры: Подготовительная стадия сопровождается прекращением деления и увеличением количества липидных включений. Стадия предспоры обычно начинается бурно. В клетке появляется эллиптическая оболочка, окружающая участок цитоплазмы с изменёнными плотностью и тинкториальными свойствами. Подобное образование обозначают терминами «предспора , проспора». Третья стадия включает появление оболочки (обычно в течение 10 мин после образования предспоры) и ещё большее увеличение коэффициента светопреломления. Стадия созревания споры сопровождается её уплотнением и снижением метаболической активности клетки. Образуются споры в течение 18-20 часов. При попадании споры в благоприятные условия она прорастает в вегетативную форму. В благоприятных условиях споры прорастают за 4-5 часов.
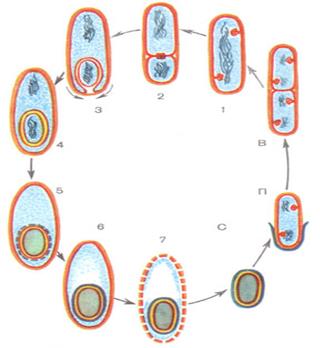 Рис. 24. Цикл развития спорообразующих бактерий:
Рис. 24. Цикл развития спорообразующих бактерий:
в — деление вегетативных клеток; 1-7 стадии спорообразования: 1 — образование осевого хроматинового тяжа; 2 — образование споровой перегородки (септы); 3 — «поглощение» протопластом материнской клетки септированного участка цитоплазмы с ядром; 4 — формирование кортекса; 5 — начало формирования оболочки споры; 6 — завершение образования оболочки и созревание споры; 7 — лизис материнской клетки и освобождение спор; с — свободная зрелая спора; п — прорастание споры. Темные извитые нити — ДНК, красным цветом обозначены мембраны вегетативной клетки и споры, голубым — цитоплазма, желтым — клеточная стенка, синим — оболочка споры.
Вопросы для контроля знаний:
1. Строение прокариотической клетки
2. Основные отличия эукариот и прокариот
3. Строение клеточной стенки; отличие в строении клеточной стенки (кл.ст.) Гр+ и Гр- м.о. Понятие о тинкториальных свойствах. Назначение кл. ст.
4. Цитоплазматическая мембрана: строение, назначение. Мезосомы
5. Нуклеоид; особенности строения, назначение.
6. Рибосомы; назначение
7. Реснички; виды ресничек, понятие о фимбриях и пилях. Что такое адгезия? Что такое конъюгация?
8. Жгутики; назначение, классификация м.о. по расположению жгутиков.
9. Капсула: классификация, назначение
10. Споры: назначение, классификация. Понятие о бациллах и клостридиях; отличия
Лекция № 4
Спирохеты
Форма
Спирохеты (spira - виток, chaite - волосы) представляют собой тонкие спирально извитые нити, изогнутые вокруг центральной оси, которая, по-видимому, является пучком слившихся фибрилл. Они относятся к порядку Spirochaetales.
Спирохеты имеют штопорообразную извитую форму. Они отличаются друг от друга характером и числом завитков, длиной клеток, а также другими морфологическими и физиологическими признаками. Спирохеты чрезвычайно полиморфны.
Структура
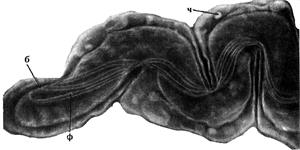
Бледная трепонема. Электронная микроскопия. Ультратонкий срез. Увеличение 131000. ч - чехол; б - блефаропласт; ф - фибрилы;
Патогенные виды относятся к трем родам: Treponema, Borrelia, Leptospira, отличающимся друг от друга структурными особенностями, количеством завитков, типом движения и другими признаками. В структурном отношении клетки спирохет представляют собой цитоплазматические цилиндры, отграниченные цитоплазматической мембраной (ЦМ) от тонкой и эластичной клеточной стенки (КС), которая состоит из наружной мембраны и пептидогликанового слоя. Между ЦМ и цитоплазматическим цилиндром спирохет расположены фибриллы, состоящие, так же как и жгутики бактерий, из белка флагеллина. У трепонем и боррелий имеется два пучка фибрилл, прикрепленных к дисковидным образованиям - блефаропластам, расположенным на обоих концах цилиндра и направленных навстречу друг другу. У лептоспир единичные фибриллы прикреплены на концах клетки к блефаропластам. Фибриллы обеспечивают разные типы движения спирохет: поступательное, вращательное и сгибательное. В процессе движения спирохеты образуют петли, завитки, изгибы, которые получили название вторичных завитков.
Окраска
Спирохеты, особенно трепонемы, в отличие от других бактерий плохо воспринимают анилиновые красители. Их, так же как простейших, окрашивают краской Романовского – Гимза или серебрением. Все спирохеты - грамотрицательные микроорганизмы. Однако лучше всего наблюдать спирохеты в живом виде при фазовоконтрастной микроскопии или в темном поле.
Патогенность
Патогенными для людей являются немногие. Различные виды - анаэробы, факультативные анаэробы и аэробы. Большая часть спирохет - свободно живущие микроорганизмы, обитают как сапрофиты и в организме человека.
Патогенные для человека спирохеты являются представителями трех родов семейства Spirochaetaceae: В род Treponema входят мелкие тонкие спирохеты с неглубокими завитками (в количестве 8—12). Эти спирохеты очень подвижны (возбудитель сифилиса - Т. pallidum, возбудитель фрамбезии - Т. раllidum subsp. tenue, возбудитель пинты-Т. carateum); Borrelia (возбудитель эпидемического возвратного тифа - В. recurrentis, возбудители клещевого возвратного тифа - В. persica, В. hispanisa и др.) Спирохеты этого рода длиннее, имеют 3—8 крупных завитков с большей амплитудой. Среди спирохет рода Leptospira (от leptos — малый, spiera — завиток) около 40 патогенных видов и большое количество сапрофитических форм, живущих в пресных водоемах. Лептоспиры имеют длину до 4—8 мкм и своеобразную структуру: завитки очень неглубокие и частые (напоминают под микроскопом веревку), концы изогнуты в виде крючков и имеют пуговчатые утолщения. Образуя вторичные завитки при движении, лептоспиры приобретают вид букв S или С. L. interrogans вызывают у человека инфекционную желтуху. Род Leptospira семейства Leptospiraceae (возбудитель лептоспироза - L. interrogans).
Морфология риккетсий.
Риккетсии находятся в составе класса Rickеttsias и относятся к прокариотам. Они являются облигатными внутриклеточными паразитами, поражая членистоногих, птиц, животных, человека. Их не удается культивировать па искусственных питательных средах. Риккетсии размножаются в живых клетках, лучше всего в желточном мешке куриного эмбриона (метод Кокса).
Риккетсии названы в честь американского исследователя Г. Риккетса, описавшего первого возбудителя заболевания, известного под названием пятнистой лихорадки Скалистых гор. Это своеобразные микроорганизмы, имеющие черты сходства с бактериями: задерживаются на бактериальных фильтрах, имеют клеточную стенку, содержащую мурамовую кислоту, нуклеотид, рибосомы, окрашиваются по Граму, Романовскому — Гимзе, Здродовскому или серебрением (по Морозову), размножаются так же, как бактерии, — поперечным делением, но этот процесс может происходить только внутри клеток.
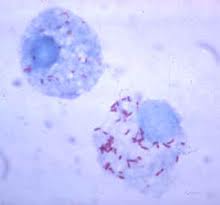
Жизненный цикл риккетсий зависит от жизнедеятельности клетки-хозяина и складывается из двух стадий: вегетативной и покоящейся (элементарные тельца). Риккетсии, находящиеся в вегетативной стадии (рис. 4) активно размножаются путем бинарного деления и обладают активной подвижностью, по-видимому, обусловленной жгутиковыми структурами. Риккетсии покоящейся стадии (элементарные тельца) имеют сферическую форму и они не активны.
Порядок Rickettsiales включает виды патогенные для теплокровных животных и человека, переносчиками служат вши, блохи, клещи. Заболевания называются риккетсиозами. Большинство болезнетворных для человека видов риккетсий входит в состав семейства Rickettsiaceae , роды Rickettsia , Rochalimaea , Coxiella , вызывая эпидемический сыпной тиф ( Rickettsia prowazekii ), Ку-лихорадку ( Coxiella burnetti ), волынскую лихорадку ( Rochalimaea guintana ), лихорадку цуцугамуши ( Rickettsia tsutsugamushi ) и другие. Паразитирующие виды ассоциированы с ретикулоэндотелиальными клетками и клетками эндотелия сосудов или эритроцитами.
Морфология грибов.
Грибы – многоклеточные или одноклеточные гетеротрофные эукариотические микроорганизмы с клеточной стенкой.
Рост и строение грибов.
Выделяют два типа роста грибов – дрожжевой и мицелиальный (гифальный).
Дрожжевые грибы (дрожжи) имеют вид овальных клеток.
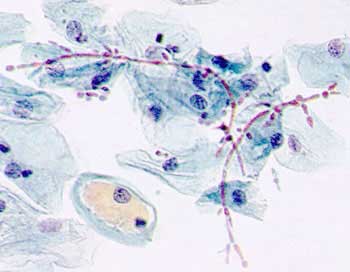
Дрожжеподобный гриб рода Candida образует псевдомицелий (фиолетовые клетки).
У большинства клеток грибов имеется клеточная стенка, отсутствует она лишь у зооспор и вегетативных клеток некоторых примитивных грибов. На 80—90 % она состоит из азотистых и безазотистых полисахаридов, у большинства основным полисахаридом является хитин, только у оомицетов — целлюлоза.
Вегетативное тело подавляющего большинства видов грибов (гифальные (плесневые) грибы) — это мицелий, или грибница, состоящая из тонких бесцветных (иногда слегка окрашенных) нитей, или гиф, с неограниченным ростом и боковым ветвлением. Гифы низших грибов клеточных перегородок не имеют. Гифы высших грибов перегородки имеют. Гифы растут апикально и обильно ветвятся. Грибница обычно имеет большую общую поверхность, так как через неё осмотическим путём всасывается пища..
Мицелий обычно дифференцируется на две функционально различные части: субстратный, служащий для прикрепления к субстрату, поглощения и транспортировки воды и растворенных в ней веществ, и воздушный, поднимающийся над субстратом и образующий органы размножения. В процессе приспособления к различным условиям обитания у грибов возникают многочисленные видоизменения мицелия, одно из них гаустории, характерные для грибов-паразитов, представляют собой специальные выросты мицелия, проникающие в клетки хозяина и поглощающие из них питательные вещества.
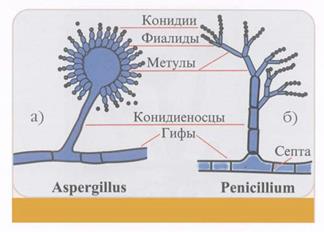
Строение гриба рода а) Aspergillus, б) Penicillium (рисунок).
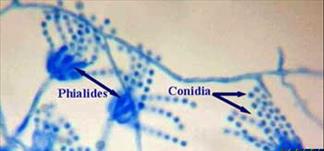
Питание грибов.
Все грибы являются гетеротрофными организмами. Минеральные вещества гриб способен усваивать из окружающей среды, однако органические он должен получать в готовом виде Грибы не способны усваивать крупные частички пищи, поэтому всасывают исключительно жидкие вещества через всю поверхность тела, при этом огромная площадь поверхности мицелия оказывается весьма выгодной.
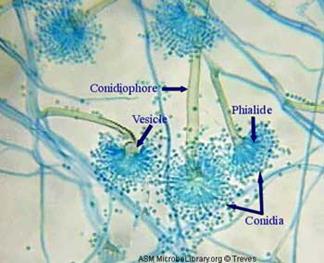
Высшие грибы рода Aspergillus (фото).
По способу питания различают две основные группы грибов: сапротрофы и симбионты. Для последних характерен паразитизм и мутуализм. К сапротрофам относится большинство шляпочных и плесневых грибов, а также дрожжи. Обширная система ветвящихся гиф позволяет им тесно контактировать с субстратом. Почти все клетки мицелия отделены от субстрата лишь тонкой клеточной стенкой. Пищеварительные ферменты, выделяемые грибами в окружающую среду, очень быстро воздействуют на материал субстрата и способствуют его частичному перевариванию вне грибной клетки. Такой полупереваренный материал затем всасывается всей поверхностью клетки. Это называется внешнее пищеварение.
Размножение грибов.
У большинства грибов выделяют половой и бесполый типы размножения. Совершенные грибы – размножаются половым и бесполым путем. Несовершенные грибы – размножаются только бесполым путем. В отличие от довольно однообразного вегетативного строения формы полового размножения очень разнообразны (на них основана классификация царства). Характерен плеоморфизм — наличие одновременно нескольких видов спороношений, например, бесполого и полового.
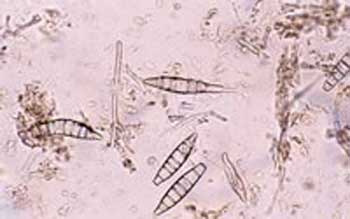
Несовершенные грибы рода Microsporum.
Лекция 5.
Распространение в природе.
Микрофлора воды. Вода также является естественной средой обитания микроорганизмов. Микрофлора воды чаще всего отражает микробный пейзаж почвы около водоема, постоянно меняется и обновляется, что связано с попаданием различных бактерий с ливневыми, сточными, талыми водами, с пылью, из организма живущих в водоеме рыб, гниющих растений. Микрофлора в пресных и соленых водоемах различна. В пресных водоемах (озерах, реках) обнаруживаются кокки (Micrococcus roseus и др.) и палочковидные бактерии (Pseudomonas fluorescens). Анаэробов в воде мало; в основном они размножаются в иле на дне рек, участвуя в биохимических процессах очищения. Сапрофитные микроорганизмы выполняют роль мусорщиков, расщепляя органические отходы, делая их пригодными для метаболических процессов других живых существ. Микрофлора морей и океанов не так богата и представлена галофильпыми (солелюбивыми) микроорганизмами. Вода артезианских скважин почти не содержит микроорганизмов, что объясняется фильтрующей способностью почвы.
 Pseudomonas fluorescens — (фото с сайта www.scienceclarified.com
Pseudomonas fluorescens — (фото с сайта www.scienceclarified.com 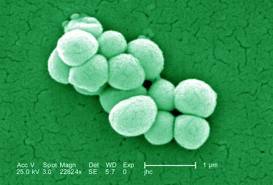
The bacterium Micrococcus roseus
С ливневыми, талыми и сточными водами в реки и озера попадают микроорганизмы — представители нормальной флоры кишечника человека и животных, например, кишечная палочка, энтерококки, различные клостридии. Вместе с ними могут попасть и патогенные микроорганизмы — брюшнотифозные, дизентерийные бактерии, холерные вибрионы, вирусы полиомиелита, гепатита, которые сохраняются от нескольких дней до недель. Именно поэтому водный путь передачи является одним из возможных факторов распространения кишечных инфекций.



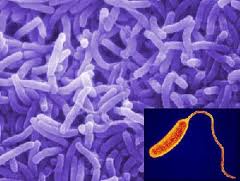
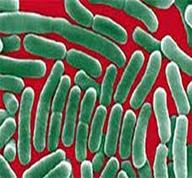
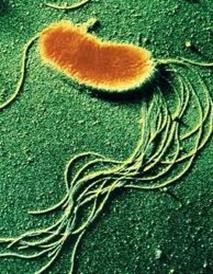
Возбудитель холеры Возбудитель брюшного тифа
Микрофлора воздуха. Микрофлору воздуха можно условно разделить на постоянную, часто встречающуюся, и переменную, представители которой, попадая в воздух из свойственных им мест обитания, недолго сохраняют жизнеспособность. Постоянно в воздухе обнаруживаются пигментообразующие кокки, палочки, дрожжи, грибы, актиномицеты, спороносные бациллы и клостридии и др., т. е. микроорганизмы, устойчивые к свету, высыханию.
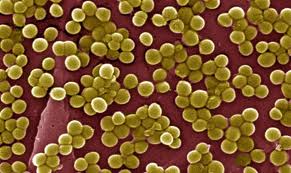

Стафилококки
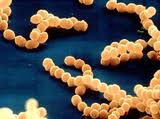
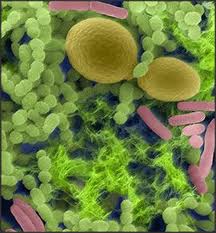

Стрептококки (на 2-ой картинке - зеленые)
В воздухе крупных городов количество микроорганизмов больше, чем в сельской местности. Над лесами, морями воздух содержит мало микробов. Дождь и снег способствуют очищению воздуха от микробов.
В воздухе закрытых помещений микробов значительно больше, чем в открытых воздушных бассейнах, особенно зимой, при недостаточном проветривании. Состав микрофлоры и количество микроорганизмов, обнаруживаемых в 1 м3 воздуха (микробное число воздуха), зависят от санитарно-гигиенического режима, числа находящихся в помещении людей, состояния их здоровья и других условий.
В воздух могут попадать и патогенные микроорганизмы от животных, людей (больных и носителей) при разговоре, кашле, чиханье — возбудители дифтерии, коклюша, скарлатины, туберкулеза, гриппа, кори и других инфекций.
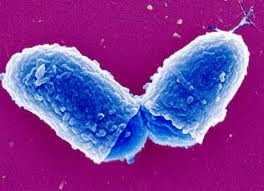
Возбудитель дифтерии
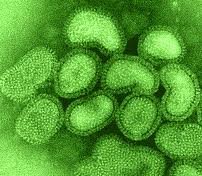
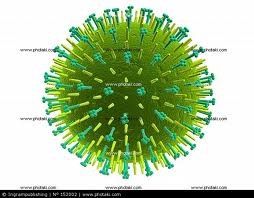
Вирус гриппа
При высыхании в капельках слизи и мокроты, которые образуют защитную белковую пленку, жизнеспособность попавших в воздух микробов увеличивается.
Микрофлора почвы. Почва является средой обитания огромного числа мельчайших живых существ: множества видов бактерий, актиномицетов, грибов, простейших, водорослей, вирусов и др. В 1 г почвы содержится 1—10 млрд. микроорганизмов; взаимоотношения между ними носят характер как симбиотических, так и антагонистических. Почвенные микробы антагонисты широко применяются в медицинской промышленности при получении антибиотиков.
Качественный состав, количество особей и соотношения между различными группами микроорганизмов изменяются в зависимости от вида почвы, способов ее обработки. Распределение микробов в почве неравномерно. На глубине 10—50 см микрофлора наиболее обильна. Здесь идет процесс разложения органических веществ с активным участием таких почвенных бактерий, как гнилостные, аммонифицирующие, нитрифицирующие, азотфиксирующие и др. Небольшой верхний слой почвы (1—2 см) содержит немного микробов, что объясняется постоянным действием различных физических и химических факторов, вызывающих их гибель. В глубоких слоях почвы микробов мало, на глубине 4— 5 м — ничтожное количество. С выделениями больных животных и человека в почву попадают также патогенные микроорганизмы; часть из них погибает, но многие могут сохраняться длительное время. Поэтому почву рассматривают как путь передачи возбудителей инфекционных заболеваний. В ней обнаруживаются возбудители грибковых заболеваний, возбудители ботулизма, столбняка, газовой гангрены, сибирской язвы, способные образовывать споры и благодаря этому свойству длительно, иногда десятками лет, сохраняющиеся в почве. Непродолжительное время в почве могут существовать брюшнотифозные бактерии, возбудители туляремии, туберкулеза.
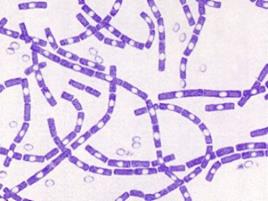
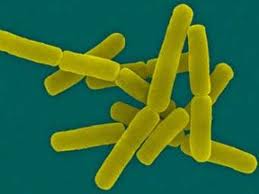
Возбудитель сибирской язвы
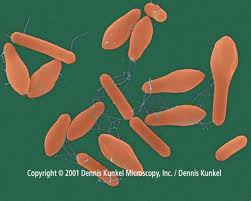
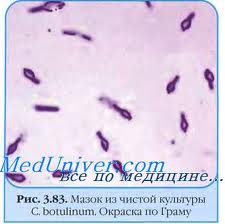
Возбудитель ботулизма
Возбудитель газовой гангрены и пищевых токсикоинфекций
Микрофлора человека.
Дисбактериоз
Часто можно слышать о нормальной микрофлоре и о нарушениях, связанных с отклонением от нормы. Термин нормальная микрофлора объединяет виды микроорганизмов, часто выделяемые из организма здорового человека. Нарушение качественного и количественного состава микрофлоры и перемещение ее в другие, не свойственные микроорганизмам, части тела называют дисбактериозами.
Развитию дисбактериоза способствует:
- Длительное применение антибиотиков и антисептиков. Антимикробная терапия сопровождается дисбактериозом в 90% случаев. Поэтому настоятельно рекомендуется использовать антибиотики только в острых и тяжелых случаях.
- Чрезмерная чистоплотность, использование средств гигиены с антибактериальными веществами (например, триклозан) также может приводить к дисбактериозу. Используя антибактериальные средства, человек убивает не только патогенные микроорганизмы, но и нормальные. Последние являются защитным барьером для человека. Здесь уместна аналогия со стражниками, защищающими ворота. Стражники - нормальная микрофлора, ворота - кожа человека. Нет стражи, ворота легко атакуемы.
- Снижение местного и общего иммунитета в результате гормонотерапии , лучевой терапии, инфекционных заболеваний, воспалительных процессов, аллергий.
- Нарушения в гормональной системе организма. Чаще всего нарушение в гормональной системе вызваны употреблением продуктов, содержащих активные гормоны (мясо, молоко крупномасштабных производителей)
- Стресс. Группу риска составляют люди, находящиеся в состоянии постоянного напряжения: летчики, бизнесмены, моряки, спортсмены, врачи, а также жители экологически неблагоприятных территорий и пожилые люди.
- Нарушение работы нервной системы. Нарушения в нервной системе могут быть вызваны недосыпанием, чрезмерным употреблением кофе, энергетических напитков, использованием снотворных средств.
- Общее ухудшение экологической обстановки, низкое качество воды, неполноценное и несбалансированное питание также могут стать причиной дисбактериоза.
Наиболее распостранен дисбактериоз кишечника, симптомы которого следующие:
- Нарушение работы кишечника (диарея, запор, урчание, повышенный метеоризм)
- Общее недомогание, сопровождающееся болями в области живота
- Постоянная усталость, депрессивность
Вопросы для контроля знаний:
- Что такое микрофлора и ее отличие от культуры?.
- Какие м.о. являются наиболее частыми обитателями водоемов, почвы и воздуха? Какой природный объект наиболее обсеменен?
- Понятие о нормальной микрофлоре (н.м.ф.) человека.
- Какие биотопы организма обсеменены?
- Назначение н.м.ф. в организме человека
- Понятие о дисбактериозе; симптомы
Лекция 7
Действие физических и химических факторов на микроорганизмы.
Основные понятия:
Стерилизация – предполагает полную инактивацию микробов и вирусов в объектах, подвергшихся обработке.
Дезинфекция — процедура, предусматривающая обработку загрязненного микробами предмета с целью их уничтожения до такой степени, чтобы они не смогли вызвать инфекцию при использовании данного предмета. Как правило, при дезинфекции погибает большая часть микробов (в том числе все патогенные), однако споры и некоторые резистентные вирусы могут остаться в жизнеспособном состоянии.
Асептика – комплекс мер, направленных на предупреждение попадания возбудителя инфекции в рану, органы больного при операциях, лечебных и диагностических процедурах. Методы асептики применяют для борьбы с экзогенной инфекцией, источниками которой являются больные и бактерионосители.
Антисептика – совокупность мер, направленных на уничтожение микробов в ране, патологическом очаге или организме в целом, на предупреждение или ликвидацию воспалительного процесса.
Методы воздействия на микроорганизмы по виду использованного фактора можно разделить на физические и химические,
по характеру воздействия- на неизбирательные (обеззараживание- дезинфекция, стерилизация) и избирательные (химиотерапевтические).
Физические методы.
1.Термическая обработка- прокаливание, кипячение, пастеризация, автоклавирование.
2.Облучение- ультрафиолетовое, гамма- и рентгеновское, микроволновое.
3.Фильтрование (оптимально- бактериологические фильтры с диаметром пор около 200 нм).
Химические методы.
1.Неспецифического действия- дезинфектанты (обработка помещений и др., антисектики - обработка живых тканей). К ним относятся: препараты йода и хлора, спирты, альдегиды, кислоты и щелочи, соли тяжелых металлов, катионные детергенты, фенолы, окислители, природные препараты- деготь, ихтиол, хлорофиллипт.
2.Избирательно подавляющие жизнедеятельность микроорганизмов - антибиотики и химиотерапевтические препараты.
Лекция 8
Антибиотики.
Антибио́тики (от др.-греч. ἀντί — против + βίος — жизнь) — вещества природного или полусинтетического происхождения, подавляющие рост живых клеток, чаще всего прокариотических или простейших.
По ГОСТ 21507-81 (СТ СЭВ 1740-79) Антибиотик — вещество микробного, животного или растительного происхождения, способное подавлять рост микроорганизмов или вызывать их гибель.
Исторический очерк.
В народной медицине для обработки ран и лечения туберкулеза издавна применяли экстракты лишайников. Позднее в состав мазей для обработки поверхностных ран стали включать экстракты бактерий Pseudomonas aeruginosa, хотя почему они помогают, никто не знал, и феномен антибиоза был неизвестен.
Однако некоторые из первых ученых-микробиологов сумели обнаружить и описать антибиоз (угнетение одними организмами роста других). Дело в том, что антагонистические отношения между разными микроорганизмами проявляются при их росте в смешанной культуре. До разработки методов чистого культивирования разные бактерии и плесени выращивались вместе, т.е. в оптимальных для проявления антибиоза условиях. Луи Пастер еще в 1877 описал антибиоз между бактериями почвы и патогенными бактериями – возбудителями сибирской язвы. Он даже предположил, что антибиоз может стать основой методов лечения.
Первые антибиотики были выделены еще до того, как стала известной их способность угнетать рост микроорганизмов. Так, в 1860 был получен в кристаллической форме синий пигмент пиоцианин, вырабатываемый небольшими подвижными палочковидными бактериями рода Pseudomonas, но его антибиотические свойства были обнаружены лишь через много лет. В 1896 Б. Гозио из жидкости, содержащей культуру грибка из рода Penicillium (Penicillium brevicompactum), выделил кристаллическое соединение — микофеноловую кислоту, подавляющую рост бактерий сибирской язвы.
В 1899 году Р. Эммерих и О. Лоу сообщили об антибиотическом соединении, образуемом бактериями Pseudomonas pyocyanea, и назвали его пиоцианазой; препарат использовался как местный антисептик.
Постепенно выяснилось, что антибиоз имеет химическую природу и обусловлен выработкой специфических химических соединений. В 1929 Александр Флеминг, наблюдая антагонизм Penicillium notatum и стафилококка в смешанной культуре, открыл пенициллин и предположил возможность его применения в лечебных целях. Антагонистические отношения между болезнетворными для растений микробами и непатогенными микроорганизмами почвы, выявленные в смешанных культурах, заинтересовали фитопатологов, и они попытались использовать этот феномен для борьбы с болезнями растений. Было известно, что в почве присутствует определенный грибок, который уменьшает выпревание ростков; в 1936 из культуры этого грибка был выделен антибиотик, получивший название глиотоксин. Это открытие подтвердило значение антибиотиков как средства профилактики заболеваний.
Годом ранее в 1935 –м Герхард Домагк опубликовал статью о терапевтическом действии пронтозила в Deutsche Medizinische Wochenschrift, данная статья была первым руководством по лечению антибиотиком, а в 1939-м году он получил Нобелевскую премию по физиологии и медицине за «за открытие антибактериального эффекта пронтозила».
В 1937-м М. Вельш описал первый антибиотик стрептомицетного происхождения — актиномицетин.
Среди первых исследователей, занявшихся целенаправленным поиском антибиотиков, был Р.Дюбо. Проведенные им и его сотрудниками эксперименты привели к открытию антибиотиков, вырабатываемых некоторыми почвенными бактериями, их выделению в чистом виде и использованию в клинической практике. В 1939 Дюбо получил тиротрицин – комплекс антибиотиков, состоящий из грамицидина и тироцидина; это явилось стимулом для других ученых, которые обнаружили еще более важные для клиники антибиотики. В этом же году Н. А. Красильников и А. И. Кореняко получили мицетин, а на химико-фармацевтическом заводе «АКРИХИН» начали производство стрептоцида.
В 1940 году — Э. Чейн выделил пенициллин в кристаллическом виде.
В 1942 год — Х.Флори со своими коллегами по Оксфордскому университету повторно исследовал пенициллин и доказал возможность его клинического использования в качестве нетоксичного средства лечения многих острых инфекций. Зельман Ваксман впервые ввел термин «антибиотик». З.Ваксман со своими студентами в Университете Ратджерса, США, занимался актиномицетами (такими, как Streptomyces) и в 1944 открыл стрептомицин, эффективное средство лечения туберкулеза и других заболеваний. После 1940 было получено множество клинически важных антибиотиков, в их числе бацитрацин, хлорамфеникол (левомицетин), хлортетрациклин, окситетрациклин, амфотерицин В, циклосерин, эритромицин, гризеофульвин, канамицин, неомицин, нистатин, полимиксин, ванкомицин, виомицин, цефалоспорины, ампициллин, карбенициллин, аминогликозиды, стрептомицин, гентамицин. В настоящее время открывают все новые и новые антибиотики. В середине 1980-х годов в США антибиотики прописывались чаще, чем любые другие лекарства, за исключением седативных средств и транквилизаторов.
Классификация антибиотиков.
Современная классификация антибиотиков разработана в Государственном центре по антибиотикам (С.М.Навашин, 1994), в соответствии с которой, они характеризуются по происхождению, способу получения, механизму действия, химической структуре, противомикробному спектру, типу действия на клетку.
Продуцентами большинства антибиотиков являются ( классификация по происхождению):
- актиномицеты (стрептомицин, тетрациклин),
- плесневые грибы (весь пенициллиновый ряд);
но их можно получить и из:
- бактерий (полимиксины),
- высших растений (фитонциды)
- тканей высших животных, человека и рыб (эритрин, эктерицид, лизоцим, интерферон).
По способу получения их делят на:
- природные (штаммы-продуценты антибиотиков выращивают на искусственных питательных средах, а за тем антибиотик извлекают из питательной среды химическими методами);
- синтетические (химические аналоги природных антибиотиков и синтезированные антибиотики, не имеющие природного аналога);
- полусинтетические (на начальном этапе получают естественным путем, затем синтез ведут искусственно, то есть изменяют химическую структуру природного антибиотика).
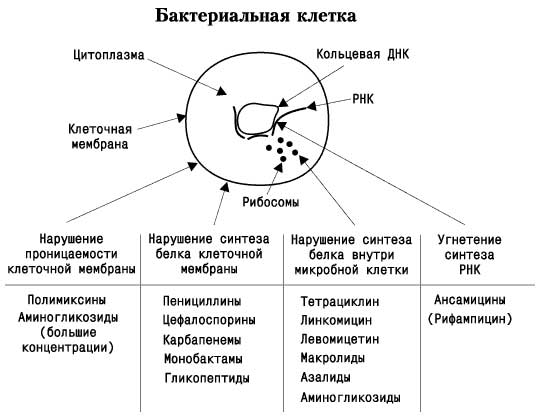
С учетом механизма действия антибиотики разделяют на три основные группы:
- ингибиторы синтеза клеточной стенки микроорганизма (пенициллины, цефалоспорины, ванкомицин, тейкопланин и др.);
- антибиотики, нарушающие молекулярную организацию, функции клеточных мембран (полимиксин, нистатин, леворин, амфотерицин и др.);
- антибиотики, подавляющие синтез белка и нуклеиновых кислот, в частности, ингибиторы синтеза белка на уровне рибосом (хлорамфеникол, тетрациклины, макролиды, линкомицин, аминогликозиды) и ингибиторы РНК-полимеразы (рифампицин) и др.
В зависимости от типа воздействия на микробную клетку антибиотики классифицируют на две группы:
- бактерицидные – вызывают гибель микробной клетки (пенициллины, цефалоспорины, аминогликозиды, рифампицин, полимиксины и др.);
- бактериостатические – задерживают рост микробной клетки (макролиды, тетрациклины, линкомицин, хлорамфеникол и др.).
По химическому строению антибиотики делятся на:
1. Бета-лактамные антибиотики - основу из молекулы составляет бета-лактамное кольцо. К ним относятся:
- пенициллины - это группа природных и полусинтетических антибиотиков, молекула которых содержит 6-аминопенициллановую кислоту, состоящую из двух колец - тиазолидонового и бета-лактамного. Среди них выделяют:
- биосинтетические (пенициллин G - бензилпенициллин),
- аминопенициллины (амоксициллин, ампициллин, бекампициллин),
- полусинтетические "антистафилококковые" пенициллины (оксациллин, метициллин, клоксациллин, диклоксациллин, флуклоксациллин), основное преимущество которых - устойчивость к микробным бета-лактамазам, в первую очередь, стафилококковым;
2. цефалоспорины - это природные и полусинтетические антибиотики, полученные на основе 7-аминоцефалоспориновой кислоты и содержащие цефемовое (также бета-лактамное) кольцо, т.е. по структуре они близки к пенициллинам. Они делятся на цефалоспорины:
- 1-го поколения: цепорин, цефалотин, цефалексин;
- 2-го поколения:- цефазолин (кефзол), цефамезин, цефамандол (мандол);
- 3-го поколения:- цефуроксим (кетоцеф), цефотаксим (клафоран), цефуроксим аксетил (зиннат), цефтриаксон (лонгацеф), цефтазидим (фортум);
- 4-го поколения:- цефепим, цефпиром (цефром, кейтен) и другие.
- монобактамы - азтреонам (азактам, небактам);
- карбопенемы - меропенем (меронем) и имипинем. Причем имипинем применяют только в комбинации со специфическим ингибитором почечной дегидропептидазы циластатином - имипинем/циластатин (тиенам);
3 Аминогликозиды - они содержат аминосахара, соединенные гликозидной связью с остальной частью (агликоновым фрагментом) молекулы. К ним относятся: стрептомицин, гентамицин (гарамицин), канамицин, неомицин, мономицин, сизомицин, тобрамицин (тобра) и полусинтетические аминогликозиды - спектиномицин, амикацин (амикин), нетилмицин (нетиллин);
4. Тетрациклины - основу молекулы составляет полифункциональное гидронафтаценовое соединение с родовым название тетрациклин. Среди них имеются природные тетрациклины - тетрациклин, окситетрациклин (клинимицин) и полусинтетические тетрациклины - метациклин, хлортетрин, доксициклин (вибрамицин), миноциклин, ролитетрациклин;
5. Макролиды - препараты этой группы содержат в своей молекуле макроциклическое лактоновое кольцо, связанное с одним или несколькими углеводными остатками. К ним относятся: эритромицин, олеандомицин, рокситромицин (рулид) азитромицин (сумамед), кларитромицин (клацид), спирамицин, диритромицин;
6. Линкозамиды - к ним относятся: линкомицин и клиндамицин. Фармакологические и биологические свойства этих антибиотиков очень близки к макролидам, и, хотя в химическом отношении это совершенно иные препараты, некоторые медицинские источники и фармацевтические фирмы - производители химиопрепаратов, например, делацина С, относят линкозамины к группе макролидов;
7. Гликопептиды - препараты этой группы в своей молекуле содержат замещенные пептидные соединения. К ним относятся: ванкомицин (ванкацин, диатрацин), тейкопланин (таргоцид), даптомицин;
8. Полипептиды - препараты этой группы в своей молекуле содержат остатки полипептидных соединений, к ним относятся: грамицидин, полимиксины М и В, бацитрацин, колистин;
9. Полиены - препараты этой группы в своей молекуле содержат несколько сопряженных двойных связей. К ним относятся: амфотерицин В, нистатин, леворин, натамицин;
10. Антрациклинновые антибиотики - к ним относятся противоопухолевые антибиотики - доксорубицин, карминомицин, рубомицин, акларубицин.
Есть еще несколько достаточно широко используемых в настоящее время в практике антибиотиков, не относящихся ни к одной из перечисленных групп - фосфомицин, фузидиевая кислота (фузидин) рифампицин.
По спектру противомикробного действия антибиотики разделяют на следующиие группы:
- антибиотики широкого спектра действия, активные в отношении грамположительных и грамотрицательных палочек: хлорамфеникол, тетрациклины, аминогликозиды, полусинтетические пенициллины широкого спектра действия (ампициллин, азлоциллин и др.) и цефалоспорины 2-го поколения.
- антибиотики узкого спектра действия - препараты, действующие преимущественно на грамположительные и грамотрицательные кокки (стафилококки, стрептококки, менингококки, гонококки), некоторые грамположительные микробы (коринебактерии, клостридии). К этим препаратам относятся бензилпенициллин, бициллины, феноксиметилпенициллин, пенициллиназоустойчивые пенициллины (оксациллин, метициллин), цефалоспорины 1-го поколения, макролиды, ванкомицин, линкомицин. Антибиотики с преимущественной активностью в отношении грамотрицательных палочек (полимиксины, цефалоспорины 3-го поколения). Противотуберкулезные антибиотики (стрептомицин, рифампицин, флоримицин). Противогрибковые антибиотики (нистатин, леворин, гризеофульвин, амфотерицин В, кетоконазол, анкотил, дифлюкан и др.).
По направленности действия :
- антибактериальные;
- противогрибковые;
- противоопухолевые;
- противовирусные.
Вышеперечисленные свойства в основном и диктуют выбор антибиотика для лечения инфекционного больного. При этом обязательно учитываются фармакодинамика и фармакокинетика препарата, индивидуальные особенности больного (возраст, состояние иммунитета, сопутствующие заболевания и др.).
Механизмы резистентности.
- У микроорганизма может отсутствовать структура на которую действует антибиотик (например бактерии рода микоплазма нечувствительны к пенициллину, так как не имеют клеточной стенки);
- Микроорганизм непроницаем для антибиотика (большинство грам-отрицательных бактерий невосприимчивы к пенициллину G, поскольку клеточная стенка защищена дополнительной мембраной);
- Микроорганизм в состоянии переводить антибиотик в неактивную форму (многие стафилококки содержат фермент β-лактамазу, который разрушает β-лактамовое кольцо большинства пенициллинов);
- В результате генных мутаций, обмен веществ микроорганизма может быть изменён таким образом, что блокируемые антибиотиком биохимические реакции больше не являются критичными для жизнедеятельности данного микроорганизма.
- Кроме того, антибиотикорезистентность микроорганизмов может быть создана искусственно методом генетической трансформации. Например, внесением искусственных генов в геном микроорганизма.
Таким образом выделяют два типа устойчивости к антибиотикам:
- естественная – является видовым признаком. Чаще всего эта устойчивость связана со слабой для данного антибиотика проницаемостью клеточной стенки и цитоплазматической мембраны микроорганизма.
- приобретённая – возникает у отдельных штаммов в результате изменения генома микроорганизма под действием антибиотика.
Существует так же понятие полирезисте́нтность — устойчивость микроорганизмов к двум и более антибактериальным препаратам.
По степени чувствительности к основным антибиотикам микробы подразделяются на чувствительные, среднечувствительные, умеренно устойчивые и устойчивые.
В группу чувствительных входит большинство штаммов микроорганизмов, рост которых на питательных средах прекращается при использовании концентраций, соответствующих средним терапевтическим дозам антибиотиков.
Если он угнетается при применении только максимальных доз препаратов, то такие микроорганизмы среднечувствительны к антибиотику.
Если рост бактерий прекращается только при непосредственном воздействии антибиотиком на очаг инфекции, то такие возбудители относят к умеренно устойчивым.
Если подавление роста достигается в опыте в лаборатории лишь при очень высоких концентрациях препарата, которые нельзя создать в организме, то такие возбудители инфекции относятся к устойчивым к антибиотику.
В зависимости от диаметра зоны задержки роста различают степень чувствительности испытуемого штамма: чувствительные , малочувствительные и устойчивые (отсутствие зоны). Степень чувствительности к антибиотику отмечается по четырёхкрестной системе, в зависимости от диаметра зоны задержки роста.
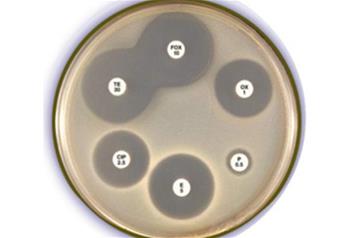
Метод серийных разведений.
Биологическую активность антибиотика измеряют в международных единицах ЕД (единица действия) – наименьшее количество препарата, которое оказывает антимикробное действие на тест-культуру.
Для получения количественных результатов используют методы серийных разведений. Метод серийного разведения препарата в бульоне основан на определении способности растворенного в питательном бульоне препарата вызывать гибель или ингибировать рост находящихся в нем микробов.
Для постановки опыта необходимы основные растворы антибиотиков в дистиллированной воде, питательный бульон (МПБ) и 18-часовая бульонная культура исследуемого штамма с примерной плотностью в 10 м.т./мл.
Ход исследования: из основных разведений препаратов готовят ряд в объеме 1 мл двукратных серийных разведений (титруют с1-й по 7-ю пробирки, из последней 1.0 мл сливают в дез. раствор для уравнивания количества жидкости) по схеме , захватывающие все уровни чувствительности-устойчивости. Во все разведения ряда доливают по 0,1 мл исследуемой культуры.
Контроли: контроль культуры (К/К) содержит 0,1 мл культуры и 1 мл бульона, а контроль среды ( К\Ср) только 1 мл питательного бульона.
Инкубируют посевы при 37°С до следующего дня.
| Число пробирок | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Кратные разведения а\б , ЕД | 64 | 32 | 16 | 8 | 4 | 2 | 1 | К\К | К\Ср |
| МПБ (мл) | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| А\б 128 ЕД |  1.0 1.0
| 
| 
| 
| 
| 
|  1.0 мл в дез.р-р 1.0 мл в дез.р-р
| _ | _ |
| Исследуемая культура | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | _ |
| Результат | - | - | - | + | + | + | + | + | - |

Результат: Сначала смотрят контроли – К\К – мутная пробирка, есть рост культуры (+) – микроорганизмы способны размножаться, а К/Ср – прозрачная пробирка (-) – рост отсутствует, питательная среда стерильна. Определяют МИК (минимальная концентрация препарата, оказывающая антимикробное действие), которая соответствует концентрации препарата в последней пробирке с видимой задержкой роста (последняя прозрачная пробирка в ряду с 1-й по7-ю). Затем эту дозу антибиотика пересчитывают на вес больного.
Если необходимо установить бактерицидное действие МБК, из нескольких пробирок с задержкой роста делают высев петлей на секторы чашки с МПА. Инкубируют до следующего дня и учитывают рост. За МБК принимают концентрацию препарата в последней пробирке, высев из которой не дал роста.
Метод серийных разведений в плотной питательной среде базируется на способности растворенного в плотной питательной среде препарата ингибировать рост нанесенных на него микробов. По сравнению с методом серийных разведении в жидкой среде более производителен, чувствителен и точен.
Ускоренные методы определения чувствительности.
Ускоренные методы определения чувствительности микроорганизмов к химиопрепаратам дают возможность получить ответ спустя 2-6 ч. от начала исследования чистых культур. По принципу и механизму реакций, возникающих в результате действия антибиотиков, можно выделить 5 групп ускоренных методов, которые основаны на:
1) выявлении изменений ферментативной активности бактерий. Сущность методов 1-й группы заключается в следующем: в мясо-пептонный бульон с глюкозой добавляют антибиотик в необходимой концентрации, а затем засевают испытуемый штамм микробов. Устойчивые к данному антибиотику микроорганизмы усваивают глюкозу, что проявляется изменением кислотно-щелочного потенциала (pH) среды. Для определения изменений pH среды предложено использовать индикаторы, которые изменяют свой цвет при снижении pH – феноловый красный, индикатор Андреде и бромтимоловый синий.
2) выявлении изменений окислительно-восстановительного потенциала среды развивающимися микроорганизмами. Методы 2-й группы, получившие наибольшее распространение, основаны на выявлении изменений окислительно-восстановительного потенциала среды (rH2) развивающимися микроорганизмами в присутствии антибиотиков с помощью биологических или химических редокс-индикаторов. Микроорганизмы, которые устойчивы к антибиотику, растут и размножаются в среде и снижают rH2 – потенциал, в результате чего индикатор, добавленный к питательной среде, изменяет свой цвет. Чувствительные микроорганизмы в зоне диффузии антибиотиков не размножаются и не изменяют rH2, вследствие этого цвет среды вокруг дисков не изменяется.
3) цитоморфологической оценке изменений бактериальных клеток и формирования микроколоний. Цитоморфологические ускоренные методы основаны на том принципе, что микроорганизмы, чувствительные к антибиотикам при 3-4-часовом росте на средах с химиопрепаратами, не увеличивают размеров микробной клетки или не образуют микроколоний на специальных препаратах с питательными средами.
4) определении изменений оптической плотности среды растущей популяцией или включения радиоизотопов в микробные клетки. Предложены ускоренные методы, основанные на выявлении динамики оптической плотности культур в присутствии антибиотика с помощью нефелометра или спектрофотометра. Разработка системы автоматизации процесса регистрации подавления микробного роста антимикробными препаратами позволила создать различные приборы-автоматы (АТВ Expression, MIC-2000, MS-2, Autobac и др.), обеспечивающие стандартность исследования и ускоренное получение антибиотикограмм.
5) использовании специальных питательных сред с ростовыми стимуляторами. Пятая группа ускоренных методов основана на использовании специальных питательных сред с ростовыми стимуляторами для достижения быстро регистрируемых изменений в среде. В качестве таких стимуляторов используют экстракт бычьего сердца и глюкозу, кровь и глюкозу, индолилмасляную и индолилуксусную кислоты, гибереллин.
Для лечебной и эпидемиологической практики большой интерес представляют экспресс-методы определения чувствительности микроорганизмов к антибиотикам, которые позволяют устанавливать антибиотикограмму возбудителя непосредственно в нативном материале или в первичном посеве, то есть без выделения чистой культуры, что сокращает время анализа до нескольких часов. Разработано несколько модификаций экспресс-метода, в основном для определения чувствительности к антибиотикам возбудителей опасных инфекционных заболеваний (ОИЗ) в первичном посеве исследуемого материала с помощью иммунологических реакций-метода флюоресцирующих антител, реакции непрямой гемагглютинации (РНГА), иммуноферментного метода. Основу модификаций эспресс-анализа антибиотикочувствительности составляет регистрация с помощью специфических антител действия препаратов на рост и размножение популяции возбудителя в смешанной культуре, то есть в ассоциации с сопутствующей микрофлорой.
Аллергические реакции
Прямое токсическое действие
Дисбактериозы
Обострение заболевания
Аллергические реакции не связаны с фармакологическими свойствами лекарств и возникают только у людей с повышенной чувствительностью (чаще сенсибилизированных). Антигенные свойства антибиотиков объясняются тем, что они являются неполными антигенами — гаптенами (простые химические соединения). Гаптены приобретают антигенные свойства только после связи с белком в организме. Это осуществляется при связи с растворимыми протеинами в крови или клеточными мембранами. Установлено, что антитела к пенициллину относятся к классам IgG, IgM, IgE. Клинические проявления аллергии на антибиотик могут быть различны от сыпи и до анафилактического шока. Для определения повышенной чувствительности организма к препарату перед назначение антибиотика проводят кожную пробу.
Кожная проба заключается в следующем. На сгибательную поверхность предплечья наносят каплю раствора антибиотика, содержащую 100—1000 ЕД препарата и скарифицируют кожу, как это делают при пробе Пирке. Если через 15 минут появляется покраснение более 1 см в диаметре, реакция оценивается как слабоположительная (+), если покраснение и папула — положительная (++), если множественные папулы, везикулы, разлитая гиперемия — резко положительная (+++). В случаях резко повышенной чувствительности возможно появление общей реакции — крапивница, уртикарная сыпь по всему телу т. д.
Внутрикожная проба заключается в интрадермальном введении раствора антибиотика (200—2000 ЕД пенициллина) в 0,2 мл физиологического раствора. Вводится антибиотик на сгибательной поверхности предплечья, на другой руке на симметричном участке вводят 0,2 мл физиологического раствора. Появление гиперемии (размер папулы более 3-х копеечной монеты), отечности, иногда высыпаний на месте инъекций расценивается как положительная проба. Кожные пробы не всегда дают немедленную реакцию: она может проявиться через 24—48 часов.
Дисбактериозы .
Кандидозы. К этой группе относятся заболевания, вызванные дрожжеподобными грибами рода Candida. Антибиотикотерапия (особенно применение препаратов широкого спектра действия) нарушает обычные соотношения между различными представителями нормальной микрофлоры (подавление роста бактерий и усиленное раз-множение дрожжеподобных грибов) и способствует активации Candida и их распространению у ослабленных больных. При длительной антибиотикотерапии для предотвращения кандидоза совместно назначают и противогрибковые препараты.
Авитаминозы.
При проведении антибиотикотерапии есть основания ожидать развития вторичного авитаминоза группы В и витамина К, которые необходимо профилактировать назначением соответствующих препаратов.
Обострение заболевания.
Может наступить при улови, что заболевание вызвано Гр(-) возбудителем, а для лечения использовался бактериоцидный антибиотик. В результате массовой гибели возбудителя в организм больного будет поступать большое количество эндотоксина (ЛПС клеточной стенки Гр (–) м.о.). Это приведет к обострению заболевания и даже развитию эндотоксического шока.
1.
Использованная литература:
1. Борисов Л.Б. Медицинскапя микробиология, вирусология, иммунология.- М., 2006., 736с.
2. Рудаков Н.В. Краткий курс лекций по медицинской микробиологии, вирусологии и иммунологии. В 2 частях: Учебное пособие. - Омск, 2002.
Интернет ресурсы:
- nmu-S.net > loag
- mikrobiologija / 16-1-0-247
- www mmbook. ru Северо-запад
- medstudents. ru > catory / mbio/ mbiotextbookc
- www. Colibri. ru Евразия
- images. yandex. Ru > микробиология, учебник
Содержание
| Пояснительная записка | 4 стр. |
| Лекция №1. Введение. Предмет и задачи микробиологии. История развития. | 7 стр. |
| Лекция № 2. Основные принципы классификации микроорганизмов. | 22 стр. |
| Лекция №3. Морфология и ультраструктура бактерий | 28 стр. |
| Лекция № 4 Морфология грибов, спирохет, простейших, риккетсий, микоплазм, вирусов. | 43 стр. |
| Лекция 5. Морфология вирусов. Вирусы бактерий - бактериофаги | 53 стр. |
| Лекция 6. Микроэкология. Роль микроорганизмов в круговороте веществ. Нормальная микрофлора организма человека. | 65 стр |
| Лекция 7 Действие физических и химических факторов на микроорганизмы. | 75 стр. |
| Лекция 8 Антибиотики. | 80 стр. |
| Использованная и рекомендуемая литература | 92 стр. |
Пояснительная записка
Основная цель лекционного курса по разделу «Общая микробиология» - формирование у будущего лаборанта - микробиолога научного мировоззрения о многообразии микроорганизмов и их роли в общебиологических процессах.
В задачи курса входит изучение студентами:
- принципов систематики, морфологии и физиологии, широты распространения микроорганизмов в природе
- особенностей биологии и экологии микроорганизмов;
- роли микробов в превращении веществ в природе и эффекты действия факторов внешней среды на прокариотические клетки,
- методов индикации и идентификации патогенных бактерий,
- основ учения об инфекции и иммунитете
- микроскопических, бактериологических, серологических, иммунологических, биологических методов исследования, используемых при диагностике инфекционных болезней.
В результате изучения курса студенты должны знать:
- теоретические основы жизнедеятельности микроорганизмов, их взаимодействия друг с другом и с организмом человека и животных
- основные биологические свойства патогенных микробов,
- принципы и способы диагностики и специфической профилактики инфекционных болезней.
Освоение программы, в соответствии с профессиональным модулем «Теория и практика лабораторных микробиологических исследований», рассчитано на 6 семестров.
Раздел «Общая микробиология » предусматривает 46 лекционных часов, распределенных на первые 3 семестра.
В 4, 5, 6 семестрах предусмотрено изучение частной микробиологии и вирусологии.
План лекций по дисциплине: Теория и практика лабораторных микробиологических исследований
(раздел «Общая микробиология», 3 семестр).
| Наименование тем лекций в соответствии с профессиональным модулем (ПМ.04) | Содержание учебного материала, | объем часов |
| 1 | 2 | 3 |
Курс 3 семестр
Лекция №1.
Введение. Предмет и задачи микробиологии. История развития.
Микробиология (от micros — малый, bios — жизнь, logos — учение) — наука, изучающая закономерности жизни и развития мельчайших организмов — микроорганизмов в их единстве со средой обитания, их биологические признаки, систематика, экология, взаимоотношения с другими организмами.
Микроорганизмы – наиболее древняя форма организации жизни на Земле. По количеству они представляют собой самую значительную и самую разнообразную часть организмов, населяющих биосферу, включают многочисленные виды как полезных, так и вредных для человека микроорганизмов. Одни из них являются участниками круговорота веществ и энергии в природе и, следовательно, определяют возможность существования жизни на Земле. Другие, наоборот, причиняют ущерб. Отдельные виды в процессе эволюции адаптировались к существованию в живых организмах и приобретали свойства возбудителей инфекционных заболеваний людей, животных и растений.
К микроорганизмам относят: 1) бактерии; 2) вирусы; 3) грибы; 4) простейшие; 5) микроводоросли. Общий признак микроорганизмов – микроскопические размеры; отличаются они строением, происхождением, физиологией.
Бактерии – одноклеточные микроорганизмы растительного происхождения, лишенные хлорофилла и не имеющие ядра.
Грибы – одноклеточные и многоклеточные микроорганизмы растительного происхождения, лишенные хлорофилла, но имеющие черты животной клетки, эукариоты.
Вирусы – это уникальные микроорганизмы, не имеющие клеточной структурной организации.
В зависимости от экологии микробов и практических потребностей человека паука о микробах дифференцировалась на общую, медицинскую, ветеринарную, сельскохозяйственную, пищевую и промышленную микробиологию. В XX веке появилась морская и космическая микробиология.
Общая микробиология изучает наиболее общие закономерности, свойственные каждой группе перечисленных микроорганизмов: структуру, метаболизм, генетику, экологию и т. д.
Основной задачей технической микробиологии является разработка биотехнологии синтеза микроорганизмами биологически активных веществ: белков, ферментов, витаминов, спиртов, органических веществ, антибиотиков и др.
Ветеринарная микробиология изучает возбудителей заболеваний животных, разрабатывает методы их биологической диагностики, специфической профилактики и этиотропного лечения, направленного на уничтожение микробов-возбудителей в организме больного животного.
Предметом изучения медицинской микробиологии являются болезнетворные (патогенные – возбудители инфекционных заболеваний) и условно-патогенные ( вызывают заболевания при определённых условиях) для человека микроорганизмы и те взаимоотношения, которые возникают между ними и организмом в определенных условиях внешней и социальной среды, а также разработка методов микробиологической диагностики, специфической профилактики и этиотропного лечения вызываемых ими инфекционных заболеваний. Разделом медицинской микробиологии является и иммунология, которая занимается изучением специфических механизмов защиты организмов людей и животных от болезнетворных микроорганизмов. Таким образом, курс медицинской микробиологии состоит из общей части, включающей изучение морфологии и физиологии микроорганизмов, учение об инфекции и иммунитете, и специальной части (частная микробиология), посвященной изучению свойств возбудителей основных инфекционных заболеваний человека, методов микробиологической диагностики, вопросов патогенеза, иммунитета, специфической профилактики и терапии.
Предметом изучения санитарной микробиологии являются санитарно-микробиологическое состояние объектов окружающей среды и пищевых продуктов, разработка санитарных нормативов.
Развитие микробиологии.
За относительно короткий срок развития микробиология обогатила медицину блестящими достижениями и ее применение стало необходимым в разнообразных областях медицинской теории и практики. Практически нет ни одной отрасли медицины, не связанной с микробиологией, в которую, помимо бактериологии, сейчас входят вирусология, иммунология, микология, протозоология и паразитология.
Донаучный этап.
Задолго до открытия микроорганизмов человек сталкивался с процессами их жизнедеятельности. Люди использовали брожение теста и виноградного сока, сквашивание молока, получение пива, уксуса, при силосовании кормов, мочке льна. Издавна знакомы человечеству и повальные заболевания, уносившие население целых городов. Однако люди не знали вызывающих их истинных причин. Это не мешало делать наблюдения и использовать ряд этих процессов в быту. Ряд философов и естествоиспытателей делали умозрительные заключения о причинах тех или иных явлений.
Уже в трудах Гиппократа (460 - 377 д.н.э.) появляются предположения о связи заразных болезней и особых болезнетворных испарений, названных им «миазмами». В трудах Лукреция (95-55 д. н.э.) и Галена (131-211 д.н.э.) была высказана гипотеза о живой природе возбудителей заразных заболеваний.
Народы Азии имели определённые представления о заразности лепры (проказы) и проводили изоляцию больных. Авиценна считал, что причиной заразных болезней являются невидимые существа, передающиеся через воду и воздух.
Имея подобную гипотезу, наиболее близко к открытию микромира подошел итальянский врач Джироламо Фракасторо (1478—1553), предположивший, что инфекции вызывают маленькие тельца, передающиеся при контакте и сохраняющиеся на вещах больного. Он создал учение о живом «контагии» - о мельчайших и недоступных нашим чувствам частицах, которые, проникая, вызывают болезнь.
Гипотезу о том, что эти частицы живые существа, высказал в начале 17 века немецкий учёный, иезуит Афанасий (Анасиус) Кирхер (1602 -1680). Однако в то время невозможно было удостовериться в правильности идей Фракасторо и распространение получили совершенно иные гипотезы. Бактериальную природу инфекционных заболеваний многие учёные продолжали отвергать и после революционных открытий Пастера и Коха так, в 1892 Макс Петтенкофер, уверенный в том что холеру вызывают миазмы, выделяемые окружающей средой, и пытаясь доказать свою правоту, проглотил при свидетелях-медиках культуру холерных вибрионов.
 Рис. 1 Джиро́ламо Фракасто́ро (1478 - 1553) — венецианский врач и писатель.
Рис. 1 Джиро́ламо Фракасто́ро (1478 - 1553) — венецианский врач и писатель.
 Рис. 2 Атанасиус Кирхер (1602 – 1680) - немецкий учёный, иезуит, занимавшийся физикой, естественными науками, лингвистикой, древностями, теологией, математикой.
Рис. 2 Атанасиус Кирхер (1602 – 1680) - немецкий учёный, иезуит, занимавшийся физикой, естественными науками, лингвистикой, древностями, теологией, математикой.
Дата: 2018-12-28, просмотров: 589.