Среди антибактериальных препаратов отдельно выделяют группу противотуберкулезных в связи с их специфическим действием на микобактерии туберкулеза. Эти препараты способны преодолевать барьер клеточной стенки бактерии.
Противотуберкулезные препараты делятся на основные антибактериальные препараты и резервные. К основным химиотерапевтическим средствам для лечения различных форм туберкулеза относится изониазид (гидразид изоникотиновой кислоты).
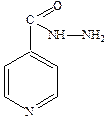
Широко применяется парааминосалициловая кислота (ПАСК).
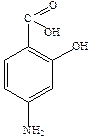
Указанные вещества очень эффективны, но при их применении быстро развивается устойчивость микобактерий к таким препаратам (через 2-4 месяца).
К резервным препаратам относятся производные парааминобензальдегида, например, тибон (производное семикарбазида 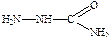 ).
).
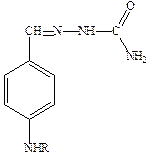
При комбинированном применении препаратов обеих групп снижается возможность развития резистентности. Парааминосалициловая кислота действует как антагонист парааминобензойной кислоты, необходимой для роста бактерий. Положительный эффект наблюдается при приеме больших доз – 9‑12 г в сутки.
Противовирусные препараты
Противовирусных препаратов чрезвычайно мало. Это объясняется недостаточными знаниями природы вирусов.
Вирусы – внеклеточная форма жизни, структурно более простая, чем бактерии. Существующий вне клетки вирус (вирион) содержит ядро, состоящее из ДНК или РНК, покрытой защитной оболочкой (капсид), построенной из одного или двух белков. В зависимости от природы нуклеиновой кислоты различают ДНК- и РНК‑вирусы.
Вирусы могут различаться по числу генов, входящих в состав нуклеиновой кислоты. Вирусы несут крайне ограниченное количество генетической информации. Их белковая оболочка содержит большое число белковых субъединиц одного или нескольких видов. Эта белковая оболочка надежно защищает нуклеиновую кислоту вируса от действия нуклеаз. Она также способна внедриться в клеточную стенку бактерий, после чего ДНК обнажается и проникает через клеточную мембрану.
В результате попадания вирусной ДНК или РНК в клетку, останавливается синтез нуклеиновых кислот клетки хозяина всего через несколько минут и начинается синтез вирусных макромолекул. После заражения клетки хозяина, размножение вируса может привести к лизису (разрушение клеточных стенок под действием ферментов). Кроме того, ДНК вируса может включаться в ДНК клетки и вызывать трансформацию клетки, в том числе и в раковую, поэтому при создании антивирусных нужно учитывать все факторы химического строения и развития вируса.
Действие противовирусного препарата должно быть направлено на какой-то этап вирусной инфекции: проникновение вируса в клетку, депротеинизация, синтез специфических белков, и при всем этом препарат должен быть не токсичен для хозяина на всех уровнях его применения. Отсюда основной подход к поиску антивирусных препаратов – это строгая направленность, основанная на определенные мишени – вирусный геном, вирус‑содержащие ферменты, ДНК- и РНК‑полимеразы вирусов.
Противовирусным эффектом обладают производные адамантана (ремантадин) и оксалин.
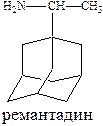
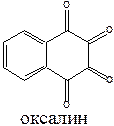
Противовирусным действием обладают также интерфероны (эндогенные низкомолекулярные белки, моль масса которых колеблется в пределах от 15 до 25 тысяч), продуцируемые в клетках человека в ответ на внедрение вируса. Они нарушают процесс репликации вирусов и являются одним из факторов неспецифического иммунитета, делая клетки частично или полностью резистентными по отношению к вирусным инфекциям.
Однако самым важным в случае такой инфекции как герпес является препарат ацикловир.
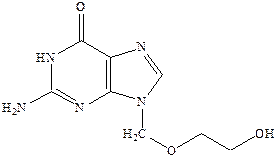
Ацикловир применяется в пораженных вирусом клетках, где он превращается в моно‑, а затем ди‑ и трифосфат, который тормозит синтез и репликацию ДНК вируса.
Зидовудин (азидотимидин) оказывает иммуностимулирующее действие в комплексной терапии СПИДа, поскольку подавляет репликацию ВИЧ, но не убивает.
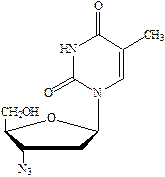
Противоопухолевые препараты
Злокачественные новообразования являются одной из ведущих проблем, ибо ежегодно свыше 5 миллионов человек на Земле умирают от этой патологии. Известно несколько групп соединений, которые проявляют противоопухолевый эффект, но при этом, как правило, затрагивают и нормальные клетки. Это антиметаболиты и цитостатические препараты: ацилирующие агенты, комплексы лигандов, природные соединения алкалоиды, антибиотики, ферменты и гормоны.
Действие антиметаболитов обусловлено нарушением синтеза нуклеиновых кислот. Они разнообразны по структуре. Обычно это производные витаминов, гетероциклических оснований, кислот и т.д. Они влияют на активность фермента, что проявляется в виде терапевтического эффекта.
Большинство простейших организмов не способны синтезировать пурины и должны получать их от организма хозяина и должны иметь ферментативные системы пригодные для их переработки. Отсюда, поиск соответствующих антиметаболитов.
К числу антиметаболитов аналогов пурина относят 6‑меркаптопурин. Механизм цитостатического действия его обусловлен нарушением синтеза ДНК и РНК путем блокады включения в них аденина и гуанина. Будучи структурным аналогом аденина 6‑меркаптопурин является антиметаболитом пурина. Он нарушает нормальный пуриновый обмен, вследствие чего нарушается синтез нуклеиновых кислот. Препарат показан при лечении острого лейкоза (рак крови).
Антиметаболиты, производные пиримидина, нарушают пиримидиновый обмен, влияют на активность фермента, участвующего в синтезе нуклеиновых кислот. Например, 5‑фторурацил снижает активность фермента тимидил-синтетазы.
5‑фторурацил это пример образования высокоактивных соединений при метаболизме менее эффективного противоопухолевого препарата, который называется фторафур.
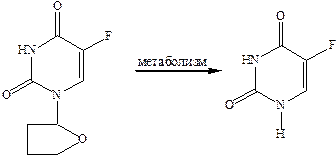
Его применяют при рецидивном и иноперабельном раке желудка, толстой и прямой кишки, поджелудочной железы. 5‑фторурацил обладает сильным токсическим действием.
Наиболее многочисленна группа цитостатических препаратов, включающая ацилирующие агенты, например,
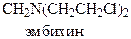
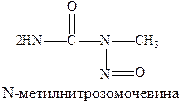
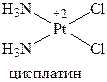
Цисплатин представляет собой плоский комплекс с центральным атомом платины, окруженным двумя лабильными атомами хлора и двумя относительно инертными аммониевыми фрагментами в цис‑конфигурации.
Ацилирующие агенты способны реагировать с нуклеофильными центрами белковых молекул, нарушая главным образом синтез ДНК и в меньшей степени синтез РНК. В результате нарушается жизнедеятельность клетки.
Хлорэтиламины обладают высокой токсичностью и в дозах, близких к лечебным, могут вызывать побочные явления проявляющиеся в сильном угнетении костно-мозгового кроветворения и нарушениях функции желудочно-кишечного тракта. Эмбихин применяют при лимфогрануломатозе, лимфолейкозе, а N-метилнитрозомочевину при раке легких.
Цисплатин по механизму действия сходен с алкилирующими агентами. Главной мишенью для проявления цитотоксичности цисплатина является ДНК. Он взаимодействует именно с пиримидиновыми и пуриновыми основаниями ДНК, не реагируя с фосфатами или сахарными остатками. Сшивая нити ДНК, цисплатин обеспечивает длительное подавление биосинтеза и гибель патологических клеток. Применяют его при злокачественных опухолях мочевого пузыря.
В борьбе с опухолевыми патологиями могут полезны ферменты. Речь прежде всего идет о L‑аспарагиназе – фермент, основная функция которого дезаминирование аспарагина до аспарагиновой кислоты. Вероятный механизм его действия: способность нарушать метаболизм аминокислоты аспарагина, которая необходима некоторым опухолевым клеткам. Иногда L‑аспарагиназа оказывается более эффективной, чем другие противоопухолевые препараты.
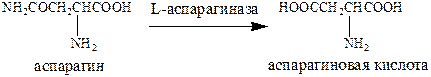
Недавно появились новые данные о возникновение и росте опухолей при воздействии свободных радикалов, в частности оксида азота (II) – N=O. Целый ряд патологических состояний в том числе сердечно-сосудистые заболевания, инфекции, повреждения мозга вызваны избыточным высвобождение N=O. Нежелательными токсикологическими эффектами перепродукции N=O являются коллапс (падение ритмов сердца до нуля), клеточные повреждения, септический шок (падение давления), поэтому в ряде случаев возникает необходимость ингибирования N=O.
Оксид азота при перепродукции его в организме может выступать в качестве медиаторов воспаления и факторов вызывающих модификацию белков и повреждение нуклеиновых кислот. Эти эффекты могут привести к инициализации канцерогенеза. Возможно, именно свободные радикалы и N=O ответственны за повреждение белков, мембран, ДНК и РНК.
Анальгетики
Под анальгетиками подразумеваются средства, доминирующим эффектом которых является ослабление или устранение чувства боли. Их принято разделять на две группы:
а) наркотические анальгетики: морфин и близкие к нему алкалоиды (опиаты) и синтетические соединения, обладающие подобными свойствами (опиоиды).
б) ненаркотические анальгетики, включая нестероидные противовоспалительные препараты.
В обычной медицинской практике широко распространены анальгетики относящиеся к производным пиразола и п‑аминофенола. Производные фенилпиразалола – аминопирин и анальгин. Производные п‑аминофенола – фенацетин и парацетамол. Производные салициловой кислоты – салицилат натрия, аспирин, салициламид.
Обычно эти препараты оказывают не только обезболивающий эффект, но и жаропонижающий, т.е. являются антипиретиками.
В последнее время установлено, что применение аминопирина и фенацетина (если это длительно) вызывает нежелательные побочные эффекты, вплоть до канцерогенного влияния аминопирина и нефротоксического действия фенацетина, что привело к ограничению использования этих препаратов.
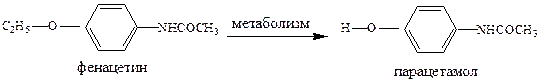
Парацетамол является основным метаболитом фенацетина и дезаминирование в организме протекает очень быстро. По-видимому, обезболивающий эффект фенацетина вызван именно этим обстоятельством, т.е. фенацетин - пролекарство, а парацетамол – истинное лекарство. Парацетамол не обладает противовоспалительной активностью и применяется как болеутоляющее средство. В его анальгетическом эффекте имеется центральный компонент – снижается уровень простагландинов в структурах головного мозга, уменьшается поступление болевых импульсов по восходящим путям спинного мозга.
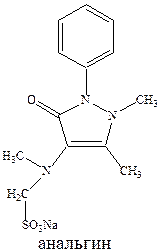
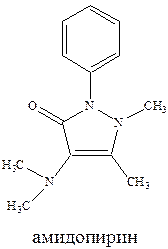
Анальгин обычно применяется для снижения температуры тела. Его эффект развивается быстро в отличие от амидопирина, не обладает судорожным действием, может назначаться перорально, внутривенно, внутримышечно. Однако (и это свойственно для всех производных пирозалола) он резко угнетает кроветворение. В этой связи сейчас все чаще применяют жаропонижающее средство парацетамол, причем чаще применяется его комбинация с ацетилсалициловой кислотой. При этом усиливается и жаропонижающий и болеутоляющий эффекты, и что очень важно, парацетамол защищает слизистую желудка от раздражающего действия ацетилсалициловой кислоты.
Салицилаты – это первые препараты, для которых было обнаружено противовоспалительная активность, но механизм действия салициловой кислоты все еще изучается.
Салициловая кислота оказывает противовоспалительный, жаропонижающий и болеутоляющий эффекты и применяется еще как антиревматическое средство.
Противовоспалительная активность ацетилсалициловой кислоты вызвана влиянием на процессы, протекающие в очаге воспаления, а именно снижением проницаемости капилляров и снижении активности фермента, расщепляющего гликозидные связи, и ингибированием энергетического обеспечения путем торможения образования аденозинтрифосфата. Важную роль в этом отношении имеет ингибирование синтеза простагландинов свойственное для нестероидных противовоспалительных препаратов.
Анальгезирующий эффект связан с действием на центры болевой чувствительности, а также способностью снижать вызывающее боль действие брадекинина (чушь какая-то, абракадабрина). С влиянием на биосинтез, метаболизм и высвобождение простагландинов связаны различные положительные и негативные эффекты ацетилсалициловой кислоты. Именно с этим связано антиагрегационная активность этого препарата – способность ингибировать агрегацию тромбоцитов, что находит применение для предотвращения различных тромбозов: послеоперационных тромбофлебитов, нарушения мозгового кровообращения, образование тромбов при ишемической болезни сердца. С другой стороны, торможение синтеза простагландинов приводит к ряду осложнений, важнейшими из которых являются повышение кислотности желудочного сока, нарушение кровоснабжения слизистой, возникновение желудочных кровотечений. Поскольку такой риск существует не только для ацетилсалициловой кислоты, но и для других нестероидных противовоспалительных средств целесообразно посмотреть данные, связанные с биосинтезом и ролью простагландинов в живом организме.
Простагландины – это вторичные месенджеры, преобразующие информацию гормонов или нейромедиаторов в соответствии физиологическому ответу. Обычно они действуют сильно, но кратковременно, т.к. разрушение из специфическими дегидрогеназами протекает быстро.
Из продуктов питания в организм поступает γ‑линолениковая кислота, которая затем превращается в арахидоновую, накапливающуюся в составе фосфолипидов клеточной мембраны и высвобождающуюся оттуда под действием фермента фосфолипазы.
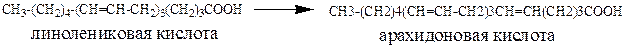
Простогландины играют важнейшую роль в течении физиологических и паталогических процессов в тканях, поэтому при торможении их синтеза в стенке желудка, где простагландины регулируют ее защитные свойства, нормализуя кровоснабжение и снижая секрецию соляной кислоты, приводит к ульцерогенному эффекту (изъязвлению).
Второй путь метаболизма арахидоновой кислоты связан с ее трансформацией под действием ферментов, в результате образуются лекотриены, вызывающие воспаление и ответственные за симптомы астмы.
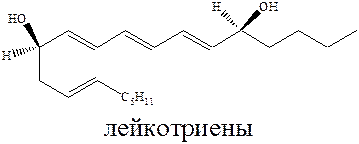
Необратимое ингибирование нестероидными противовоспалительными препаратами простагландинсинтетазы приводит к побочным эффектам, связанными с желудочными заболеваниями. С другой стороны уменьшение синтеза простогландинов приводит к нормализации функции тканей пораженных ревматизмом. Опасным осложнением применения нестероидных противовоспалительных препаратов является бронхоспазм.
Блокада синтеза простагландинов может вызвать сдвиг метаболизма арахидоновой кислоты в сторону лейкотриенов, а это отек тканей и спазмы гладкой мускулатуры.
К числу наиболее эффективных противовоспалительных средств относятся ибупрофен и ортофен.
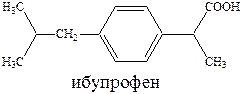
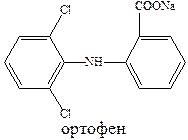
Ибупрофен малотоксичен и близок к салицилатам по противовоспалительной и анальгезирующей активности. Стимулирует образование эндогенного интерферона, обладает значительным жаропонижающим эффектом, лечит ревматоидный артрит и снижает температуру тела.
Ортофен хорошо проникает в полость суставов при ревматоидном артрите, артрозах. Используется для купирования болей и при заболеваниях слизистой оболочки полости рта и парадонтите.
Наркотические анальгетики
Основным источником наркотических анальгетиков являются алкалоиды опия, выделяемые из опийного мака. Синтез морфина впервые был осуществлен в 1950 году, но не нашел промышленного применения в виду своей сложности. Производные морфина кодеин и этилморфин синтезируют из морфина. Более простые заменители морфина промедол и лидол получают путем химических превращений.
Эта группа соединений характеризуется сильной анальгезирующей активностью, позволяющей использовать их в экстраординарных случаях (хирургическом вмешательстве, ранениях, злокачественных новообразованиях, сопровождающихся сильным болевым синдромом).
Другой характеристикой соединений этого типа является влияние на центральную нервную систему, выражающуюся в эйфории и, в конечном счете, появлением физической и психологической зависимости (наркомания), что ограничивает их длительное применение, несмотря на имеющуюся их эффективность.
Развитие синдрома физической зависимости приводит к тяжелым последствиям – синдрому абстиненции («ломка»), при прекращении введения препарата.
Еще одна особенность – наличие специфических антагонистов, способных снять как анальгезирующее действие, так и токсические явления, связанные с применением этих препаратов.
В малых концентрациях, не достаточных для того, чтобы вызвать сон, морфин вызывает эйфорию и освобождает от боли – анальгезию.
Морфин обладает выраженной стереоселективностью.
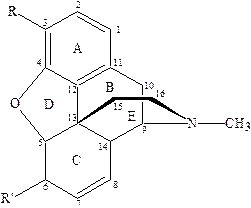 или
или 
В молекуле этого алкалоида 5 асимметрических атомов углерода (С5, С6, С9, С13, С14). Такое количество асимметрических атомов теоретически допускает возможность существования 32 оптических изомеров морфина, но ограничения, которые налагаются мостиковой этиламинной цепочкой, создающей кольцевую систему С9-С13, приводит к тому, что морфин существует лишь в виде 16 оптических изомеров. Центры С5, С6, С9 являются левовращающими, а С13, С14 – правовращающими.
Одной из причин отличающейся физиологической активности стереоизомерных лекарственных препаратов является различия в их проникновении в организм. Они могут быть связаны как с особенностями строения и свойствами биологических мембран, которые сами построены из оптически активного асимметрического материала, так и с наличием в мембранах специальных систем, осуществляющих перенос метаболитов через мембраны.
Морфин и близкие алкалоиды – яркий пример влияния пространственной конформации на физиологическую активность соединения. Морфин, содержащийся в естественном растительном сырье, является одним из левовращающих изомеров. Введение этого препарата вызывает сильную анальгезию, а синтезированный правовращающих изомер морфина полностью лишен каких бы то ни было анальгезирующих свойств.
Молекулу морфина много раз модифицировали. При этом удавалось получать соединения со значительно большей анальгезирующей активностью. К сожалению повышение активности всегда сопровождалось повышением токсичности, способностью вызывать пристрастие, к сокращению продолжительности эффекта и другим нежелательным явлениям.
| R | R’ | Активность, в относительных единицах | Название препарата |
| НО | НО | 100 | морфин |
| CH3O | НО | 10 | кодеин |
| C2H5O | НО | 10 | дионин |
| НО | CH3O | 160 | гетерокодеин |
| НО | OCOCH3 | 400 | α‑ацетилморфин |
| OCOCH3 | OCOCH3 | 180 | диаморфин, героин |
Токсичность препарата оценивается дозой LD50, при введении которой наступает гибель 50% экспериментальных животных.
Анальгин обладает значительно меньшими анальгезирующими свойствами, чем морфин, но часто достаточными, чтобы помочь при болях. Кроме того, кодеин оказывает угнетающее действие на кашлевой центр, тем самым снижается частота кашля. Кодеин в меньшей степени чем морфин, но вызывает зависимость. Отсюда, для его применения те же ограничения, что и для других наркотических анальгетиков.
При передозировке морфина имеет место угнетение дыхания и снижение артериального давления, тошнота.
Решающее значение в проявлении анальгетической активности молекулы морфина имеет наличие свободной фенольной группы. Так при изменении R в положении 3 молекулы кодеина в ряду метил – этил – ацил (CH3-, C2H5-, -COCH3) наблюдается снижение обезболивающего эффекта. Вероятно, это связано с потерей стерического соответствия препарата с местом связывания.
Удаление кольца Е в структуре морфина приводит к полному исчезновению активности. Этот факт свидетельствует о важности наличия основного азота в данной структуре для проявления анальгетической активности. При удалении из структуры колец С и D, молекула преобразуется в бензоморфаны, обладающие умеренной анальгетической активностью и низким наркотическим и галлюциногенным действием.
Наиболее важными функциональными группами в структуре морфина, необходимыми для проявления анальгетического эффекта, являются
a) водород фенольного ядра, для образования водородных связей
b) и само фенольное ядро, которое участвует в Ван-дер-ваальсовых связях.
c) азот, обеспечивает ионное взаимодействие
За угнетение центров болевой чувствительности и блокирование импульсов в коре головного мозга, при воздействии на них анальгетических средств, ответственны опиатные рецепторы. Существование их в мозге показано в опытах на мышах, при исследовании стереоспецифического взаимодействия аналогов морфина – агониста леворфанола и антагониста налоксона.
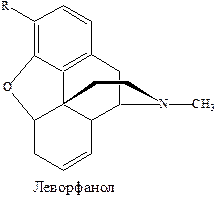
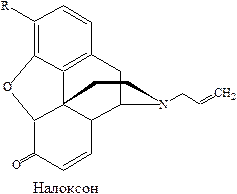
Был выделен липопротеин с молекулярной массой 60 тысяч и предположено, что агонист вызывает в нем конформационные изменения, в результате которых биологическим ответом является анальгезия. Лигандами опиатных рецепторов являются нейропептиды, которые связываются с опиатным рецептором и оказывают анальгезирующее действие. Их эффект, как это вообще характерно для агонистов, блокируется антагонистами опиатов.
Есть предположение, что многие анальгетики, но не морфин, который взаимодействует с опиатными рецепторами, не связываются с самими рецепторами, а являются ингибиторами фермента, разрушающего нейропептиды, в частности пентапептиды. Таким образом, эти анальгетики повышают уровень этих нейропептидов и оказывают обезболивающий эффект. При гидролизе в мозге человека липопротеина, образуются анальгетические полипептиды – эндорфины. Наиболее активный из них β‑эндорфин вдвое активнее морфина и вызывает более длительную анальгезию, которая снимается налоксоном. Некоторые ученые рассматривают β‑эндорфин в качестве гормона, подавляющего высвобождение других нейромедиаторов.
В организме человека анальгетики начинают выделяться только как реакция на возникновение боли, т.е. их взаимодействие с опиатными рецепторами может рассматриваться как компенсаторный эффект.
Возникновение при применении морфина психической зависимости направило изыскания учеными более простых аналогов, не вызывающих эйфорию. Например, синтез промидола и лидола.
При синтезе промидола исходят из ацетона и винилацетилена, конденсация которых приводит к 2‑метилгексадиен‑2,5‑ин‑3. Далее гидратация по Кучерову дает кетон, при взаимодействии которого с метиламином образуется замещенный пиперидон. Реакция последнего с фениллитием дает замещенный пиперидол, который ацилируют пропионилхлоридом.
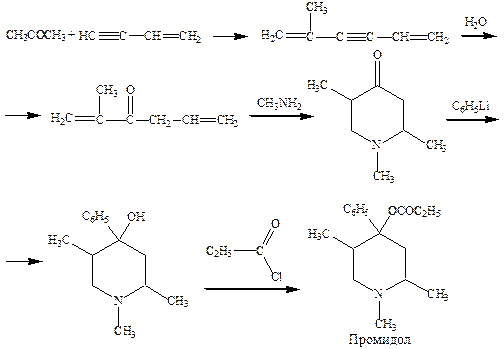
Недостаток указанного способа – получение на конечной стадии трех изомеров, вследствие чего выделение целевого продукта затрудняется.
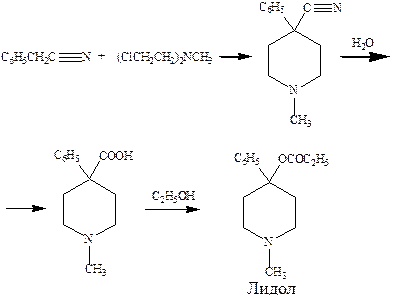
В этом синтезе лидола исходят из бензилцианида, конденсация которого с бисхлорэтилметиламином и последующим омылением продуктов конденсации нитрильной группы дают кислоту, а этерификация этой кислоты приводит к лидолу.
Характер связывания опийных анальгетиков с рецепторами существенно зависит от структурных особенностей конкретного соединения. Так полные агонисты рецепторов – морфин, промедол. Истинным антагонистом опиатных рецепторов является налоксон. Он блокирует связывание агонистов с этими рецепторами и способен вытеснить их, нарушая их рецептивные взаимодействия. Благодаря этому свойству налоксон может использоваться при интоксикации, вызванной наркотическими анальгетиками.
Однако есть и препараты обладающие смешанной активностью, давая в зависимости от типа рецепторов агонистический или антагонистический эффекты. Например, соединение с тривиальным названием налорфин вследствие агонистического эффекта оказывает анальгетический эффект, но слабее чем морфин. С другой стороны он ослабляет угнетение дыхание и снижение артериального давления, вызванное морфином.
Дата: 2018-12-21, просмотров: 352.