Если необходимо получать большое число производных, аналогичных по строению соединению-лидеру и (или) улучшать активность соединения-лидера, то комбинаторный синтез позволяет быстро получать аналоги, которые только слегка отличаются по строению с лидером.
Комбинаторный синтез для нахождения лекарственного препарата
Поиск нового соединения-лидера является движущей силой развития комбинаторного синтеза. Столкнувшись лицом к лицу с множеством новых мишеней, фармацевтические компании испытывают проблему с идентификацией функций каждой мишени, нахождения соединения-лидера для каждой мишени и оптимизации строения лидера по возможности быстрее. Здесь появляется реальная необходимость в комбинаторном синтезе. Он обеспечивает получение огромного количества соединений, но кроме этого при таких объемах синтеза повышается шанс нахождения новых соединений-хитов. Успех достигается применением новых технологий органического синтеза.
Цель комбинаторного синтеза заключается в том, чтобы одновременно создать молекулярное множество. Это может быть достигнуто, проводя взаимодействие исходных веществ комбинаторно. Например, взаимодействие соединения X с соединением Y дает единственное соединение X-Y, тогда как комбинаторный синтез соединения X1-n, с каждым соединением Y1-m, дает все возможные комбинации:
| X1 | X2 | Xn | |
| Y1 | X1–Y1 | X2–Y1 | Xn–Y1 |
| Y2 | X1–Y2 | X2–Y2 | Xn–Y2 |
| Ym | X1–Ym | X2–Ym | Xn–Ym |
Синтез каждой комбинации может быть выполнен в отдельных реакционных сосудах (параллельный синтез) или одновременно в смеси.
Существует два возможных пути реализации синтеза библиотек соединений – жидкофазный синтез и синтез на твердых подложках (твердофазный синтез). Последний имеет значительно большее распространение из-за его достаточной простоты и возможности автоматизации.
Жидкофазный синтез
Преимущества:
- Жидкофазный синтез возможен при использовании всех известных синтетических методов без каких либо ограничений
- Реакция проходит в гомогенных условиях
- Можно легко использовать нагревание
- Реакцию можно контролировать
- Возможна очистка и анализ продуктов реакции на каждой стадии
Недостатки:
- После окончания реакции все целевые соединения и побочные продукты находятся в смеси и требуется их разделение
- При использовании избытка реагентов, для достижения хороших выходов продуктов, эти реагенты необходимо тщательно очищать
- В том случае, если реагенты, продукты и побочные соединения невозможно перегнать или они не выпадают в осадок, их можно разделить или очистить только экстракцией или хроматографически, что обычно требует большого времени
- Автоматизация процессов очистки соединений в растворе весьма затруднительна
Процессы создания библиотек путем реакций в растворе делятся на параллельный синтез и синтез смесей.
Параллельный синтез протекает как обычные реакции, только их много, и они идут одновременно в отдельных реакционных сосудах. В этом случае в конце превращения регенты и побочные продукты летучи, их выпаривают. Если это невозможно, иногда используют кислотно-основную экстракцию или колоночную хроматографию. Это обычно затруднительно при наличии большого числа получаемых соединений.
Все это приводит к тому, что жидкофазный способ создания библиотек относительно мало распространен.
Твердофазный синтез
В органической химии нет ни одной реакции, обеспечивающей на практике количественные выходы целевых продуктов в любом случае. Единственное исключение составляет, по-видимому, полное сжигание органических веществ в кислороде при высокой температуре до СО2 и Н2О. Поэтому очистка целевого продукта является сложной и трудоемкой задачей. Например, 100%-ная очистка продуктов пептидного синтеза является трудноразрешимой проблемой. Действительно, первый полный синтез пептида, гормона окситоцина (1953 г), содержащего всего 8 аминокислотных остатков, рассматривался как выдающееся достижение, принесшее его автору, В. дю Виньо, Нобелевскую премию 1955 г. Однако уже в следующие двадцать лет синтезы полипептидов подобной сложности превратились в рутину, так что в настоящее время синтез полипептидов, состоящих из 100 и более аминокислотных остатков, уже не рассматривается как непреодолимо трудная задача. Что вызвало столь драматические изменения в области синтеза полипептидов?
Дело в том, что в начале 60-х годов был предложен новый подход к решению проблем выделения и очистки, возникающих в пептидном синтезе. Позже автор открытия этого подхода, Р.Б. Меррифилд, в своей Нобелевской лекции рассказал, как это произошло: “Однажды у меня возникла мысль о том, как может быть достигнута цель более эффективного синтеза пептидов. План состоял в том, чтобы собирать пептидную цепь постадийно, причем во время синтеза цепь должна быть одним концом привязана к твердому носителю”. В результате выделение и очистка промежуточных и целевых производных пептидов сводились просто к фильтрованию и тщательной промывке твердого полимера для удаления всех избыточных реагентов и побочных продуктов, остающихся в растворе. Такая механическая операция может быть выполнена количественно, легко стандартизируется и может быть даже автоматизирована. Рассмотрим эту процедуру более подробно.
Полимерный носитель в методе Меррифилда – это гранулированный сшитый полистирол, содержащий хлорметильные группы в бензольных ядрах. Эти группы превращают полимер в функциональный аналог бензилхлорида и сообщают ему способность легко образовывать сложноэфирные связи при реакции с карбоксилат-анионами. Конденсация такой смолы с N-защищенными аминокислотами ведет к образованию соответствующих бензиловых эфиров. Удаление N-защиты из дает С-защищенное производное первой аминокислоты, ковалентно связанное с полимером. Аминоацилирование освобожденной аминогруппы N-защищенным производным второй аминокислоты с последующим удалением N-защиты приводит к аналогичному производному дипептида также привязанному к полимеру:
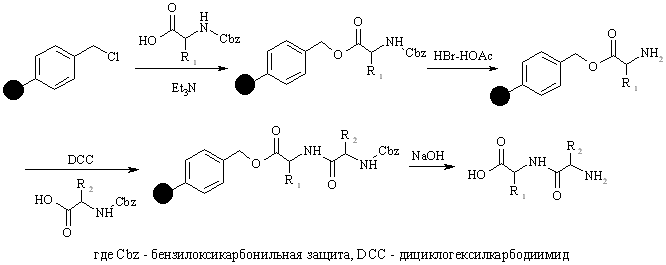
Такой двустадийный цикл (удаление защиты-аминоацилирование) может быть, в принципе, повторен столько раз, сколько требуется для наращивания полипептидной цепи заданной длины.
Использование твердого носителя само по себе еще не может упростить решение проблемы отделения n-звенного пептида от его (n-1)-членного предшественника, поскольку оба они привязаны к полимеру. Однако этот подход позволяет безопасно использовать большие избытки любого реагента, необходимые для достижения практически 100%-ной конверсии (n-1)-членного предшественника в n-членный пептид, так как привязанные к носителю целевые продукты на каждой стадии могут быть легко и количественно освобождены от избыточных реагентов (что было бы весьма проблематично при работе в гомогенных системах).
Сразу же стало понятно, что возможность очистки продукта после каждой реакции путем простого фильтрования и промывки, и то, что все реакции можно проводить в одном реакционном сосуде, составляют идеальные предпосылки для механизации и автоматизации процесса. Действительно, всего три года потребовалось для разработки автоматической процедуры и аппаратуры, позволяющих выполнять программируемый синтез полипептидов с заданной последовательностью аминокислотных остатков. Первоначально и сама аппаратура (емкости, реакционные сосуды, шланги), и система управления были очень примитивны. Тем не менее, мощь и эффективность общей стратегии были убедительно продемонстрированы рядом пептидных синтезов, выполненных на этом оборудовании. Так, например, с помощью такой полуавтоматической процедуры был успешно выполнен синтез природного гормона инсулина, построенного из двух полипептидных цепей (состоящих из 30 и 21 аминокислотных остатков), связанных дисульфидным мостиком.
Твердофазная техника приводила к существенной экономии труда и времени, необходимых для пептидного синтеза. Так, например, ценой значительных усилий Хиршмен с 22 сотрудниками завершили выдающийся синтез фермента рибонуклеазы (124 аминокислотных остатка) с помощью традиционных жидкофазных методов. Почти одновременно тот же белок был получен путем автоматизированного твердофазного синтеза. Во втором случае синтез, включающий 369 химических реакций и 11 931 операцию, был выполнен двумя участниками (Гатте и Меррифилд) всего за несколько месяцев (в среднем до шести аминокислотных остатков в день присоединялись к растущей полипептидной цепи). Последующие усовершенствования позволили построить полностью автоматический синтезатор.
Метод Меррифильда и послужил основой для нового направления органического синтеза – комбинаторной химии.
Хотя иногда комбинаторные эксперименты проводятся в растворах, но в основном, они осуществляются с использованием твердофазной техники – реакции протекают с использованием твердых подложек в виде сферических гранул полимерных смол. Это дает ряд преимуществ:
- Различные исходные соединения могут быть связаны с отдельными гранулами. Затем эти гранулы смешиваются и, таким образом, все исходные соединения могут взаимодействовать с реагентом в одном эксперименте. В результате продукты реакции образуются на отдельных гранулах. В большинстве случаев, смешивание исходных в традиционной жидкой химии приводит обычно к неудачам – полимеризации или осмолению продуктов. Эксперименты на твердой подложке исключают эти эффекты.
- Поскольку исходные материалы и продукты связаны с твердой подложной, то избыток реагентов и не связанных с подложкой продуктов можно легко отмыть от полимерной твердой подложки.
- Можно использовать большие избытки реагентов, для того чтобы провести реакцию до конца (больше, чем 99%), поскольку эти избытки легко отделяются.
- В случае использования низких объемов загрузок (менее 0,8 ммоль на грамм подложки) можно исключить нежелательные побочные реакции.
- Интермедиаты в реакционной смеси связаны с гранулами и их нет необходимости очищать.
- Индивидуальные гранулы полимера могут быть разделены в конце эксперимента и таким образом получаются индивидуальные продукты.
- Полимерная подложка может быть регенерирована в тех случаях, когда подобраны условия разрыва и выбраны соответствующие якорные группы – линкеры.
- Возможна автоматизация твердофазного синтеза.
Необходимыми условиями проведения твердофазного синтеза, кроме наличия нерастворимой полимерной подложки, инертной в реакционных условиях, являются:
- Присутствие якоря или линкера – химической функции, обеспечивающей связь подложки с наносимым соединением. Он должен быть ковалентно связан со смолой. Якорь также должен являться реакционно-способной функциональной группой для того, чтобы субстраты могли взаимодействовать с ним.
- Связь, образующаяся между субстратом и линкером должна быть стабильна в условиях реакции.
- Должны существовать способы разрыва связи продукта или интермедиата с линкером.
Рассмотрим подробнее отдельные компоненты твердофазного метода синтеза.
Твердая подложка
Как сказано выше, первыми типами смол, которые использовал Меррифильд, были полистирольные гранулы, где стирол был сшит с 1% дивинилбензола. Гранулы были модифицированы хлорметильными группами (линкер), с которыми аминокислоты могли быть соединены через эфирные группы. Эти эфирные связи стабильны в реакционных условиях, которые применялись для петидного синтеза.
Одним из недостатком полистирольных гранул является то факт, что они гидрофобны, тогда как растущая пептидная цепь гидрофильна. В результате, иногда растущая пептидая цепь не сольватируется и сворачивается за счет образования внутримолекулярных водородных связей. Такая форма затрудняет доступ новых аминокислот к концу растущей цепи. Поэтому часто используются более полярные твердые подложки, такие как полиамидные смолы. Такие смолы более пригодны для непептидного комбинаторного синтеза.
Выбор твердой подложки
Синтетические подходы к получению библиотек часто определяются природой выбранной полимерной подложки. Гранулированный полимер должен соответствовать некоторым критериям, в зависимости от стратегий синтеза и скрининга.
Для получаемых библиотек имеют важное значение размер и однородность гранул, а также устойчивость смолы к формированию кластеров. Способность смолы к набуханию в органической и водной среде особенно важна, когда используются обязательные пробы для скрининга структуры, находящейся еще на грануле.
Основные типы полимерных смол для комбинаторного синтеза используемые в настоящее время:
- Полистирол, сшитый с 0,5-2% дивинилбензола (StratoSpheres)
- Полиэтиленгликоль, привитый на сшитом сополимере полистирол- 1% дивинилбензол (TentaGel, AgroGel, NovaGel)
- Полиэтиленгликоль, привитый на 1% сшитый полистирол (PEG-PS)
- Полистирольная макропористая смола с высокой степью сшивки (AgroPore, TentaPore)
- Сополимер бис-2-акриламидполиэтиленгликоль-моноакриламидо-полиэтиленгликоль (PEGA)
- Диметилакриламид нанесенный на макропористую матрицу кизельгура (Pepsyn K)
- Диметилакриламид нанесенный на макропористую матрицу – сшитый 50% полистирол-дивинилбензол (Polyhipe)
Хотя классические гранулированные смолы больше подходят для комбинаторного синтеза библиотек соединений, иногда используются альтернативные носители.
Например, целлюлоза является хорошей подложкой для многократного “капельного синтеза” пептидов или для синтеза библиотек на бумаге. “Капельные” синтезы проводят путем капания растворов защищенных аминокислот на модифицированную бумагу в присутствии активирующего реагента. Здесь реакционным сосудом является непосредственно носитель и нет необходимости манипуляций, характерных для жидких сред в течение синтеза (обычно встряхивание в случае твердофазного синтеза). Реакция идет за счет диффузии жидкости в носителе. Этот принцип внутреннего объемного синтеза был проверен при использовании полимерных носителей на синтезаторе, использующем центрифугирование для устранения жидкости. Было найдено, что капельная техника сопоставима с классическим функционированием твердой фазы в пептидном синтезе.
Было также найдено, что хлопок (вата), как самая чистая форма целлюлозы может служить удобной подложкой твердой фазы, особенно для множественного синтеза или генерирования библиотеки.
Хотя гранулы и являются наиболее распространенной формой твердой положки, но и другие виды (например, иглы) могут также использоваться для комбинаторного синтеза. Модифицированная стеклянная поверхность также может быть применена для олигонуклеотидного синтеза.
Линкеры
Линкер – это молекулярный фрагмент, ковалентно связанный с твердой подложкой. Он содержит реакционноспособные функциональные группы, с которыми взаимодействует первый реагент и который в результате становится связанным со смолой. Образующаяся связь должна быть стабильной в реакционных условиях, но легко разрываться на конечной стадии синтеза.
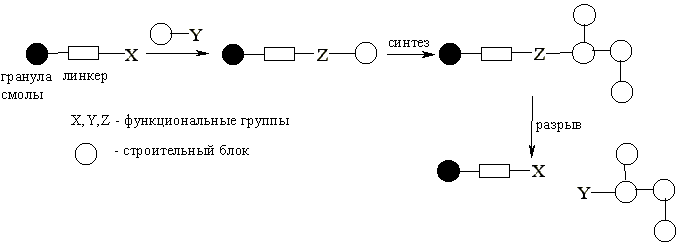
Различные линкеры используются в зависимости от того, какая функциональная группа присутствует в субстрате и от того, какая функциональная группа должна быть сформирована в конце процедуры.
В практике комбинаторного синтеза чаще всего используются следующие линкеры:
- Хлорметильный (-CH2Cl),
- Гидроксильный (-OH),
- Аминный (-NH2),
- Альдегидный (-CHO),
- Силильный (-OSiR3).
| Тип линкера | Тип смолы | Что присоединяет | Что синтезирует | Чем осуществляется разрыв |
| Галогенметил | 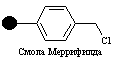
| Карбоновые кислоты, спирты, фенолы, тиолы, амины | Кислоты, спирты, сложные эфиры, тиоэфиры | TFMSA, H2/Pd, i-Bu2AlH, MeONa, HF |
| Галогенметил | 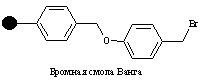
| Алкил и ариламины | Анилиды и сульфамиды | CF3COOH, SOCl2/CF3COOH |
| Галогенметил | 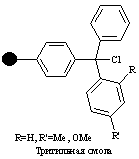
| Спирты, кислоты, фенолы, тиолы, амины | Спирты, кислоты, тиолы, амины, сложные эфиры | 1-5% CF3COOH, 30% гексафторизопропанол |
| Гидроксил | 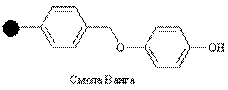
| Спирты, кислоты | Спирты, кислоты, амиды | CF3COOH, амин/AlCl3, i-Bu2AlH |
| Гидроксил | 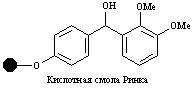
| Спирты, кислоты | Спирты, кислоты | 5% CF3COOH, 10% AcOH |
| Гидроксил | 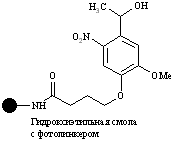
| Кислоты | Кислоты | Свет с длиной волны 365 нм. Линкер стабилен к CF3COOH и пиперидину |
| Гидроксил | 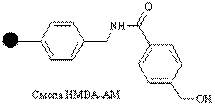
| Кислоты | Амиды кислот, спирты, сложные эфиры, гидразиды | Нуклеофилы (NaOH,NH3/MeOH, NaBH4/EtOH, MeOH/CF3COOH, NH2NH2/DMF |
| Гидроксил | 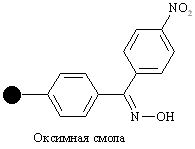
| Защищенные пептиды, ки-слоты | Циклические пепти-ды, мочевины | 25% CF3COOH, гидразиды |
| Гидроксил Линкер Ринкера | 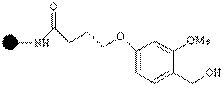
| Спирты, кисло-ты, фенолы | Спирты, кислоты, фенолы | 1-5% CF3COOH |
| Амино | 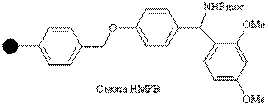
| Кислоты | Карбоксамиды | 95% CF3COOH |
| Амино | 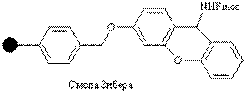
| Кислоты | Защищенные амиды | 1% CF3COOH |
| Амино | 
| Кислоты | Альдегиды и кетоны | LiAlH4 и реактивы Гриньяра |
| Амино | 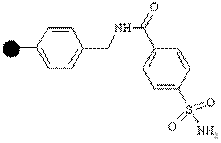
| Карбоновые кислоты | Амиды или карбоновые кислоты | Активация сульфонамида диазометаном или бромацетонитрилом с последующей атакой нуклеофилом амина или гидроксида |
| Альдегид | 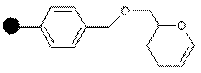
| Первичные или вторичные спирты | Спирты | 95% CF3COOH/H2O или CF3COOH/CH2Cl2/EtOH |
| Альдегид | 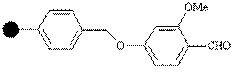
| Амины | Карбоксамиды, сульфонамиды | CF3COOH |
Смолы Ванга могут быть использованы в пептидном синтезе посредством N-защищенной аминокислоты, связанной с линкером эфирной связью. Такая эфирная связь устойчива к сочетанию и стадии снятия защиты, но может быть разрушена трифторуксусной кислотой для снятия конечного пептида с гранулы смолы.
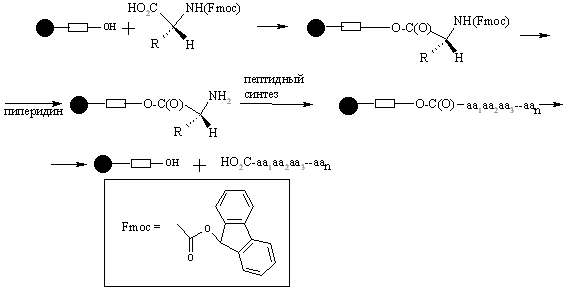
Субстраты с карбоксильной группой могут быть связаны со смолой Ринка через амидную связь. Как только процедура заканчивается, взаимодействие с трифторуксусной кислотой освобождает продукт с первичной амидной группой.
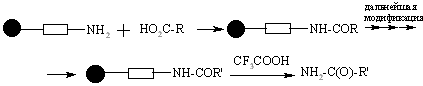
Первичные и вторичные спирты могут быть связаны со смолой, модифицированной дигидропираном. Связывание спирта происходит в присутствии 4-толуолсульфоната в дихлорметане. Снятие продукта происходит с использованием трифторуксусной кислоты:
Дата: 2018-12-21, просмотров: 468.