Опыт 1. Определение знака заряда ча с тиц мет о дом капиляризаци и
Ход работы:
На листок фильтровальной бумаги нанести с помощью бюретки каплю золя гидроксида железа (III) и отдельно каплю золя берлинской лазури. После всасывания капли положительно заряженные золи дают окрашенное в центре и бесцветное по краям пятно. Отрицательно заряженные золи дают равномерно до краев окрашенное пятно. Объясняется это явлением тем, что отрицательно заряженная по отношению к воде бумага адсорбирует положительные частицы и не адсорбирует отрицательные.
Определить по полученным экспериментальным данным знак заряда частиц золей гидроксида железа (III) и берлинской лазури.


Золь берлинской лазури Золь гидроксида железа ( III )
Опыт 2. Определение порога коагуляции золя гидроксида железа (III)
В 4 чистые пробирки с помощью бюреток набрать по 5 мл золя гидроксида железа (Ш), а затем с помощью пипеток добавить дистиллированную воду и раствор одного из электролитов: 1М KCl; 0,01М K2SO4; 0,001М K3[Fe(CN)6], объемы которых указаны в таблице 1.
Таблица 1
| № пробирки | Золь гидроксида железа, мл | Дистиллированная вода, мл | Раствор электролита, мл (1М KCl) | Коагуляция через 1 час |
| 1 | 5 | 4,5 | 0,5 | |
| 2 | 5 | 4 | 1 | |
| 3 | 5 | 3 | 2 | |
| 4 | 5 | 1 | 4 |
| № пробирки | Золь гидроксида железа, мл | Дистиллированная вода, мл | Раствор электролита, мл (0,01М K2SO4) | Коагуляция через 1 час |
| 1 | 5 | 4,5 | 0,5 | |
| 2 | 5 | 4 | 1 | |
| 3 | 5 | 3 | 2 | |
| 4 | 5 | 1 | 4 |
| № пробирки | Золь гидроксида железа, мл | Дистиллированная вода, мл | Раствор электролита, мл (0,001М K3[Fe(CN)6]) | Коагуляция через 1 час |
| 1 | 5 | 4,5 | 0,5 | |
| 2 | 5 | 4 | 1 | |
| 3 | 5 | 3 | 2 | |
| 4 | 5 | 1 | 4 |
Таким образом, в каждой пробирке получается по 10 мл золя одинаковой концентрации (1:1) с различным содержанием электролита. Содержимое каждой пробирки немедленно хорошо перемешать. Через I час в соответствующей графе таблицы знаком " + " отметить, в каких пробирках произошла явная коагуляция (помутнение).
Рассчитать порог коагуляции по формуле (см. приложение 2):
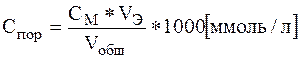
где: См - молярная концентрация раствора;
Vэ - наименьший объем исходного раствора электролита, вызывающий коагуляцию данного объема золя;
VОБЩ - сумма объемов золя исходного раствора электролита и воды. Определить коагулирующую способность электролита по формуле.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Правило Шульце-Гарди
В 6 чистые пробирки налить по 5 мл золя гидроксида железа (Ш), а в 6 другие пробирки - по 5 мл золя берлинской лазури. Затем в пробирки прилить по 1мл растворов электролитов в порядке, указанном в таблице 2.
Таблица 2
| № проб. |
Электролит |
Молярная концентрация | Золь гидроксида железа (III) | Золь берлинской лазури | ||
| коагуляция | седиментация | коагуляция | седиментация | |||
| 1 | KCl | 0,02 |
| |||
| 2 | KCl | 1,0 |
| |||
| 3 | K2SO4 | 0,02 |
| |||
| 4 | K3[Fe(CN)6] | 0,02 |
| |||
| 5 | BaCl2 | 0,02 |
| |||
| 6 | AlCl3 | 0,02 |
| |||
Пробирки встряхнуть, поставить в штатив и записать в соответствующем столбце таблицы, в какой последовательности начинается коагуляция и седиментация золей.
Учитывая концентрацию растров электролитов, расположить катионы и анионы электролитов в ряд по убывающему коагулирующему воздействию для каждого золя в отдельности и сопоставить результаты с правилом Шульце-Гарди учитывая заряд частиц изучаемых золей.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Взаимная коагуляция золей
Ход работы:
В пяти пробирках смешать золи гидроксида железа (Ш) и берлинской лазури в количествах, указанных в таблице 3.
Таблица 3
| № пробирки | Золь гидроксида железа(Ш), мл | Золь берлинской лазури | Степень коагуляции | Окраска жидкости осадком |
| 1 | 4,5 | 0,5 | ||
| 2 | 4,0 | 1,0 | ||
| 3 | 2,5 | 2,5 | ||
| 4 | 1,0 | 4,0 | ||
| 5 | 0,5 | 4,5 |
Записать в таблицу степень коагуляции (полная, неполная и т.п.) и цвет жидкости над осадком.
Сделать вывод о причине взаимной коагуляции изучаемых золей.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 5. Определение способности желатина защищать гидрозоль берлинской лазури от коагуляции его электролитами
Ход работы:
В 2 пробирки налить из бюретки по 5 мл золя берлинской лазури. Пробирки пронумеровать карандашом для стекла или фломастером.
В пробирку № 1 добавить пипеткой 1 мл свежеприготовленного 0,8% ного раствора желатина и перемешать содержимое пробирки.
В пробирку № 2 (контрольную) из бюретки добавить 1 мл дистиллированной воды, содержимое пробирки перемешать.
Через 1-2 минуты в обе пробирки добавить по 1 мл 0,2 М раствора Al(NO3)3, содержимое пробирок перемешать.
В какой пробирке происходит седиментация? Результаты наблюдений записать в таблицу 4.
Таблица 4
| № пробирки | Исследуемое вещество | Добавляемая жидкость | Добавляемый электролит | Наблюдения |
| 1 | Золь берлинской лазури | 1 мл 0,5% р-ра желатина | 1 мл 0,02 М раствора Al(NO3)3 | |
| 2 | Золь берлинской лазури | 1 мл дистиллированной воды | 1 мл 0,02 М раствора Al(NO3)3 |
Сделать вывод о причине наблюдаемых явлений.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выполнение работы проверил(а)
______________________________
Дата__________
Лабораторная работа 7
Получение эмульсий. Обращение фаз эмульсии
Опыт 1. Получение разбавленной эмульсии
Ход работы:
В пробирку наливают 6 мл воды и 2 мл 1%-ного спиртового раствора касторового масла, встряхивают и наблюдают образование эмульсии. Объяснить, почему получается эмульсия без применения эмульгатора.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 2. Получение концентрированной эмульсии
Ход работы:
В две пробирки наливают по 8 мл дистиллированной воды. В одну из них наливают 0,5 мл бензола и 1 мл 2 % раствора мыла. Пробирки закрывают пробками и тщательно взбалтывают. В одной из них наблюдают образование устойчивой эмульсии. Объяснить механизм стабилизирующего действия мыла.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 3. П олучение эмульсии масла
Ход работы:
В пробирку наливают 5 мл дистиллированной воды, вносят 5 - 6 капель растительного масла и, закрыв пробирку, сильно встряхивают. Получившаяся эмульсия довольно быстро разрушается, расслаивается вследствие слияния капелек друг с другом (коалесценция). Для стабилизации эмульсии прибавляют несколько капель 1% раствора одного из названных выше гидрофильных веществ – стабилизаторов, например, натриевого (обыкновенного) мыла, или Na2СO3 или NaOH (которые со свободными жирными кислотами масла дают натриевое мыло) и вновь сильно встряхивают. Получается стойкая, тонкая эмульсия молочно-белого цвета.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Получение эмульсии масла без применения механического воздействия
Ход работы:
Через капилляр вливают в воду раствор, состоящий из 3 мл касторового (льняного или минерального) масла, 25 мл 95% спирта, 0,1 г мыла и 0,1 камфоры. Капельки масла самопроизвольно быстро диспергируются и получается стойкая эмульсия.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 5. Обращение фаз эмульсии
Ход работы:
В пробирку наливают 2 мл 2% раствора олеиновокислого натрия и 2 мл керосина, бензола или толуола, плотно закрывают корковой пробкой и взбалтывают до получения однородной эмульсии.
Для определения типа эмульсии 1 мл полученной эмульсии переносят в другую пробирку, прибавляют (на кончике ножа) растертую в пыль краску судан III (растворимую в масле, но не растворимую в воде), встряхивают и через некоторое время каплю окрашенной эмульсии на предметном стекле рассматривают с помощью микроскопа: если окрашены капельки (дисперсная фаза), то эмульсия типа "масло в воде", если же наоборот, окрашена дисперсионная среда, а капельки бесцветны, то эмульсия типа "вода в масле".
К остатку эмульсии в первой пробирке приливают несколько капель 1% раствора СаСl2, взбалтывают и вновь определяют тип эмульсии как описано.
Если произошло неполное обращение фаз, то прибавляют еще несколько капель CaCl2.
Выполнение работы проверил(а)
______________________________
Дата__________
Лабораторная работа 8
Свойства РАСТВОРОВ ВМС
Опыт 1. Зависимость времени желатинирования от концентрации раствора
Ход работы:
В две пробирки налить примерно по 6 мл раствора желатина концентрации 3% и 6%. Нагреть пробирки в течении 5 минут на водяной бане с температурой 40ºС. В кристаллизатор поместить снег или лёд м залить их холодной водой. Опустить пробирки в кристаллизатор и определить время желатинирования по образованию невытекающего геля.
В выводе отметить, как зависит время желатинирования от концентрации раствора.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 2. Влияние кислот и щелочей на желатинирование
Ход работы:
В 3 пробирки налить по 5 мл тёплого 3% - ного раствора желатина. В одну пробирку прибавить 1 мл дистиллированной воды, в другую – 1 мл 0,1н раствора HCl и в третью – 1 мл 0,1н раствора NaOH. Перемешать, поставить на 10 минут в водяную баню с температурой 40ºС. Затем пробирки опустить в кристаллизатор, наполненный снегом и тёплой водой и определить время желатинирования по образованию невытекающего геля.
В выводе отметить, как влияет добавление кислот и щелочей на время желатинирования.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 3. Влияние солей на желатинирование
Ход работы:
В 8 пробирок налить по 2,5 мл 6% - ного раствора желатина. В первую пробирку добавить 2,5 дистиллированной воды, а в остальные семь по 2,5 мл предложенных растворов.
Определить время желатинирования полученных смесей, как и в предыдущем опыте.
В выводе сравнить полученные в опыте данные о влиянии солей на желатинирование с лиотропным рядом Гофмейстера.
| № Пробирки | Раствор | Концентрация | Высота осадка, мм | ||
| До набухания | После набухания | Δ h | |||
| 1 2 3 4 5 6 7 8 | H2O HCl NaOH NaCl Na2SO4 KSCN Сахар Мочевина | - 0,025н 0,025н 0,1н 0,1н 0,1н 10% 5% | |||
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Выделение тепла и набухание
Ход работы:
В стаканчик поместить примерно 5 г крахмала и добавить примерно 5 мл воды. Смесь перемешать, погрузить в неё термометр и отметить величину изменения температуры.
В выводе отметить, какие температурными изменениями сопровождается процесс набухания.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 5. Влияние кислоты, щёлочи, солей неэлектролитов на набухание желатина
Ход работы:
В 8 пробирок одинакового диаметра налить по 5 мл различных растворов согласно следующей таблице:
В каждую пробирку внести приблизительно по 0,3 г порошка желатина, осторожно встряхнуть пробирку и дать желатину опуститься на дно. Приложив полоску миллиметровой бумаги, определить высоту осадка желатина и внести эти данные в таблицу. Оставить пробирки на 1-2 часа, периодически несколько раз встряхивать осадок. Определить высоту набухшего осадка в результаты записать в таблицу.
В выводах записать влияние различных вещества набухание в соответствии с обращённым лиотропным рядом.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 6. Влияние рН на набухание
Ход работы:
В 5 пробирках приготовить по 10 мл буферных смесей, указанных в таблице, а в шестую пробирку налить 10 мл дистиллированной воды.
| №№ про-бирки | Состав буферной смеси, мл | рН смеси | Масса пластинки | Масса поглощён-ной воды | Степень набухания | ||
| До набухания | После набухания | ||||||
| 0,1н К-та | 0,1н Соль | m1 | m2 | ||||
| 1 2 3 4 5 6 | 9 7 5 3 1 | 1 3 5 7 9 | |||||
3.6
4.4
4.7
5.1
5.7
7
10 мл Н2О dest
Взвесить 6 пластинок желатина толщиной 1-2 мм, поместить их в пробирки и оставить в растворе для набухания на 1-2 часа. Затем пластинки осторожно вынуть, обсушить фильтровальной бумагой и взвесить. По равности массы пластинки до и после набухания найти массу поглощённой жидкости и вычислить степень набухания по формуле:
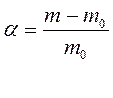
где m0 - масса сухой пластинки
m – масса пластинки после набухания
На основании полученных данных строят графическую зависимость в координатах α – рН (см. приложение 1)
В выводах отметить, как влияет рН на набухание, приняв во внимание, что изоэлектрическая точка желатина равна 4,7.


Опыт 7. Периодическое осаждение в гелях
Ход работы:
Приготовить раствор желатина растворением 1 г желатина в 30 мл 0,1%-ного раствора K2Cr2O7. Налить его в плоскодонную чашку или цилиндр до ¾ их высоты. Оставить для желатинирования при комнатной температуре (не выше 20ºС) на ночь.
На середину геля нанести 3-5 капель 8,5%-ного раствора AgNO3 и для предохранения от испарения закрыть чашку крышкой под которую положить кусок ваты, смоченной водой. Оставить в тёмном месте. В результате диффузии и химической реакции между K2Cr2O7 и AgNO3 через 1-3 дня на геле образуется ряд концентрических колец красно-бурого осадка Ag2Cr2O7 - кольца Лизенганга.
Аналогично можно получить слоистые осадки гидроксида магния белого цвета.

Опыт 8. Комплексная коацервация
Ход работы:
К 1 мл свежеприготовленного раствора гуммиарбика или картофельного крахмала при постоянном перемешивании прибавить до появления мути несколько миллиметров 5%-ного раствора желатина.
Каплю смеси рассмотреть под микроскопом и зарисовать. Через некоторое время смесь в пробирке разделяется на 2 слоя.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Выполнение работы проверил(а)
______________________________
Библиографический список
а) основной
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 300 с.
2. Ершов Ю.А. Коллоидной химии [Текст] / Ю.А. Ершов. - М., ГЭОТАР – Медиа, 2012. – 352 с.
б) дополнительный
1. Попков В.А Общая и биоорганическая химия [Текст] / Попков В.А Аверцева И.Н., Нестерова О.В. и др. – Academa., 2009 г.- 540 с.
2. Пузаков С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2009 г. – 320 с.
3. Мушкамбаров Н.Н. Физическая и коллоидная химия [Текст] / Н.Н. Мушкамбаров. - ГЭОТАР – МЕД, 2002. – 350 c.
ПРИЛОЖЕНИЕ 1
ВЫРАЖЕНИЕ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ В ВИДЕ ТАБЛИЦ И ГРАФИКОВ
Данные опытов и полученные из них расчетом значения тех или иных величин целесообразно представлять в виде таблиц и графиков. Графики служат для иллюстрации или проверки теоретических уравнений. Ими пользуются также для составления эмпирических уравнений в случаях заведомой невозможности применения аналитических. Таблицы обязательно должны иметь названия и подписи, содержащие краткое и точное их описание.
Составление таблиц
Все измерения содержат по меньшей мере две переменные, одну из которых выбирают в качестве независимой (в опытах ее задают как аргумент х), а другие (другая) являются зависимыми (функциями y, z и др.).
В таблице аргумент и функции должны стоять в одной строке, а каждое значение их в своем столбце. Столбец должен иметь заголовок, указывающий название и единицу измерения приведенной в нем величины. За независимые переменные принимают такие величины, как время, температура, давление, концентрация и т. п. При составлении таблицы значения аргумента и соответствующих функций располагают в порядке возрастания или убывания. При заполнении таблицы значения должны быть расположены так, чтобы запятые, отделяющие десятичные знаки, были расположены в каждом столбце на одной вертикали.
Каждое число в таблице должно содержать не больше и не меньше значащих цифр, чем позволяет точность опытных данных. Числа, полученные как среднее из нескольких опытных данных или расчетным путем, следует округлять так, чтобы последняя цифра в числе была первой сомнительной цифрой.
Округление чисел
При округлении чисел следует соблюдать следующие правила:
v если первая отбрасываемая цифра меньше пяти, то последнюю сохраняемую цифру оставляют неизменной (12,345 округляют до 12,3);
v если первая отбрасываемая цифра больше или равна пяти, а по следующие цифры больше нуля, то последнюю сохраняемую цифру увеличивают на единицу (12,367 округляют до 12,4; 12,352 — до 12,4);
v если отбрасываемая цифра равна пяти и за нею следуют только нули, то число округляют до ближайшего четного значения (12,350 округляют до 12,4; 12,450 - до 12,4); (во всех этих примерах предполагалось, что сомнительной является первая цифра за запятой);
v в целых числах цифры, следующие за первой сомнительной, заменяют нулями (например, скорость света в вакууме с=299792500 м/с).
Интерполяцией называют определение значения функции, находящейся между измеренными ее значениями; она может быть аналитической или графической.
Тогда, когда без большой погрешности можно считать, что функция у линейно изменяется между двумя соседними значениями х, для интерполяции используют метод пропорциональных частей. Функцию у, отвечающую данному значению аргумента х, лежащему между двумя табличными значениями x1, у1 и х2, у2 вычисляют по формуле:
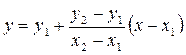
В общем случае следует составить эмпирическое уравнение у = f(x) по измеренным значениям у и по этому уравнению вычислить искомое значение у.
Часто достаточно надежен графический способ. По табличным данным вычерчивают на миллиметровой бумаге кривую у = f(x) в масштабе, позволяющем учесть последнюю значащую цифру измеренной величины. По кривой находят значение y, отвечающее любому значению х.
Экстраполяцией называют определение y, отвечающее некоторому х, лежащему вне пределов опытных данных; экстраполяция может быть аналитической и графической. Точность экстраполяции (особенно при значительном интервале ее) невелика, однако в некоторых случаях постулируют или теоретически обосновывают применение этого способа.
Построение графиков
Графическое изображение экспериментальных и расчетных данных облегчает сравнение величин, позволяет легко обнаружить характер изменения величин — наличие экстремальных точек или точек перегиба, периодичность, появление предельных значений и другие важные свойства. В таблицах эти особенности проявляются менее отчетливо. Наконец, с помощью графиков можно производить дифференцирование и интегрирование, даже не зная математической формы представленной графической зависимости.
При построении графиков соблюдают следующие правила.
Значение независимой переменной (аргумента) откладывают по оси абсцисс, функции — по оси ординат. Какую из двух переменных считать независимой, следует обычно из эксперимента. Если в ходе опыта значения одной переменной устанавливают произвольно, а соответствующие значения других переменных оказываются при этом уже вполне определенными, то первая переменная и считается независимой. Общего правила для выбора аргумента не существует.
Выбор масштаба
v Масштаб нужно выбирать так, чтобы координаты любой точки графика могли быть определены быстро и легко. Если на разграфленной в клетку бумаге (миллиметровой) расстояние между двумя главными соседними линиями разделено на десять равных частей, то наиболее удобно выбирать такой масштаб, в котором это расстояние принято за 1, 2 или 5 единиц или эти значения умножены на 10±n, где n — целое число. Масштаб, при котором чтение графика затруднено, не может считаться приемлемым. Не все линии координатной сетки должны быть надписаны; часто для чтения графика оказывается удобным надписывать линии через одну или несколько. Но какая бы система надписи обозначений не была принята, она должна быть соблюдена на всем графике. Целесообразно, чтобы числа, проставленные на оси, содержали столько значащих цифр, сколько допускает точность данных или сколько можно прочесть по кривой. Для удобства пользования графиком необходимо проставить на каждой координатной оси название представляемой ею величины и единиц, в которых она измеряется.
v Масштаб следует выбирать так, чтобы погрешность измерений соответствовала погрешности на графике не более, чем в одно – два наименьших деления масштаба. При выборе шкалы по оси координат нет необходимости обязательно начинать с нулевого значения, если это не вызвано специальными соображениями (необходимость экстраполяции и т. п.). В соответствии с этим правилом шкала для каждой переменной может начинаться с наименьшего округленного значения из совокупности данных или несколько ниже и кончаться наибольшим округленным значением или несколько выше.
v Если график предназначается для определения коэффициентов уравнения, выражающего зависимость y = f(x), или для экстраполяции полученной зависимости, следует выбирать такую функциональную зависимость, при которой уменьшается кривизна линий (обычно логарифмическую, показательную с дробным показателем степени и др.).
v Масштаб должен быть выбран так, чтобы кривая, насколько это возможно, была наклонена к оси абсцисс под углом, близким к 45°.
При необходимости подчеркнуть характерные особенности в изменении функции (наличие экстремальных точек, точек перегиба и т, п.) следует относительно увеличить масштаб функции и уменьшить масштаб аргумента.
Дата: 2018-12-21, просмотров: 1259.
