Кафедра химии

ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
РАБОЧАЯ ТЕТРАДЬ
ДЛЯ ЛАБОРАТОРНЫХ РАБОТ
для студентов, обучающихся по специальности «Фармация»
студента______________________________________________
группы № ____________________________________________

ТВЕРЬ
201 8
УДК 541.1 /.18
ББК 24
Авторы-составители: Бордина Г.Е., Лопина Н.П., Халяпина Я.М.
Под общей редакцией профессора, док.биол.наук. Зубаревой Г.М.
Рецензенты:
Харитонова Е.А. – канд. биол. наук, доцент кафедры биологии ФГБОУ ВО Тверская ГМА
Игнатова Ю.П. – канд. мед. наук, доцент кафедры физиологии ФГБОУ ВО Тверская ГМА
Учебно-методическое пособие одобрено на заседании ЦКМС ТГМА
Физическая и коллоидная химия [Текст]: Рабочая тетрадь для лабораторных работ для студентов фармацевтического факультета / Бордина Г.Е., Лопина Н.П. Халяпина Я.М. // Под общей редакцией: Зубаревой Г.М. – Тверь: Ред.-издат. центр Твер. гос. мед. универ., 2017. – 48 с.
Авторы-составители – сотрудники кафедры химии Тверского государственного медицинского университета:
Галина Евгеньевна Бордина – канд. биол. наук, доцент кафедры химии
Надежда Петровна Лопина – канд. хим. наук, доцент кафедры химии
Янина Михайловна Халяпина – старший преподаватель кафедры химии
Физическая и коллоидная химия. Рабочая тетрадь для лабораторных работ составлено коллективом кафедры химии и биохимии Тверской государственной медицинской академии и предназначено в помощь студентам фармацевтического факультета для подготовки к лабораторно-практическим занятиям.
УДК 541.1/.18
ББК 24
© Бордина Г.Е., Лопина Н.П., Халяпина Я.М., 2012
© Оформление, оригинал-макет. Редакционно-издательский центр Тверской государственной медицинский академии, 2012
ОГЛАВЛЕНИЕ
Предисловие………………………………………………………………….4
Правила техники безопасности……………………………………………5
Химическая посуда и лабораторное оборудование……………………...6 – 10
Лабораторная работа 1. Определение теплоты нейтрализации………11 – 13
Лабораторная работа 2. Свойства буферных растворов……………….14 - 17
Лабораторная работа 3. Кинетика химических реакций. Качественные опыты по химическому равновесию………………………………………18 - 20
Лабораторная работа 4. Качественные и количественные опыты по адсорбции…………………………………………………………………….. 21 - 25
Лабораторная работа 5. Способы получения и методы очистки коллоидных растворов………………………………………………………26 - 29
Лабораторная работа 6. Коагуляция золей. Определение порога коагуляции. Коллоидная защита………………………………………......30 - 34
Лабораторная работа 7. Получение эмульсий. Обращение фаз эмульсий……………………………………………………………………….35 - 36
Лабораторная работа 8. Свойства растворов ВМС……………………...37 - 41
Библиографический список…………………………………………………42
Приложение 1…………………………………………………………………43 - 45
Приложение 2…………………………………………………………………46 - 47
"Опыт – единственно верный путь
спрашивать природу и слышать ответ в ее лаборатории"
Д.И. Менделеев
ПРЕДИСЛОВИЕ
В настоящее время лабораторному практикуму, как специфической и важнейшей форме учебной работы, уделяется особое внимание, так как усвоение изучаемого материала может происходить только в ходе активной деятельности самого учащегося. Эта деятельность реализуется на лабораторно-практических занятиях.
Эксперимент предполагает выработать у студентов определенные навыки научной организации исследований. В этом смысле лабораторный практикум является формой учебной работы, которая позволяет реализовать задачи обучения.
В преподавании химии в медицинских вузах произошли значительные изменения: разработаны новые программы, усилена целевая направленность. Вместе с тем произошло сокращение учебных часов с 76 до 57 по дисциплине «Физическая и коллоидная химия». Изменились требования к лабораторному практикуму по химии. Поэтому в целях экономии времени практических занятий, мы предлагаем оформлять лабораторные работы в «Рабочей тетради».
В рабочей тетради описаны лабораторные работы, помогающие освоению теоретических основ физической и коллоидной химии. После каждого опыта выделено свободное место для самостоятельного выполнения необходимых расчетов и формирования студентами выводов. Если необходимо построение графических зависимостей, то в конце работы имеется копия миллиметровой бумаги для графиков.
Авторы-составители
ХИМИЧЕСКАЯ ПОСУДА И
ЛАБОРАТОРНОЕ ОБОРУДОВАНИЕ
В лабораторных условиях чаще всего используется стеклянная посуда. Она устойчива к воздействию большинства химических реагентов, легко моется и, что также немаловажно, прозрачная. Стеклянной посудой нельзя пользоваться при работе с фтороводородом и с расплавленной щелочью, в ней нельзя нагревать концентрированные растворы щелочей.
Стаканы изготавливают или из обычного химически стойкого, или из тугоплавкого стекла (термоустойчивые). Нагревать стаканы из обычного стекла на открытом пламени нельзя. Нагревание можно вести только на асбестовой сетке или на водяной бане. Вместимость химических стаканов колеблется от 50 до 2000 мл. Их используют для вспомогательных работ с органическими жидкостями и водными растворами различных соединений.
Пробирки бывают различной величины и диаметра. Обычные лабораторные пробирки изготавливают из легкоплавкого стекла, но для особых работ, например, при высоких температурах применяют пробирки из тугоплавкого стекла или кварца.
В химической лаборатории пробирки используют для проведения реакций с различными веществами. При перемешивании реактивов пробирку держат за верхнюю часть большим, указательным и средним пальцами левой руки, а указательным пальцем правой руки ударяют косым скользящим движением по ее нижней части несколько раз. Нельзя встряхивать пробирку, закрывая ее пальцем, так как при этом загрязняются перемешиваемые вещества, а при проведении опытов с едкими веществами может быть травмирована кожа руки. Если пробирку необходимо нагреть, то ее закрепляют в держателе или в лапке штатива.
При нагревании пробирки с реакционной смесью на открытом пламени необходимо помнить следующее:
1) открытый конец пробирки должен быть повернут в сторону от работающих людей;
2) перед локальным нагреванием пробирки ее необходимо равномерно прогреть по всей длине;
3) для предотвращения вскипания и выплескивания реакционной смеси пробирку следует осторожно нагревать в верхней части пламени до появления первых признаков закипания, затем следует убрать ее из пламени, продолжая нагревать горячим воздухом; по мере необходимости пробирку можно вносить на короткое время в пламя горелки.
Колбы бывают плоскодонные, конические, круглодонные и грушевидные (рис. 1).
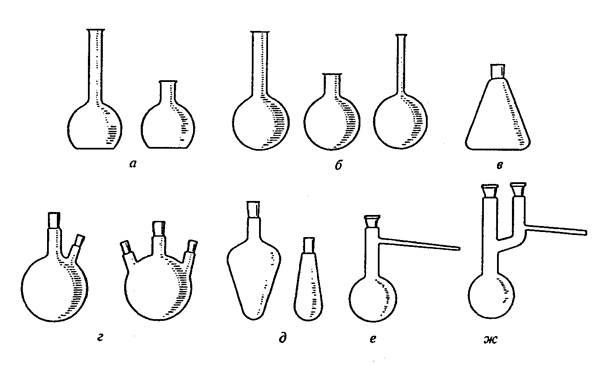
Рис. 1. Колбы:
а – плоскодонные; б – круглодонные; в – коническая; г – двух- и трехгорлые;
д – грушевидные; е – колба Вюрца; ж – колба Кляйзена
Плоскодонные и конические колбы обычно используют в качестве приемников при перегонке жидкостей, для приготовления растворов и кристаллизации. Их нельзя применять при нагревании веществ до высоких температур и использовать при работе при пониженном давлением (из-за опасности разрушения колб). Круглодонные колбы используют для перегонки веществ, в том числе и под вакуумом. Длина и диаметр горла круглодонных колб могут варьировать. Эти колбы бывают двух-, трехгорлыми и т.д. Круглодонные колбы с отводной трубкой называют колбами Вюрца. Они предназначены для перегонки веществ при атмосферном давлении. В отличие от колбы Вюрца колба Кляйзена имеет на горле две шейки, от одной из которых отходит отводная трубка. Колбы Кляйзена применяют для перегонки жидкостей при пониженном давлении.
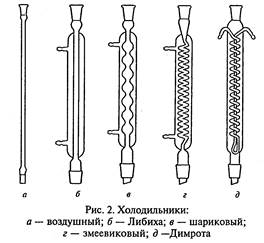
Холодильники (рис. 2) служат для охлаждения и конденсации паров, образующихся при кипении органических жидкостей. Чтобы избежать потерь низкокипящих компонентов, колбы снабжают обратными холодильниками, где пары охлаждаются и конденсат возвращается в реакционную смесь.
При перегонке вещество конденсируется в холодильнике и отводится в приемную колбу. Такие холодильники называются нисходящими (они крепятся под углом к столу в сторону приемника).
Простейшим является воздушный холодильник, который представляет собой длинную стеклянную трубку. Он годится только для работы с высококипящими жидкостями, поскольку эффективность воздуха как охлаждающего средства невелика. Воздушный холодильник можно использовать и как нисходящий, но при не слишком большой скорости перегонки, для жидкостей с температурой кипения больше 1500С.
В холодильнике Либиха для охлаждения и конденсации пара используется проточная вода. Его применяют в качестве нисходящего для перегонки жидкостей с температурой кипения менее 1600С. В качестве обратного этот холодильник малоэффективен, так как имеет небольшую охлаждающую поверхность.
Шариковый холодильник используют только как обратный, поскольку его охлаждающая поверхность значительно больше, чем у холодильника Либиха.
Змеевиковый холодильник никогда не следует использовать как обратный, потому что конденсат, который недостаточно хорошо стекает по изгибам змеевика, может быть выброшен из холодильника и послужить причиной несчастного случая. Змеевиковый холодильник, установленный вертикально, является наиболее эффективным нисходящим холодильником, особенно для низкокипящих веществ. Его нельзя устанавливать наклонно, так как конденсат может скапливаться внутри холодильника и не доходить до приемника.
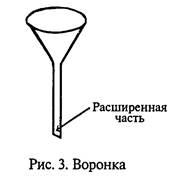
Воронки. Воронки для фильтрования выпускают различных размеров – диаметром от 35 до 300 мм. обычно воронки имеют ровную внутреннюю стенку, но для ускоренного фильтрования иногда применяют воронки с ребристой внутренней поверхностью.
Кроме того, некоторые воронки имеют удлиненный конец, внутренний диаметр которого в верхней части меньше, чем в нижней (рис. 3); такая конструкция также ускоряет фильтрование.
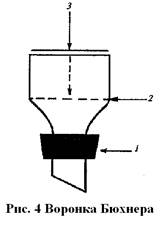
Воронки Бюхнера отличаются от обычных воронок тем, что они сделаны из фарфора и имеют перегородку с отверстиями, на которую помещают фильтр (рис. 4). Воронку вставляют в колбу Бунзена, из которой затем откачивают воздух.
Делительные воронки применяют для разделения несмешивающихся жидкостей и для экстракции. Они бывают цилиндрической, шаровидной или 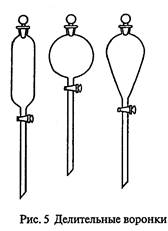 грушевидной формы, с пробиркой в верхней части отводной трубки (рис. 5).
грушевидной формы, с пробиркой в верхней части отводной трубки (рис. 5).
Капельные воронки предназначены для медленного прибавления жидкости в реакционную смесь во время проведения синтеза веществ.
Они похожи на делительные, но у них более тонкие стенки и более длинные отводные трубки. Капельные воронки составляют часть прибора и крепятся к горлу колбы на шлифе или при помощи резиновой пробки. Перед работой с капельной или делительной воронкой шлиф стеклянного крана нужно смазать вазелином или специальной смазкой.
Мерная посуда служит для для измерения объема жидкости. Мерные цилиндры и мензурки (рис. 6 в,г) служат для измерения больших объемов – от 5 до 2000 мл. Бюретки – приборы для измерения точных объемов жидкости, применяемые преимущественно при титровании (рис.6 д). Пипетками (рис.6 е) отмеряют наиболее точные объемы – от 0,005 мл (для микропипеток) до 10–25 мл (для градуированных пипеток и пипеток Мора). Мерные колбы (рис. 6 ж) предназначены для приготовления растворов точных концентраций. Они имеют длинную шейку, на которой нанесена кольцевая черта, шлиф и притертую пробку. При приготовлении раствора уровень жидкости доводят до кольцевой черты.
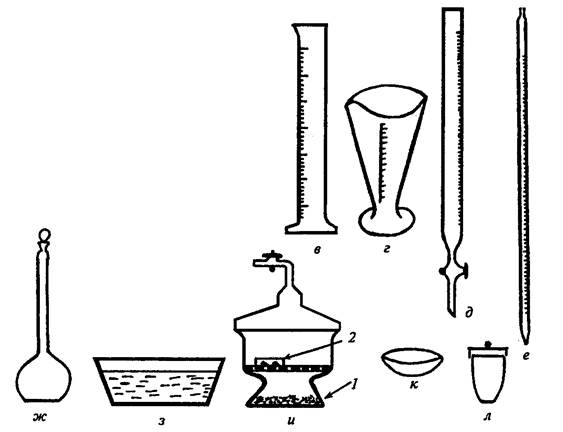
Кристаллизаторы – это низкобортные сосуды, предназначенные для охлаждения веществ при их получении или кристаллизации (рис. 6 з). Иногда в кристаллизаторах можно проводить выпаривание, но следует помнить, что нагревать их можно только на водяной бане.
Эксикаторы – это емкости из толстостенного стекла (рис.6 и), состоящие из массивного корпуса и притертой к нему стеклянной крышки. Они предназначены для упаривание растворов и высушивания твердых веществ. Различают простые и вакуум-эксикаторы. Из последних через трубку с краном при помощи водоструйного насоса откачивают воздух. Вещество помещают в эксикатор в чашке Петри. В качестве осушителя применяют прокаленный хлорид кальция, оксид фосфора (V), силикагель, натронную известь, гидроксид натрия, сульфат магния или натрия.
Фарфоровая посуда позволяет вести прямой обогрев веществ до температуры 12000С. Недостатком этой посуды является ее большая масса и непрозрачность. Чашки для выпаривания (рис.6 к) применяют для нагревания и выпаривания различных растворов. Этот процесс можно вести на открытом пламени, но равномерное выпаривание растворов обычно происходит на асбестовой сетке или водяной бане. Тигли (рис.6 л) применяют для прокаливания различных веществ и для сжигания органических соединений. Из фарфоровой посуды в химической лаборатории часто применяют стаканы, ложки, шпатели и ступки.
Нагревательные бани. Прямое нагревание на пламени газовой горелки или электрической плитке может приводить к местным перегревам. Этого можно избежать при использовании нагревательных бань. В качестве теплопроводящей среды в банях применяют воду, воздух, песок и масло.
Простейшую воздушную баню можно получить, если между пламенем и нагреваемой колбой поместить асбестовую сетку. Песчаные бани обладают очень большой тепловой инерцией, что затрудняет регуляцию температуры. Наиболее удобны масляные и водяные бани, так как они обеспечивают равномерное нагревание колбы и благодаря незначительной тепловой инерции позволяют точно регулировать температуру реакционной смеси. Выбор бани определяется свойствами нагреваемого вещества или смеси, а также температурой, необходимой для их нагревания. Водяные бани применяют при нагревании веществ до 1000С, масляные – до 1500С, электрические воздушные – до 2500С, песчаные – свыше 4000С. необходимо помнить, что водяные бани нельзя использовать при работе с металлическими натрием и калием.
Дата__________
Лабораторная работа 1
Лабораторная работа 2
СВОЙСТВА БУФЕРНЫХ РАСТВОРОВ
Опыт 1. Приготовление буферных раствора, с различным значением pH . Зависимость рН буферных растворов от соотношений концентраций и разведения их компонентов
Ход работы:
В трех одинаковых пробирках готовят буферные растворы с различным соотношением компонентов. Для этого набирают с помощью градуированных пипеток 0,1 н раствор CH3COOH и 0,1 н раствор CH3COONa в количествах, указанных ниже.
|
№ пробирки | Состав буферной смеси в мл | |
| 0,1 н CH 3 COOH | 0,1 н CH 3 COONa | |
| 1 2 3 | 9 5 1 | 1 5 9 |
Содержимое пробирок перемешивают путем встряхивания.
Затем готовят серию буферных растворов с тем же соотношением концентраций соли и кислоты, но с меньшей суммарной концентрацией компонентов. Для этого пипеткой отбирают по 1,0 мл приготовленных ранее растворов и к каждому добавляют по 8,0 мл дистиллированной воды, после чего содержимое пробирок перемешивают.
Т.о., в пробирках 1 и 4, 2 и 5, 3 и 6 находятся растворы с одинаковыми соотношениями концентраций соли и кислоты, но растворы в пробирках 4, 5, 6 являются разбавленными по сравнению с растворами в пробирках 1, 2, 3.
Во все шесть пробирок добавляем по 3 – 4 капли индикатора метилового красного, после чего содержимое пробирок перемешивают. На белом фоне сравнивают окраску растворов между собой: 1 и 4; 2 и 5; 3 и 6.
Рассчитайте рН приготовленных буферных растворов (см. приложение 2).
Формула : ____________________________________________________________
pH1= ____________________________________________________________________________________________________________________________________
pH2= ____________________________________________________________________________________________________________________________________
pH3= ____________________________________________________________________________________________________________________________________
Константа диссоциации уксусной кислоты КД = 1,8•10-5
Результаты наблюдений и расчетов записывают по форме (см. приложение 1).
| Пробирки с исходным буферным раствором | 1 | 2 | 3 |
| c ( CH3COONa) : c(CH3COOH) | |||
| Цвет буферного раствора после добавления индикатора | |||
| рН исходного буферного раствора | |||
| Пробирки с разбавленным буферным раствором | 4 | 5 | 6 |
| c ( CH3COONa) : c(CH3COOH) | |||
| Цвет разбавленного буферного раствора после добавления индикатора | |||
| рН разбавленного буферного раствора |
Сделайте вывод о зависимости рН буферных растворов от соотношения концентраций компонентов и разведения.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 2. Выяснение влияния добавления небольших количеств сильных кислот и оснований на рН буферного раствора
Ход работы:
В трех пробирках приготовить по 10 мл буферного раствора ( 5 мл CH3COOH + 5 мл CH3COONa). Содержимое пробирок перемешать путем встряхивания. Прибавить в одну пробирку 5 капель 0,1 н HCl, в другую 5 капель 0,1 н NaOH, а в третью – 5 капель дистиллированной воды. Пробирки встряхнуть. В каждую пробирку добавить по 4 капли индикатора метилового красного.
Результаты наблюдений записать по форме:
| № | Объект изучения | Окраска раствора после добавления индикатора |
| 1 | Буферный раствор + 5 капель HCl | |
| 2 | Буферный раствор + 5 капель NaOH | |
| 3 | Буферный раствор + 5 капель H2O |
Сделайте выводы на основании наблюдений. Обосновать выводы, написав уравнения реакций, показывающих механизм действия ацетатной буферной системы (молекулярном и ионном виде).
________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Определение буферной емкости растворов
Ход работы:
В колбу налить 10 мл буферного раствора с рН = 5 (4 мл 0,1 н CH3COOH + 6 мл 0,1 н CH3COONa) и прибавить 3 капли индикатора метилового красного. Раствор титровать 0,1 н раствором NaOH до появления окраски (рН = 6,3).
Рассчитать буферную емкость по формуле:
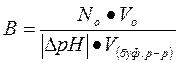 [моль/л]
[моль/л]
Где No – нормальная концентрация раствора NaOH
Vo – объем раствора NaOH, пошедший на титрование, мл.
∆рН – изменение рН испытуемого буферного раствора в процессе титрования
V(буф. р-р) – объем испытуемого буферного раствора, мл.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Влияние разбавления на буферную емкость
Ход работы:
К 10 мл буферного раствора с рН = 5 (4 мл 0,1 н CH3COOH + 6 мл 0,1 н CH3COONa) добавить 10 мл дистиллированной воды, 3 капли индикатора метилового красного и титровать 0,1 н раствором щелочи. Определить буферную емкость как и в предыдущем опыте. V(буф. р-р) = 20 мл (10 + 10)
________________________________________________________________________________________________________________________________________
Сделать вывод о влиянии разбавления на буферную емкость.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 5. Определение общей, активной и потенциальной кислотности
Ход работы:
К 10 мл буферного раствора с рН = 5 (4 мл 0,1 н CH3COOH + 6 мл 0,1 н CH3COONa) прибавить 3 капли индикатора фенолфталеина и титровать 0,1 н раствором гидроксида натрия NaOH до появления бледно-розового окрашивания. Вычислить общую кислотность, а по разности между общей и активной кислотностями – потенциальную кислотность.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выполнение работы проверил(а)
______________________________
Дата__________
Лабораторная работа 3
Лабораторная работа 4
По адсорбции
Опыт 1. Адсорбция электролитов, красителей и золей углем
Ход работы:
В пробирки налейте примерно по 5 мл сильно разбавленных слабо окрашенных растворов CuSO4, K2Cr2O7, водный раствор фуксина, флюоресцеина, эозина, золей гидроксида железа(Ш) и берлинской лазури. Затем внесите немного (около 0,2г) растертого в порошок активированного угля, встряхивайте смесь в течение 5 мин и оставьте в штативе. Через 15-20 минут отфильтруйте через бумажные фильтры. Как изменился цвет растворов?
| Раствор | Исходный цвет раствора | Цвет после фильтрации |
| CuSO4 | ||
| K2Cr2O7 | ||
| фуксин | ||
| флюоресцеин | ||
| эозин | ||
| золь гидроксида железа(III) | ||
| золь берлинской лазури |
В выводе охарактеризуйте адсорбционные свойства активированного угля.
Вывод:_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 2. Адсорбция ионов свинца углем
Ход работы:
В пробирку налейте примерно 5мл раствора нитрата свинца (II) Pb(NO3)2. Добавьте около 0,2 г растертого в порошок активированного угля, встряхивайте смесь в течение 5 минут и отфильтруйте через бумажный фильтр. К фильтрату добавьте немного раствора дихромата калия K2Cr2O7. В отдельную пробирку налейте примерно 5 мл раствора нитрата свинца (II) и сразу добавьте немного раствора дихромата калия. В каком случае наблюдается выпадение осадка?
 Pb(NO3)2 + К2С r 2O7 РbС r 2O7 + 2 КNO3
Pb(NO3)2 + К2С r 2O7 РbС r 2O7 + 2 КNO3
В выводе объясните наблюдаемые явления, укажите цвет осадка.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________
Опыт 3. Влияние растворителя на адсорбцию
Ход работы:
В одну пробирку налейте примерно 5 мл слабо окрашенного водного раствора фуксина, в другую – 5 мл так же слабо окрашенного спиртового раствора фуксина, внесите в обе пробирки примерно по 0,1 г порошка активированного угля. Смесь встряхивайте в течение 5 минут и оставьте в штативе. Через 15 - 20 минут отфильтруйте через бумажные фильтры. Как изменилась окраска раствора в пробирках? В каком случае обесцвечивание раствора произошло бы в большей степени?
В выводе объясните наблюдаемые явления в соответствии с правилом Ребиндера.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Адсорбция уксусной кислоты углем
Ход работы:
В четыре чистые сухие склянки вносят точно по 1 г измельченного активированного угля и отмеривают пипеткой по 25 мл растворов уксусной кислоты, указанной в таблице нормальности. Склянки закрывают пробкой встряхивают и оставляют на 15-25 минут, время от времени встряхивая, после чего смесь фильтруют через сухие фильтры в отдельные колбочки, отбрасывая первые порции фильтрата.
Начальную концентрацию растворов уксусной кислоты и равновесную концентрацию ее в фильтратах определяют титрованием 10 мл растворов кислоты 0,1н раствором NaOH с индикатором фенолфталеином. Концентрацию выражают в миллилитрах 0,1н NaOH на 100 мл раствора.
Форма записи
| № склянки | Нормальность кислоты | Количество миллиметров 0,1н Na0Н на 100 мл раствора | x | lg x | lg C | ||
| С0 | С | С0 - С | |||||
| 1. 2. 3. 4. | 0,025 0,05 0,1 0,2 | ||||||
По формуле 1 определяют количество адсорбированной уксусной кислоты x.
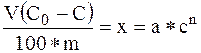 (1)
(1)
где: x – количество миллимолей вещества, адсорбированного одним граммом адсорбента из 100 мл раствора;
m – количество граммов адсорбента;
С0 и С – начальная и равновесная миллимолярная концентрации;
V – количество миллилитров раствора, взятое для адсорбции;
n – постоянная с числовым значением от 0,2 до 0,6 в зависимости от температуры, природы адсорбента и адсорбируемого вещества;
a - постоянная, зависящая от тех же факторов, и равная х при равновесной концентрации, равной единице.
Все полученные цифры записывают в таблицу.
На миллиметровой бумаге строят "кривую адсорбции", отложив на оси абсцисс значения равновесной концентрации С, а по оси ординат – значения разности (рис. 1). Логарифмируя уравнение 1 получим:
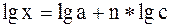
Это – уравнение прямой линии АС (рис.2) пересекающей ось ординат на расстоянии, равном отрезку ОА от начала координат и наклоненной к оси абсцисс под углом, тангенс которого равен n.
Для определения числовых значений постоянных а и n находят логарифмы чисел C и х и строят графики, отложив по оси абсцисс lg C, а по оси ординат lg x. Наносят точки и проводят линию так, чтобы расстояния от всех этих точек до прямой были наименьшими. Отрезок АО равен lg a. По логарифму находят число а. Значение n равно или отношению длин отрезков СВ и АВ, т.е (см. приложение 2).
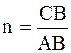
|
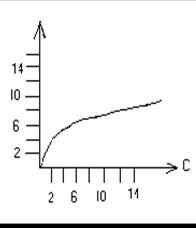
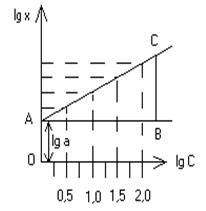
Рис. 1 Изотерма адсорбции Рис. 2 Логарифмическая
прямая адсорбции
Принятое в данной работе выражение начальной и равновесной концентрации (а, следовательно, и количество адсорбированной уксусной кислоты) в миллилитрах 0,1н NaOH на 100 мл раствора соответствует миллимолярным концентрациям. Количество граммов адсорбента (угля) также пересчитывается на 100 мл раствора.
В отличие от постоянной а, значение постоянной n не зависит от избранных единиц концентрации. Определив n графическим методом, как указано выше, и взяв среднеарифметические значения lg x и lg C из всех четырех опытов lg а можно вычислить по уравнению:
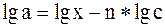
По логарифму находят число а. Более точные значения постоянных а и n получаются в опытах адсорбции с 6-8 различными начальными концентрациями растворов при постоянной температуре, одинаковой продолжительности адсорбции и одинаковом измельчении адсорбента.




Выполнение работы проверил(а)
______________________________
Дата___________
Лабораторная работа 5
Лабораторная работа 6
Лабораторная работа 7
Получение эмульсий. Обращение фаз эмульсии
Опыт 1. Получение разбавленной эмульсии
Ход работы:
В пробирку наливают 6 мл воды и 2 мл 1%-ного спиртового раствора касторового масла, встряхивают и наблюдают образование эмульсии. Объяснить, почему получается эмульсия без применения эмульгатора.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 2. Получение концентрированной эмульсии
Ход работы:
В две пробирки наливают по 8 мл дистиллированной воды. В одну из них наливают 0,5 мл бензола и 1 мл 2 % раствора мыла. Пробирки закрывают пробками и тщательно взбалтывают. В одной из них наблюдают образование устойчивой эмульсии. Объяснить механизм стабилизирующего действия мыла.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 3. П олучение эмульсии масла
Ход работы:
В пробирку наливают 5 мл дистиллированной воды, вносят 5 - 6 капель растительного масла и, закрыв пробирку, сильно встряхивают. Получившаяся эмульсия довольно быстро разрушается, расслаивается вследствие слияния капелек друг с другом (коалесценция). Для стабилизации эмульсии прибавляют несколько капель 1% раствора одного из названных выше гидрофильных веществ – стабилизаторов, например, натриевого (обыкновенного) мыла, или Na2СO3 или NaOH (которые со свободными жирными кислотами масла дают натриевое мыло) и вновь сильно встряхивают. Получается стойкая, тонкая эмульсия молочно-белого цвета.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Получение эмульсии масла без применения механического воздействия
Ход работы:
Через капилляр вливают в воду раствор, состоящий из 3 мл касторового (льняного или минерального) масла, 25 мл 95% спирта, 0,1 г мыла и 0,1 камфоры. Капельки масла самопроизвольно быстро диспергируются и получается стойкая эмульсия.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 5. Обращение фаз эмульсии
Ход работы:
В пробирку наливают 2 мл 2% раствора олеиновокислого натрия и 2 мл керосина, бензола или толуола, плотно закрывают корковой пробкой и взбалтывают до получения однородной эмульсии.
Для определения типа эмульсии 1 мл полученной эмульсии переносят в другую пробирку, прибавляют (на кончике ножа) растертую в пыль краску судан III (растворимую в масле, но не растворимую в воде), встряхивают и через некоторое время каплю окрашенной эмульсии на предметном стекле рассматривают с помощью микроскопа: если окрашены капельки (дисперсная фаза), то эмульсия типа "масло в воде", если же наоборот, окрашена дисперсионная среда, а капельки бесцветны, то эмульсия типа "вода в масле".
К остатку эмульсии в первой пробирке приливают несколько капель 1% раствора СаСl2, взбалтывают и вновь определяют тип эмульсии как описано.
Если произошло неполное обращение фаз, то прибавляют еще несколько капель CaCl2.
Выполнение работы проверил(а)
______________________________
Дата__________
Лабораторная работа 8
Свойства РАСТВОРОВ ВМС
Опыт 1. Зависимость времени желатинирования от концентрации раствора
Ход работы:
В две пробирки налить примерно по 6 мл раствора желатина концентрации 3% и 6%. Нагреть пробирки в течении 5 минут на водяной бане с температурой 40ºС. В кристаллизатор поместить снег или лёд м залить их холодной водой. Опустить пробирки в кристаллизатор и определить время желатинирования по образованию невытекающего геля.
В выводе отметить, как зависит время желатинирования от концентрации раствора.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 2. Влияние кислот и щелочей на желатинирование
Ход работы:
В 3 пробирки налить по 5 мл тёплого 3% - ного раствора желатина. В одну пробирку прибавить 1 мл дистиллированной воды, в другую – 1 мл 0,1н раствора HCl и в третью – 1 мл 0,1н раствора NaOH. Перемешать, поставить на 10 минут в водяную баню с температурой 40ºС. Затем пробирки опустить в кристаллизатор, наполненный снегом и тёплой водой и определить время желатинирования по образованию невытекающего геля.
В выводе отметить, как влияет добавление кислот и щелочей на время желатинирования.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 3. Влияние солей на желатинирование
Ход работы:
В 8 пробирок налить по 2,5 мл 6% - ного раствора желатина. В первую пробирку добавить 2,5 дистиллированной воды, а в остальные семь по 2,5 мл предложенных растворов.
Определить время желатинирования полученных смесей, как и в предыдущем опыте.
В выводе сравнить полученные в опыте данные о влиянии солей на желатинирование с лиотропным рядом Гофмейстера.
| № Пробирки | Раствор | Концентрация | Высота осадка, мм | ||
| До набухания | После набухания | Δ h | |||
| 1 2 3 4 5 6 7 8 | H2O HCl NaOH NaCl Na2SO4 KSCN Сахар Мочевина | - 0,025н 0,025н 0,1н 0,1н 0,1н 10% 5% | |||
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Выделение тепла и набухание
Ход работы:
В стаканчик поместить примерно 5 г крахмала и добавить примерно 5 мл воды. Смесь перемешать, погрузить в неё термометр и отметить величину изменения температуры.
В выводе отметить, какие температурными изменениями сопровождается процесс набухания.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 5. Влияние кислоты, щёлочи, солей неэлектролитов на набухание желатина
Ход работы:
В 8 пробирок одинакового диаметра налить по 5 мл различных растворов согласно следующей таблице:
В каждую пробирку внести приблизительно по 0,3 г порошка желатина, осторожно встряхнуть пробирку и дать желатину опуститься на дно. Приложив полоску миллиметровой бумаги, определить высоту осадка желатина и внести эти данные в таблицу. Оставить пробирки на 1-2 часа, периодически несколько раз встряхивать осадок. Определить высоту набухшего осадка в результаты записать в таблицу.
В выводах записать влияние различных вещества набухание в соответствии с обращённым лиотропным рядом.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Опыт 6. Влияние рН на набухание
Ход работы:
В 5 пробирках приготовить по 10 мл буферных смесей, указанных в таблице, а в шестую пробирку налить 10 мл дистиллированной воды.
| №№ про-бирки | Состав буферной смеси, мл | рН смеси | Масса пластинки | Масса поглощён-ной воды | Степень набухания | ||
| До набухания | После набухания | ||||||
| 0,1н К-та | 0,1н Соль | m1 | m2 | ||||
| 1 2 3 4 5 6 | 9 7 5 3 1 | 1 3 5 7 9 | |||||
3.6
4.4
4.7
5.1
5.7
7
10 мл Н2О dest
Взвесить 6 пластинок желатина толщиной 1-2 мм, поместить их в пробирки и оставить в растворе для набухания на 1-2 часа. Затем пластинки осторожно вынуть, обсушить фильтровальной бумагой и взвесить. По равности массы пластинки до и после набухания найти массу поглощённой жидкости и вычислить степень набухания по формуле:
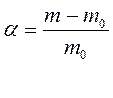
где m0 - масса сухой пластинки
m – масса пластинки после набухания
На основании полученных данных строят графическую зависимость в координатах α – рН (см. приложение 1)
В выводах отметить, как влияет рН на набухание, приняв во внимание, что изоэлектрическая точка желатина равна 4,7.


Опыт 7. Периодическое осаждение в гелях
Ход работы:
Приготовить раствор желатина растворением 1 г желатина в 30 мл 0,1%-ного раствора K2Cr2O7. Налить его в плоскодонную чашку или цилиндр до ¾ их высоты. Оставить для желатинирования при комнатной температуре (не выше 20ºС) на ночь.
На середину геля нанести 3-5 капель 8,5%-ного раствора AgNO3 и для предохранения от испарения закрыть чашку крышкой под которую положить кусок ваты, смоченной водой. Оставить в тёмном месте. В результате диффузии и химической реакции между K2Cr2O7 и AgNO3 через 1-3 дня на геле образуется ряд концентрических колец красно-бурого осадка Ag2Cr2O7 - кольца Лизенганга.
Аналогично можно получить слоистые осадки гидроксида магния белого цвета.

Опыт 8. Комплексная коацервация
Ход работы:
К 1 мл свежеприготовленного раствора гуммиарбика или картофельного крахмала при постоянном перемешивании прибавить до появления мути несколько миллиметров 5%-ного раствора желатина.
Каплю смеси рассмотреть под микроскопом и зарисовать. Через некоторое время смесь в пробирке разделяется на 2 слоя.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
____________________________________________________________________
Выполнение работы проверил(а)
______________________________
Библиографический список
а) основной
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 300 с.
2. Ершов Ю.А. Коллоидной химии [Текст] / Ю.А. Ершов. - М., ГЭОТАР – Медиа, 2012. – 352 с.
б) дополнительный
1. Попков В.А Общая и биоорганическая химия [Текст] / Попков В.А Аверцева И.Н., Нестерова О.В. и др. – Academa., 2009 г.- 540 с.
2. Пузаков С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2009 г. – 320 с.
3. Мушкамбаров Н.Н. Физическая и коллоидная химия [Текст] / Н.Н. Мушкамбаров. - ГЭОТАР – МЕД, 2002. – 350 c.
ПРИЛОЖЕНИЕ 1
ВЫРАЖЕНИЕ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ В ВИДЕ ТАБЛИЦ И ГРАФИКОВ
Данные опытов и полученные из них расчетом значения тех или иных величин целесообразно представлять в виде таблиц и графиков. Графики служат для иллюстрации или проверки теоретических уравнений. Ими пользуются также для составления эмпирических уравнений в случаях заведомой невозможности применения аналитических. Таблицы обязательно должны иметь названия и подписи, содержащие краткое и точное их описание.
Составление таблиц
Все измерения содержат по меньшей мере две переменные, одну из которых выбирают в качестве независимой (в опытах ее задают как аргумент х), а другие (другая) являются зависимыми (функциями y, z и др.).
В таблице аргумент и функции должны стоять в одной строке, а каждое значение их в своем столбце. Столбец должен иметь заголовок, указывающий название и единицу измерения приведенной в нем величины. За независимые переменные принимают такие величины, как время, температура, давление, концентрация и т. п. При составлении таблицы значения аргумента и соответствующих функций располагают в порядке возрастания или убывания. При заполнении таблицы значения должны быть расположены так, чтобы запятые, отделяющие десятичные знаки, были расположены в каждом столбце на одной вертикали.
Каждое число в таблице должно содержать не больше и не меньше значащих цифр, чем позволяет точность опытных данных. Числа, полученные как среднее из нескольких опытных данных или расчетным путем, следует округлять так, чтобы последняя цифра в числе была первой сомнительной цифрой.
Округление чисел
При округлении чисел следует соблюдать следующие правила:
v если первая отбрасываемая цифра меньше пяти, то последнюю сохраняемую цифру оставляют неизменной (12,345 округляют до 12,3);
v если первая отбрасываемая цифра больше или равна пяти, а по следующие цифры больше нуля, то последнюю сохраняемую цифру увеличивают на единицу (12,367 округляют до 12,4; 12,352 — до 12,4);
v если отбрасываемая цифра равна пяти и за нею следуют только нули, то число округляют до ближайшего четного значения (12,350 округляют до 12,4; 12,450 - до 12,4); (во всех этих примерах предполагалось, что сомнительной является первая цифра за запятой);
v в целых числах цифры, следующие за первой сомнительной, заменяют нулями (например, скорость света в вакууме с=299792500 м/с).
Интерполяцией называют определение значения функции, находящейся между измеренными ее значениями; она может быть аналитической или графической.
Тогда, когда без большой погрешности можно считать, что функция у линейно изменяется между двумя соседними значениями х, для интерполяции используют метод пропорциональных частей. Функцию у, отвечающую данному значению аргумента х, лежащему между двумя табличными значениями x1, у1 и х2, у2 вычисляют по формуле:
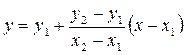
В общем случае следует составить эмпирическое уравнение у = f(x) по измеренным значениям у и по этому уравнению вычислить искомое значение у.
Часто достаточно надежен графический способ. По табличным данным вычерчивают на миллиметровой бумаге кривую у = f(x) в масштабе, позволяющем учесть последнюю значащую цифру измеренной величины. По кривой находят значение y, отвечающее любому значению х.
Экстраполяцией называют определение y, отвечающее некоторому х, лежащему вне пределов опытных данных; экстраполяция может быть аналитической и графической. Точность экстраполяции (особенно при значительном интервале ее) невелика, однако в некоторых случаях постулируют или теоретически обосновывают применение этого способа.
Построение графиков
Графическое изображение экспериментальных и расчетных данных облегчает сравнение величин, позволяет легко обнаружить характер изменения величин — наличие экстремальных точек или точек перегиба, периодичность, появление предельных значений и другие важные свойства. В таблицах эти особенности проявляются менее отчетливо. Наконец, с помощью графиков можно производить дифференцирование и интегрирование, даже не зная математической формы представленной графической зависимости.
При построении графиков соблюдают следующие правила.
Значение независимой переменной (аргумента) откладывают по оси абсцисс, функции — по оси ординат. Какую из двух переменных считать независимой, следует обычно из эксперимента. Если в ходе опыта значения одной переменной устанавливают произвольно, а соответствующие значения других переменных оказываются при этом уже вполне определенными, то первая переменная и считается независимой. Общего правила для выбора аргумента не существует.
Выбор масштаба
v Масштаб нужно выбирать так, чтобы координаты любой точки графика могли быть определены быстро и легко. Если на разграфленной в клетку бумаге (миллиметровой) расстояние между двумя главными соседними линиями разделено на десять равных частей, то наиболее удобно выбирать такой масштаб, в котором это расстояние принято за 1, 2 или 5 единиц или эти значения умножены на 10±n, где n — целое число. Масштаб, при котором чтение графика затруднено, не может считаться приемлемым. Не все линии координатной сетки должны быть надписаны; часто для чтения графика оказывается удобным надписывать линии через одну или несколько. Но какая бы система надписи обозначений не была принята, она должна быть соблюдена на всем графике. Целесообразно, чтобы числа, проставленные на оси, содержали столько значащих цифр, сколько допускает точность данных или сколько можно прочесть по кривой. Для удобства пользования графиком необходимо проставить на каждой координатной оси название представляемой ею величины и единиц, в которых она измеряется.
v Масштаб следует выбирать так, чтобы погрешность измерений соответствовала погрешности на графике не более, чем в одно – два наименьших деления масштаба. При выборе шкалы по оси координат нет необходимости обязательно начинать с нулевого значения, если это не вызвано специальными соображениями (необходимость экстраполяции и т. п.). В соответствии с этим правилом шкала для каждой переменной может начинаться с наименьшего округленного значения из совокупности данных или несколько ниже и кончаться наибольшим округленным значением или несколько выше.
v Если график предназначается для определения коэффициентов уравнения, выражающего зависимость y = f(x), или для экстраполяции полученной зависимости, следует выбирать такую функциональную зависимость, при которой уменьшается кривизна линий (обычно логарифмическую, показательную с дробным показателем степени и др.).
v Масштаб должен быть выбран так, чтобы кривая, насколько это возможно, была наклонена к оси абсцисс под углом, близким к 45°.
При необходимости подчеркнуть характерные особенности в изменении функции (наличие экстремальных точек, точек перегиба и т, п.) следует относительно увеличить масштаб функции и уменьшить масштаб аргумента.
ПРИЛОЖЕНИЕ 2
ДЛЯ ЗАМЕТОК
Кафедра химии

ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
РАБОЧАЯ ТЕТРАДЬ
ДЛЯ ЛАБОРАТОРНЫХ РАБОТ
для студентов, обучающихся по специальности «Фармация»
студента______________________________________________
группы № ____________________________________________

ТВЕРЬ
201 8
УДК 541.1 /.18
ББК 24
Авторы-составители: Бордина Г.Е., Лопина Н.П., Халяпина Я.М.
Под общей редакцией профессора, док.биол.наук. Зубаревой Г.М.
Рецензенты:
Харитонова Е.А. – канд. биол. наук, доцент кафедры биологии ФГБОУ ВО Тверская ГМА
Игнатова Ю.П. – канд. мед. наук, доцент кафедры физиологии ФГБОУ ВО Тверская ГМА
Учебно-методическое пособие одобрено на заседании ЦКМС ТГМА
Физическая и коллоидная химия [Текст]: Рабочая тетрадь для лабораторных работ для студентов фармацевтического факультета / Бордина Г.Е., Лопина Н.П. Халяпина Я.М. // Под общей редакцией: Зубаревой Г.М. – Тверь: Ред.-издат. центр Твер. гос. мед. универ., 2017. – 48 с.
Авторы-составители – сотрудники кафедры химии Тверского государственного медицинского университета:
Галина Евгеньевна Бордина – канд. биол. наук, доцент кафедры химии
Надежда Петровна Лопина – канд. хим. наук, доцент кафедры химии
Янина Михайловна Халяпина – старший преподаватель кафедры химии
Физическая и коллоидная химия. Рабочая тетрадь для лабораторных работ составлено коллективом кафедры химии и биохимии Тверской государственной медицинской академии и предназначено в помощь студентам фармацевтического факультета для подготовки к лабораторно-практическим занятиям.
УДК 541.1/.18
ББК 24
© Бордина Г.Е., Лопина Н.П., Халяпина Я.М., 2012
© Оформление, оригинал-макет. Редакционно-издательский центр Тверской государственной медицинский академии, 2012
ОГЛАВЛЕНИЕ
Предисловие………………………………………………………………….4
Правила техники безопасности……………………………………………5
Химическая посуда и лабораторное оборудование……………………...6 – 10
Лабораторная работа 1. Определение теплоты нейтрализации………11 – 13
Лабораторная работа 2. Свойства буферных растворов……………….14 - 17
Лабораторная работа 3. Кинетика химических реакций. Качественные опыты по химическому равновесию………………………………………18 - 20
Лабораторная работа 4. Качественные и количественные опыты по адсорбции…………………………………………………………………….. 21 - 25
Лабораторная работа 5. Способы получения и методы очистки коллоидных растворов………………………………………………………26 - 29
Лабораторная работа 6. Коагуляция золей. Определение порога коагуляции. Коллоидная защита………………………………………......30 - 34
Лабораторная работа 7. Получение эмульсий. Обращение фаз эмульсий……………………………………………………………………….35 - 36
Лабораторная работа 8. Свойства растворов ВМС……………………...37 - 41
Библиографический список…………………………………………………42
Приложение 1…………………………………………………………………43 - 45
Приложение 2…………………………………………………………………46 - 47
"Опыт – единственно верный путь
спрашивать природу и слышать ответ в ее лаборатории"
Д.И. Менделеев
ПРЕДИСЛОВИЕ
В настоящее время лабораторному практикуму, как специфической и важнейшей форме учебной работы, уделяется особое внимание, так как усвоение изучаемого материала может происходить только в ходе активной деятельности самого учащегося. Эта деятельность реализуется на лабораторно-практических занятиях.
Эксперимент предполагает выработать у студентов определенные навыки научной организации исследований. В этом смысле лабораторный практикум является формой учебной работы, которая позволяет реализовать задачи обучения.
В преподавании химии в медицинских вузах произошли значительные изменения: разработаны новые программы, усилена целевая направленность. Вместе с тем произошло сокращение учебных часов с 76 до 57 по дисциплине «Физическая и коллоидная химия». Изменились требования к лабораторному практикуму по химии. Поэтому в целях экономии времени практических занятий, мы предлагаем оформлять лабораторные работы в «Рабочей тетради».
В рабочей тетради описаны лабораторные работы, помогающие освоению теоретических основ физической и коллоидной химии. После каждого опыта выделено свободное место для самостоятельного выполнения необходимых расчетов и формирования студентами выводов. Если необходимо построение графических зависимостей, то в конце работы имеется копия миллиметровой бумаги для графиков.
Авторы-составители
Дата: 2018-12-21, просмотров: 846.