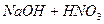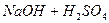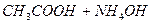Опыт 1. Определение теплоты реакции нейтрализации
Ход работы:
Во взвешенный калориметрический стакан помещают 50 мл 1,0 н раствора щелочи и записывают показатель термометра. В отдельный стакан отмеривают 50 мл 1,0 н раствора кислоты и измеряют его температуру. Затем при работающей мешалке через воронку вливают раствор кислоты в калориметр. Отмечают самую высокую температуру, которую покажет термометр после сливания растворов.
Определение проводят по два раза с сильными кислотами и основаниями и один раз со слабыми, например:
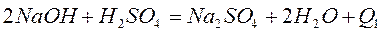
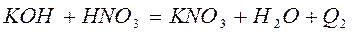
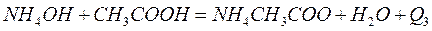
Результаты опытов записывают в таблицу по форме: (см. приложение 1)
| Измеряемые величины | | | | |||
| Масса калориметрического стакана m1, г |
|
|
| |||
| Концентрация растворов, N | ||||||
| Объем каждого раствора V, мл | ||||||
| Температура каждого раствора. tºС | ||||||
Начальная температура
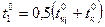
|
|
|
| |||
Температура после нейтрализации 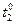
|
|
|
| |||
Общая масса растворов 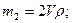 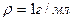
|
|
|
| |||
Обработка результатов эксперимента. Для вычисления по экспериментальным данным теплоты реакций нейтрализации сначала рассчитывают общую теплоемкость калориметра С, учитывая теплоемкость раствора и теплоемкость внутреннего стакана:
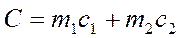
Удельную теплоемкость стекла (C1) принять равной 0,753 Дж/г× град, раствора (C2) = 4,184 Дж/г× град, плотность раствора 1 г/мл.
Затем вычисляют выделившуюся в калориметре теплоту:
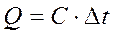
где 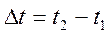
Эта теплота постепенно, по мере выравнивания температуры передается в окружающую среду и может быть принята равной по абсолютной величине изменению энтальпии системы (калориметра):
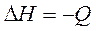
Для расчета стандартной теплоты реакции нейтрализации найденное значение теплоты необходимо пересчитать на 1 моль реагирующей кислоты или основания, что соответствует 1 моль образующейся воды:
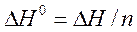 ,
, 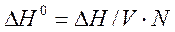
или
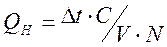
где n - количество одного из веществ, участвующих в реакции, которое требуется рассчитать по исходным данным.
Сравните полученные величины 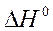 с общепринятым значением теплоты нейтрализации.
с общепринятым значением теплоты нейтрализации.
Для всех сильных кислот и щелочей реакция нейтрализации оказывается одним и тем же процессом:
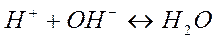
Для них теплота нейтрализации 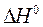 одинакова с небольшими отклонениями из-за влияния теплоемкостей разных катионов и анионов. По данным справочников,
одинакова с небольшими отклонениями из-за влияния теплоемкостей разных катионов и анионов. По данным справочников, 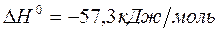 . При участии в реакции слабого электролита, нейтрализация сопровождается его диссоциацией (процесс эндотермический), и измеренная теплота оказывается меньше.
. При участии в реакции слабого электролита, нейтрализация сопровождается его диссоциацией (процесс эндотермический), и измеренная теплота оказывается меньше.
Для вычисления ошибки примененного метода и доверительного интервала возьмите результаты аналогичных опытов у 3 - 4 студентов и проведите их математическую обработку. Рассчитайте:
1. Среднее арифметическое отдельных измерений:
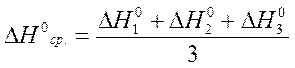
2. Абсолютную ошибку:
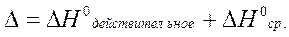
3. Относительную ошибку:
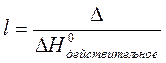
Вычисления: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выполнение работы проверил(а)
______________________________
Дата__________
Лабораторная работа 2
СВОЙСТВА БУФЕРНЫХ РАСТВОРОВ
Опыт 1. Приготовление буферных раствора, с различным значением pH . Зависимость рН буферных растворов от соотношений концентраций и разведения их компонентов
Ход работы:
В трех одинаковых пробирках готовят буферные растворы с различным соотношением компонентов. Для этого набирают с помощью градуированных пипеток 0,1 н раствор CH3COOH и 0,1 н раствор CH3COONa в количествах, указанных ниже.
|
№ пробирки | Состав буферной смеси в мл | |
| 0,1 н CH 3 COOH | 0,1 н CH 3 COONa | |
| 1 2 3 | 9 5 1 | 1 5 9 |
Содержимое пробирок перемешивают путем встряхивания.
Затем готовят серию буферных растворов с тем же соотношением концентраций соли и кислоты, но с меньшей суммарной концентрацией компонентов. Для этого пипеткой отбирают по 1,0 мл приготовленных ранее растворов и к каждому добавляют по 8,0 мл дистиллированной воды, после чего содержимое пробирок перемешивают.
Т.о., в пробирках 1 и 4, 2 и 5, 3 и 6 находятся растворы с одинаковыми соотношениями концентраций соли и кислоты, но растворы в пробирках 4, 5, 6 являются разбавленными по сравнению с растворами в пробирках 1, 2, 3.
Во все шесть пробирок добавляем по 3 – 4 капли индикатора метилового красного, после чего содержимое пробирок перемешивают. На белом фоне сравнивают окраску растворов между собой: 1 и 4; 2 и 5; 3 и 6.
Рассчитайте рН приготовленных буферных растворов (см. приложение 2).
Формула : ____________________________________________________________
pH1= ____________________________________________________________________________________________________________________________________
pH2= ____________________________________________________________________________________________________________________________________
pH3= ____________________________________________________________________________________________________________________________________
Константа диссоциации уксусной кислоты КД = 1,8•10-5
Результаты наблюдений и расчетов записывают по форме (см. приложение 1).
| Пробирки с исходным буферным раствором | 1 | 2 | 3 |
| c ( CH3COONa) : c(CH3COOH) | |||
| Цвет буферного раствора после добавления индикатора | |||
| рН исходного буферного раствора | |||
| Пробирки с разбавленным буферным раствором | 4 | 5 | 6 |
| c ( CH3COONa) : c(CH3COOH) | |||
| Цвет разбавленного буферного раствора после добавления индикатора | |||
| рН разбавленного буферного раствора |
Сделайте вывод о зависимости рН буферных растворов от соотношения концентраций компонентов и разведения.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 2. Выяснение влияния добавления небольших количеств сильных кислот и оснований на рН буферного раствора
Ход работы:
В трех пробирках приготовить по 10 мл буферного раствора ( 5 мл CH3COOH + 5 мл CH3COONa). Содержимое пробирок перемешать путем встряхивания. Прибавить в одну пробирку 5 капель 0,1 н HCl, в другую 5 капель 0,1 н NaOH, а в третью – 5 капель дистиллированной воды. Пробирки встряхнуть. В каждую пробирку добавить по 4 капли индикатора метилового красного.
Результаты наблюдений записать по форме:
| № | Объект изучения | Окраска раствора после добавления индикатора |
| 1 | Буферный раствор + 5 капель HCl | |
| 2 | Буферный раствор + 5 капель NaOH | |
| 3 | Буферный раствор + 5 капель H2O |
Сделайте выводы на основании наблюдений. Обосновать выводы, написав уравнения реакций, показывающих механизм действия ацетатной буферной системы (молекулярном и ионном виде).
________________________________________________________________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Определение буферной емкости растворов
Ход работы:
В колбу налить 10 мл буферного раствора с рН = 5 (4 мл 0,1 н CH3COOH + 6 мл 0,1 н CH3COONa) и прибавить 3 капли индикатора метилового красного. Раствор титровать 0,1 н раствором NaOH до появления окраски (рН = 6,3).
Рассчитать буферную емкость по формуле:
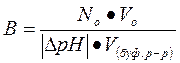 [моль/л]
[моль/л]
Где No – нормальная концентрация раствора NaOH
Vo – объем раствора NaOH, пошедший на титрование, мл.
∆рН – изменение рН испытуемого буферного раствора в процессе титрования
V(буф. р-р) – объем испытуемого буферного раствора, мл.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Влияние разбавления на буферную емкость
Ход работы:
К 10 мл буферного раствора с рН = 5 (4 мл 0,1 н CH3COOH + 6 мл 0,1 н CH3COONa) добавить 10 мл дистиллированной воды, 3 капли индикатора метилового красного и титровать 0,1 н раствором щелочи. Определить буферную емкость как и в предыдущем опыте. V(буф. р-р) = 20 мл (10 + 10)
________________________________________________________________________________________________________________________________________
Сделать вывод о влиянии разбавления на буферную емкость.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 5. Определение общей, активной и потенциальной кислотности
Ход работы:
К 10 мл буферного раствора с рН = 5 (4 мл 0,1 н CH3COOH + 6 мл 0,1 н CH3COONa) прибавить 3 капли индикатора фенолфталеина и титровать 0,1 н раствором гидроксида натрия NaOH до появления бледно-розового окрашивания. Вычислить общую кислотность, а по разности между общей и активной кислотностями – потенциальную кислотность.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выполнение работы проверил(а)
______________________________
Дата__________
Лабораторная работа 3
Дата: 2018-12-21, просмотров: 748.