Аппараты и приспособления для внутривенных введений. Для внутривенных введений могут быть использованы различные аппараты и приспособления:
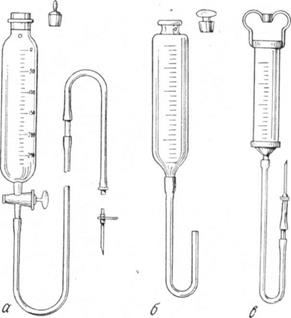
Аппараты для внутривенных введений.
а — аппарат Конькова, б —- упрощенная модель аппарата Конькова. в — шприц Жанэ.
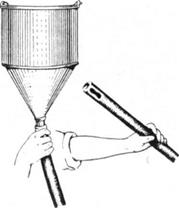
аппараты Боброва, Конькова или цилиндр от шприца Жанэ. Можно воспользоваться и обычной стеклянной воронкой, соединенной длинной резиновой трубкой с канюлей, легко вставляющейся в муфту иглы.
Инфузионный аппарат Конькова состоит из градуированного стеклянного цилиндра емкостью в 150 мл, резиновой трубки, металлической канюли и иглы. Верхняя часть цилиндра закрыта стеклянной пробкой с небольшим отверстием для доступа воздуха. Нижняя часть цилиндра оканчивается утолщением, на которое насажена дренажная трубка длиной 55см и диаметром 6мм. В нижний конец трубки вставляют металлическую канюлю, на которую надевают инфузинную иглу Сайковича. Преимущество этого аппарата заключается в том, что он дает возможность вводить отдельно иглу и соединять ее с трубкой, идущей от аппарата, лишь тогда, когда будет установлена позиция иглы. Очень широкое применение в практике внутривенных введений имеет большой шприц Жанэ. С этой целью используют цилиндр шприца, на конус нижней оправы которого надевают резиновую трубку длиной около 50—60 см и диаметром 6 мм. В нижний конец трубки вставляют металлическую канюлю, на которую надевают иглу Сайковича. Выше канюли в резиновую трубку (на расстоянии 10—15 см) вставляют небольшую стеклянную трубочку, которая является «контрольным окошком», позволяющим проверять правильность положения иглы в момент введения.
Аппарат Боброва (рис. 81) представляет собой широкогорлый градуированный сосуд с резиновой пробкой, в которой имеются два отверстия для изогнутых под прямым углом стеклянных трубок. Одна из них - короткая — соединена с нагнетательными резиновыми баллонами; другая — длинная трубка — спускается почти до дна цилиндра и соединяется посредством резиновой трубки с инъекционной иглой. Большим недостатком этого аппарата является то, что сосуд изготовлен из толстого стекла, которое часто лопается при стерилизации.
Сосуды из стекла, имеющего различные оттенки зеленого цвета, следует считать совершенно непригодными, так как растворы, при нагревании и хранении их в этих сосудах, мутнеют вследствие частичного растворения стекла; к тому же цветное стекло мешает контролировать наличие в жидкости случайных примесей.
Внутривенное введение небольших количеств растворов лекарственных веществ можно производить при помощи шприца соответствующей емкости.
Техника внутривенных введений. Введение лекарств в ток венозной крови обеспечивает быстрое их действие на организм, что имеет особенно важное значение при упадке сердечной деятельности, коллапсе, шоке и других тяжелых состояниях животных. К внутривенным введениям часто прибегают при септических и кровопаразитарных заболеваниях. Однако следует помнить, что введение в вену некоторых лекарственных веществ оказывает очень сильное влияние на кровь и на сердце и что пользоваться этим методом следует с большой осторожностью. Дозы лекарственных веществ при внутривенном введении примерно в 4 раза меньше, чем при введении внутрь.
Внутривенное вливание делают лошадям в яремную или наружную грудную вену; рогатому скоту — в яремную или подкожную вену живота; собакам — бедренную, яремную, плюсневую передне-наружную вену или подкожную вену предплечья; свиньям — в большую ушную вену.
Место пункции вены выстригают, кожу протирают бензином или эфиром, а затем смазывают 1—2 раза 5% спиртовым раствором йода. Беспокойных животных укрощают при помощи закрутки или носовых щипцов. Голову животного слегка поднимают вверх, но так, чтобы не напрягались мышцы яремного желоба. Большим пальцем левой руки сдавливают яремную вену; таким путем сосуд фиксируется, наполняется кровью и хорошо обозначается в яремном желобе. Если же вена плохо обозначена, надо несколько изменить положение головы животного, ослабить закрутку.
В кол иглы можно делать только тогда, когда будет полная уверенность в расположении наполненной вены. Иглу прочно фиксируют указательным и большим пальцами правой руки. Скос иглы должен располагаться к коже или наружу. Вкол лучше производить порывистым, но умеренным толчком, направляя иглу вверх под углом
в 40—45°, чтобы избежать прокола противоположной стенки сосуда. Если после вкола игла сразу в вену не вошла, ее следует слегка подтащить и направить в вену. При попадании иглы в просвет вены кровь сразу же начинает вытекать свободной струей. Если кровь вытекает слабой струей, не соответствующей диаметру иглы, или истекает каплями, то следует легкими поворотами . Пункция яремной вены, или перемещением иглы по вене добиться хорошей струи, в противном случае иглу надо извлечь и сделать повторную пункцию в новом месте. После введения в вену иглу следует осторожно углубить по ходу вены на 2—3 см, а короткие иглы на всю их длину.
Когда при вколе игла засоряется кусочками ткани, кровь не вытекает даже в том случае, если игла свободно лежит в вене; при неполной закупорке просвета иглы кровь истекает каплями или слабой струйкой. В таких случаях необходимо извлечь иглу и заменить ее другой, стерильной, или удалить застрявшие частички в просвете мандреном и произвести прокол той же иглой вторично.
Установив правильную позицию иглы, из инфузионного аппарата выпускают небольшое количество лекарственного раствора, чтобы освободить резиновую трубку от пузырьков воздуха, затем вставляют канюлю трубки в павильон иглы, одновременно освобождая от давления вену и поднимая сосуд с раствором несколько выше места вкола.
Вливание растворов должно быть медленным (со скоростью 20—35 мл в минуту). Скорость тока жидкости регулируется поднятием или опусканием сосуда. Если жидкость перестала вытекать или идет очень медленно.
осторожно исправляют положение иглы. Однако при этом нельзя допускать более глубокого введения иглы или более высокого поднятия сосуда. В таких случаях можно попытаться исправить положение приподниманием головы животного или снятием закрутки. Если от этого ток не улучшается, лучше прекратить инъекцию или произвести пункцию вторично.
После окончания введения, прежде чем извлечь иглу, надо отъединить канюлю от муфты, пережать вену и промыть иглу струей крови. Если игла присоединена к резиновой трубке без канюли (игла Боброва), то для промывания иглы весь аппарат опускают вниз. Промыв иглу, пережимают яремную вену выше места вкола и осторожно извлекают иглу. Место вкола обрабатывают настойкой йода.
Кроме описанных выше правил внутривенных введений, необходимо во всех случаях соблюдать следующие требования: 1) проверять перед введением качество раствора (цвет, прозрачность, температуру и пр.), свойственное данной лекарственной форме; 2) не допускать проникновения в вену пузырьков воздуха; 3) перед введением убедиться в правильности положения иглы; 4) при пользовании цилиндром покрывать его сверху стерильной марлей; 5) во время введения следить за реакцией животного и при появлении резких изменений в состоянии больного немедленно прекращать введение.
Выведение газов из желудка и рубца.
При остром вздутии желудка у лошади и рубца у рогатого скота можно использовать желудочные зонды для выведения газов. При удачном введении зонда в желудок лошади, страдающей острым расширением, через просвет зонда сейчас же начинают выделяться газы. Животное успокаивается, колики быстро утихают.
Если отделение газов задерживается, то легкими движениями зонд углубляют или несколько вытягивают, устанавливая его с расчетом лучшего отделения газа. При закупорке зонда кормовыми массами его промывают при помощи шприца или спринцовки. Вместе с газом может выделяться жидкое содержимое, особенно при низком положении головы животного (или откачивании).
Для отделения газов из рубца у крупного рогатого скота животных надо помещать на трамплин передними ногами. С этой целью можно использовать любые естественные возвышения (бровку канав и т. п.). Такое расположение животных способствует накоплению газа у кардиальной части рубца и прямому выведению через
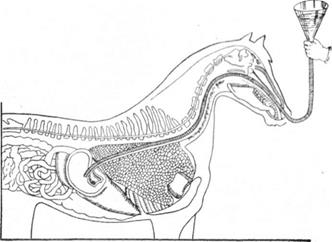
Положение зонда при промывании желудка у лошади.
зонд. Для лучшего отхождения газов из рубца у мелкого рогатого скота животных приподнимают за передние конечности.
Промывание желудка и рубца. Промывание желудка у животных является эффективным лечебным мероприятием при многих заболеваниях (отравления, острое расширение желудка, атонии желудка и рубца, засорения книжки и др.). Промывание желудка у овец, коз и собак производят медицинскими зондами, а у лошадей и крупного рогатого скота — специальными зондами, обеспечивающими выведение разжиженных кормовых масс.
Промывание желудка у лошади производят носопищеводным зондом, к свободному концу которого присоединяют посредством стеклянной трубки дополнительно резиновым шлангом с большой воронкой на конце. Введя зонд в желудок, наполняют воронку водой и, постепенно поднимая ее вверх, непрерывной струей вливают 5—10 л теплой воды (40—47°). Вовремя введения воды воронку необходимо держать в верхнем положении, а затем, при прекращении введения воды, опускать вниз, создавая таким образом то приток, то отток раствора, что способствует лучшему перемешиванию содержимого с водой. После заливания последней порции воды воронку
(при неполном ее освобождении) переносят строго внизу и снимаются. Часть жидкости, таким образом, самопроизвольно вытекает обратно.
Оставшуюся жидкость откачивают шприцами(емкостью200мл), гидропультом с боковым отверстием, велосипедным насосом Комовского. Взамен выкачанной жидкости в желудок вводят еще 5-10л теплой воды. Процедуру повторяют 2-3 раза.
У лошадей при некоторых заболеваниях (острое расширение желудка, метеоризм кишечника и др.) промывание желудка сочетают с глубокими клизмами. Если промывание желудка теплой водой не дает эффекта, т. е. рецепторный аппарат или соответствующие центры не реагируют на такой раздражитель, то делают промывание холодной водой (10—20°), а клизмы ставят из теплой воды.
Промывания преджелудков у крупного рогатого скота удобнее производить зондом В. А. Черкасова. Зонд этот представляет собой плотный отполированный прорезиненный шланг диаметром 45 мм и длиной 2,5 м (рис 85). На конце зонда имеется два отверстия, равные диаметру зонда и удаленные друг от друга на расстояние 10—12 см.
Перед употреблением зонд обильно смазывают вазелином или маслом и легкими движениями вводят его через рот в рубец. Глубина введения определяется расстоянием от губ до 8-го ребра. К свободному концу зонда
38—40°. Для лучшего разжижения содержимого рубца воронку с последней порцией воды ( 8 раз то поднимают вверх, то опускают вниз.
После введения раствора рубец массируют, одновременно опуская вниз конец зонда для вытекания содержимого. Удалив 2—3 ведра содержимого рубца, вновь вливают 3—4 ведра воды с температурой около 10°, а конец зонда быстро опускают вниз. Резкое изменение. У лошадей при некоторых заболеваниях (острое расширение желудка, метеоризм кишечника и др.) промывание желудка сочетают с глубокими клизмами. Если промывание желудка теплой водой не дает эффекта, т. е. рецепторный аппарат или соответствующие центры не реагируют на такой раздражитель, то делают промывание холодной водой (10—20°), а клизмы ставят из теплой воды.
Промывания преджелудков у крупного рогатого скота удобнее производить зондом В. А. Черкасова. Зонд этот представляет собой плотный отполированный прорезиненный шланг диаметром 45 мм и длиной 2,5 м (рис 85). На конце зонда имеется два отверстия, равные диаметру зонда и удаленные друг от друга на расстояние 10—12 см.
38—40°. Для лучшего разжижения содержимого рубца воронку с последней порцией воды ( 8 раз то поднимают вверх, то опускают вниз.
После введения раствора рубец массируют, одновременно опуская вниз конец зонда для вытекания содержимого. Удалив 2—3 ведра содержимого рубца, вновь вливают 3—4 ведра воды с температурой около 10°, а конец зонда быстро опускают вниз. Резкое изменение вниз и снимают. Часть жидкости, таким образом, самопроизвольно вытекает обратно.
Оставшуюся в желудке жидкость откачивают шприцами (емкостью 200 мл), гидропультом с боковым отверстием, велосипедным насосом, насосом Комовского. Взамен выкачанной жидкости в желудок вводят еще
Перед употреблением зонд обильно смазывают вазелином или маслом и легкими движениями вводят его через рот в рубец. Глубина введения определяется расстоянием от губ до 8-го ребра.

К свободному концу зонда присоединяют большую воронку, через которую в преджелудки наливают 4— 5 ведер 1% раствора сульфата натрия с температурой
садового опрыскивателя «Автомакс» или гидропульта (или от водопроводной сети) через зонд под давлением 3—4 атмосферы. Выходя через специальные отверстия зонда, вода создает сильные струйки, способствующие разжижению кормовых масс, которые легко выделяются наружу через отводную трубку (введенную в другую половину носа).
Промывание зоба у птиц. В качестве зонда у птиц можно использовать резиновую трубку, диаметром 5—6 мм и длиной 40—50 см.
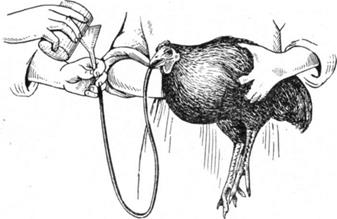
Промывание зоба у курицы.
Птицу фиксируют, раскрывают ей клюв и вводят подготовленный зонд. Для свободного прохождения зонда шею птице несколько вытягивают. Правильность нахождения зонда легко проверяют пальпацией пищевода и зоба, а также по специфическому запаху выделяемых газов. Голову и зонд фиксируют. Через воронку, вставленную в свободный конец зонда, вливают 100—150 мл воды или 0,5% раствора соды.' Затем зонд извлекают и, опустив птице голову, путем легкого массажа зоба по направлению к клюву вытесняют жидкость вместе с содержимым. В случае необходимости промывание повторяют.
Чтобы предотвратить попадание жидкости в дыхательные пути в момент удаления содержимого из зоба, не следует обременять птицу длительной процедурой; необходимо давать ей отдых для свободного дыхания.
Прокол рубца у жвачных. Прокол рубца имеет широкое применение как метод оказания неотложной помощи при сильном вздутии (тимпании). Свое- . временное выведение газов из рубца предотвращает угрозу смерти животного от асфиксии. |
 троакар
троакар
Место прокола находится в области левой голодной ямки на середине горизонтальной линии, проведенной от наружного угла подвздошной кости до последнего ребра. Прокол делают на стоящем, с зафиксированной левой тазовой конечностью, животном.
Для прокола рубца применяют троакары (рис. 88) крупного диаметра, с острым конусовидным или трехгранным стилетом. Конусовидное заострение стилета меньше травмирует ткани при проколе, чем трехгранное. Гильза троакара должна плотно охватывать стилет. Боковые щели в гильзе некоторых систем троакаров нежелательны, так как через них вместе с газом в брюшную полость может попасть содержимое рубца и вызвать Троакар, перитонит.
Прокол производят стерильным инструментом, с соблюдением всех правил асептики и антисептики. Резким и сильным толчком прокалывают все слои брюшной стенки; при этом троакар направляют в сторону правого локтя. Толстую кожу можно предварительно надрезать скальпелем. Сделав прокол рубца, вынимают стилет и постепенно выпускают газы, прикрывая временами ватным тампоном отверстие гильзы. Быстрое удаление газов при сильном вздутии вызывает у животного обморок вследствие отлива крови от мозга.
При закупорке пищевыми массами гильзу прочищают пуговчатым зондом или вставляют в нее стилет.
После прекращения выделения газов через гильзу троакара вливают в рубец 1—2 л противобродильного и дезинфицирующего раствора (1—2% раствор ихтиола, креолина или лизола, 0,5% раствор формалина и др.).
Троакар в случае крайней необходимости можно оставить в рубце на срок, не превышающий 3—5 часов, закрепив гильзу на брюшной стенке. Следует учитывать, что при недостаточной длине гильзы троакара или при движении животного конец гильзы может выйти из рубца и инфицировать брюшную полость.
При извлечении троакара из рубца нужно придерживаться такой последовательности: промыть канал гильзы троакара дезинфицирующим раствором, вставить стилет, надавить пальцами на брюшную стенку по бокам троакара и вынуть троакар. Извлечение одной гильзы (пустой) является грубой ошибкой, ведущей к попаданию пищевых масс в брюшную полость. Место прокола смазывают настойкой йода и закрывают ватой, пропитанной коллодием. Вынужденные повторные проколы допускаются только на новом месте, по соседству с первым проколом.
Прокол рубца у мелких жвачных животных производят 'пробным троакаром или иглой Боброва с тщательно пригнанным к скосу иглы мандреном.
Осложнениями при проколе рубца могут быть перитонит и свищ рубца, что обусловливается погрешностями в асептике и технике прокола.
Прокол толстых кишок у лошадей. Прокол толстых кишок (энтероцентез) у лошади производят для выведения газов при острых вздутиях, угрожающих задушением. Прокол в большинстве случаев проводят на слепой или ободочной кишке.
В случае сильного выпячивания в области правой голодной ямки, прокалывают слепую кишку. Место прокола находится в центре правой голодной ямки, на середине горизонтальной линии, соединяющей наружный бугор подвздошной кости с последним ребром. Прокол производят только после тщательной подготовки рук, а также места операции и стерилизации инструмента,
Слепую кишку прокалывают тонким троакаром с конусообразным острием (диаметр 1,5—2 мм, длина 10— 12 см). В случае острой необходимости и при отсутствии троакара прокол можно сделать соответствующей по длине и диаметру иглой с тщательно пригнанным к скосу иглы мандреном. При употреблении толстого троакара часто наблюдаются осложнения (перитонит).
На месте прокола кожу несколько сдвигают в сторону. Сильным давлением ладони на рукоятку троакара прокалывают брюшную стенку, направляя троакар сверху вниз и внутрь — в сторону мечевидного хряща. Троакар попадает в основание слепой кишки.
После прокола вынимают стилет и медленно выпускают газы через гильзу троакара. Одновременно с этим можно промассировать левую брюшную стенку. Когда выход газов прекратится, через гильзу троакара можно ввести лекарственные растворы. Не позднее чем через час в гильзу троакара вставляют стилет (мандрен) и пальцами прижимая кожу на месте пункции к брюшной стенке, быстро извлекают инструмент. Кожную рану смазывают настойкой йода и закрывают ватой, пропитанной коллодием.
Следует иметь в виду, что энтероцентез лучше производить до наступления пареза кишечника. При соблюдении строгой асептики и подборе соответствующих троакаров осложнения бывают редко.
Прокол левой ободочной кишки ввиду ее подвижности возможен только после предварительного ректального исследования, позволяющего точно определить место ее прикосновения к брюшной стенке, где и производят прокол. Помощник в это время должен удерживать вздувшуюся кишку, прижимая ее (через прямую кишку) к левой брюшной стенке.
Микроскопическая техника
в биологии, совокупность методов и приёмов для изучения с помощью оптического и электронного микроскопов строения, жизнедеятельности, развития, химического состава и физических свойств клеток, тканей и органов. М. т. включает: подготовку живых объектов к микроскопическому исследованию и его проведение, изготовление постоянных (неживых) препаратов; микро-, гисто- и цитохимические исследования; особые методы подготовки препаратов для электронной микроскопии.
Прижизненные наблюдения в проходящем свете осуществляются на простейших, мелких яйцах, культивируемых клетках и тканях, прозрачных участках тела многоклеточных (например, на кровеносных сосудах в плавательной перепонке лягушки). В отражённом свете под микроскопом можно изучать поверхностные структуры клетки, ткани, органа. Для цитофизиологических наблюдений пользуются прижизненным окрашиванием , дающим представление о pH клетки и её органоидов, а также о физиологическом состоянии живого объекта. Для прижизненных наблюдений требуются: нагревательный столик (рис. 1) особый термостат, перестраиваемый на заданную температуру в широком температурном диапазоне; стеклянные, пластмассовые, кварцевые, металлические или другие камеры (рис. 2) с постоянной или проточной средой требуемого состава. Наблюдаемые объекты (чаще клетки однослойных культур) могут длительное время оставаться нормальными при достаточном снабжении их питательными веществами и кислородом. Одна из задач М. т. для живых объектов — повышение контрастности изображения, для чего используется, например, фазово-контрастное устройство. Интерференционная микроскопия дополнительно даёт сведения о толщине объекта, концентрации в нём сухого вещества, содержании воды и показателе преломления. Прижизненные наблюдения проводятся также в тёмном поле (ультрамикроскопия) с использованием специального конденсора; при этом объект освещается сбоку, а фон остаётся тёмным. Темнопольное устройство позволяет увидеть чрезвычайно мелкие (например, коллоидные) частицы. С помощью поляризационного микроскопа можно изучать объекты (или их элементы), обладающие оптической анизотропией . Для исследования как живых, так и неживых биологических объектов применяется люминесцентная микроскопия, особенно для изучения вторичной флуоресценции, возникающей при окраске клеток и тканей слабыми концентрациями флуорохромов (акридиновый оранжевый, эритрозин, родамин и др.). Различия во флуоресценции отдельных химических веществ (нуклеиновых кислот, липидов) позволяют изучать их локализацию, динамику изменений и даже количество изучаемого вещества. Соединение белка с флуорохромом (изоцианат флуоресцеина) и связывание этого вещества с Антителами (см. Иммунофлуоресценция) даёт возможность выяснить локализацию антигенов, судьбу антител и др. вопросы иммунологии (См. Иммунология). Недавно получил распространение метод микроскопии живых и неживых объектов в ультрафиолетовых лучах с использованием специальной кварцевой оптики. Наблюдения над живыми объектами документируются микрокиносъёмкой, особенно замедленной.
Для получения постоянных препаратов объект фиксируют, т. е. убивают так, чтобы он сохранил по возможности неизменной структуру. Наиболее распространённые фиксаторы — формалин, спирт, четырёхокись осмия, а также комбинированные фиксаторы — смеси веществ. Фиксация (особенно для электронной микроскопии) осуществляется также методом лиофилизации , высушиванием мазков (например, крови) или отпечатков. При работе с клеточными культурами используются пластинки из стекла или слюды, на которых клетки располагаются в один слой. В других случаях для микроскопии пользуются срезами, получаемыми на Микротоме, объект при этом обезвоживают и заливают в парафин, целлоидин, желатину или замораживают. Для электронной микроскопии материал обычно фиксируют четырёхокисью осмия, а заливку производят в акриловые мономеры, которые полимеризуют соответствующим катализатором, или в эпоксидные смолы.
Микро-, гисто- и цитохимические исследования. Для повышения контрастности препаратов, наблюдаемых в оптический микроскоп, применяют красители, избирательно окрашивающие разные клеточные структуры. Особенно широко используются красители в гистохимии. Гистохимические реакции основаны на образовании некоторыми веществами нерастворимых и иногда окрашенных осадков, обнаруживаемых микроскопически. Ферменты обнаруживаются в клетках по активности при их воздействии на определённые субстраты, находящиеся в ткани или добавленные извне. Интенсивность гистохимических реакций часто изучают и оценивают визуально. Более совершенны количественные методы оценки, например подсчёт числа клеток с определённой интенсивностью окраски, числа зёрен осадка, а также Авторадиография, Цитофотометрия.
При электронной микроскопии вирусов, микроорганизмов, ультратонких срезов более крупных объектов их контрастность усиливают напылением частиц металла. Для негативного контраста объект помещают в раствор более плотного вещества (например, фосфорно-вольфрамовой кислоты), заполняющего промежутки между изучаемыми частицами, которые выглядят светлыми на тёмном фоне. Контраст усиливают также, применяя «электронные красители» (четырёхокись осмия, уранил и др.), избирательно связывающиеся с некоторыми участками объекта. При использовании ферритина зёрна его, содержащие молекулы железа, обнаруживаются в составе клеточных структур.
Методы фиксации животных
Дата: 2018-12-21, просмотров: 458.