При электролизе водных растворов с растворимым анодом необходимо учитывать металл анода, так как он будет принимать участие в электродной реакции. Если потенциал металла отрицательнее потенциала гидроксо – группы, то на аноде будет идти растворение металла. В случае, когда величины потенциалов металла и гидроксо – группы близки, процесс растворения металла может проходить одновременно с выделением кислорода.
Пример 2.
Напишите уравнения процессов, протекающих на кадмиевых электродах, при электролизе водного раствора сернокислого кадмия и рассчитайте выход вещества по току на катоде, если при прохождении через электролит 1 фарадея электричества выделилось 28 г металла.
Ионный состав электролита:
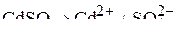
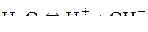 .
.
При распределении ионов по электродам надо учитывать, что кадмиевый анод относится к растворимым электродам. К кадмиевому аноду будут перемещаться отрицательно заряженные сульфат – ионы и ионы гидроксила. То есть на аноде будут присутствовать три частицы: 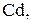
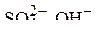 Анион
Анион 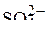 на аноде не окисляются, поэтому остаются две частицы
на аноде не окисляются, поэтому остаются две частицы 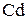 и
и 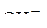 Находим их потенциалы в приложении и выбираем частицу с более отрицательным потенциалом, которая будет окисляться на аноде в первую очередь.
Находим их потенциалы в приложении и выбираем частицу с более отрицательным потенциалом, которая будет окисляться на аноде в первую очередь.
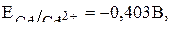
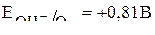 (в нейтральной среде).
(в нейтральной среде).
Сравнивая эти два потенциала видим, что более отрицательный потенциал у кадмия, то есть кадмиевый анод будет растворяться:
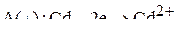 .
.
К катоду из раствора будут перемещаться положительно заряженные ионы водорода и ионы кадмия с соответствующими потенциалами:
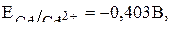
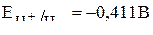 (в нейтральной среде).
(в нейтральной среде).
Так как их потенциал близки, и кадмий относится ко второй группе окислителей таблицы стандартных потенциалов, то на катоде будут происходить два восстановительных процесса:
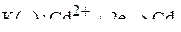
 .
.
Выход металла по току рассчитываем по формуле:

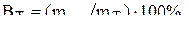
Массу теоретически выделившегося кадмия рассчитывают по первому закону Фарадея:
 ,
,
где Q – количество электричества, прошедшие через электролит, равное 1 Фарадею или 96500 кулон; F– число Фарадея, равное 96500 кулонов; 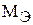 – молярная масса эквивалента кадмия, которую рассчитывают по формуле:
– молярная масса эквивалента кадмия, которую рассчитывают по формуле:
 = A(Cd)/B (Cd) =112/2 = 56г/моль.
= A(Cd)/B (Cd) =112/2 = 56г/моль.
Тогда масса кадмия теоретически будет равна:
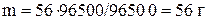 .
.
Выход кадмия по току:
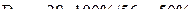 .
.
Пример 3.
Сколько граммов едкого калия 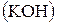 образовалось у катода при электролизе раствора
образовалось у катода при электролизе раствора 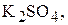 если на аноде выделилось 11,2 л кислорода измеренного при н.у.? Напишите уравнения электродных процессов.Электроды инертные.
если на аноде выделилось 11,2 л кислорода измеренного при н.у.? Напишите уравнения электродных процессов.Электроды инертные.
Ионный состав электролита:
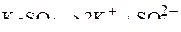
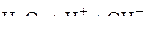 .
.
Под действием приложенного напряжения к положительно заряженному аноду будет притягиваться отрицательно заряженному анионы 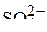 и
и  из воды; к катоду – катионы калия и водорода. На аноде пойдет процесс окисления воды, так как анионы
из воды; к катоду – катионы калия и водорода. На аноде пойдет процесс окисления воды, так как анионы 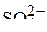 окисляться не будут:
окисляться не будут:

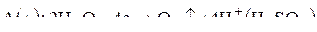 .
.
На катоде пойдет процесс восстановления воды, так как потенциал калия –2,92 В более отрицательный, чем водорода (-0,41В), и из раствора 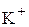 восстанавливаться не будет:
восстанавливаться не будет:
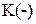
 .
.
По второму закону Фарадея можно записать:
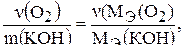
то есть число эквивалентов вещества, выделившегося при электролизе у одного электрода, равно числу эквивалентов вещества, выделившегося у другого электрода.
Объем эквивалента кислорода при н.у. равен 5,6 л, эквивалент едкого калия можно рассчитать по формуле:

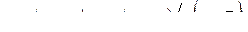
 г/моль.
г/моль.
Тогда масса образовавшегося около катода едкого калия будет равна:
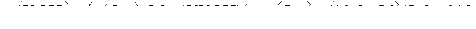 г.
г.
Пример 4.
Какие реакции протекают на электродах при электролизе раствора сульфата цинка с цинковым анодом.
Ионный состав электролита:
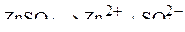
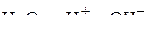 .
.
К цинковому аноду будут притягиваться отрицательно заряженные частицы из раствора: 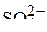 и ионы гидроксила
и ионы гидроксила  , образующиеся при диссоциации воды так же необходимо учесть потенциал самого анода , так как цинковый анод растворимый.
, образующиеся при диссоциации воды так же необходимо учесть потенциал самого анода , так как цинковый анод растворимый.
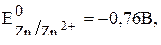
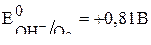 .
.
Так как ионы 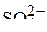 не окисляются на аноде и потенциал цинка более отрицательный, чем потенциал окисления
не окисляются на аноде и потенциал цинка более отрицательный, чем потенциал окисления  из воды, то на цинковом аноде происходит только процесс растворения цинка:
из воды, то на цинковом аноде происходит только процесс растворения цинка:
 ,
,
Так как цинк относится ко второй группе окислителей – его потенциал близок потенциалу восстановления водорода  (в нейтральной среде), на катоде будут протекать две реакции: восстановление цинка и восстановление ионов водорода из воды:
(в нейтральной среде), на катоде будут протекать две реакции: восстановление цинка и восстановление ионов водорода из воды:
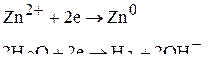
Контрольные задания
161*. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора BaCl2 с угольными электродами. Что такое поляризация в процессах электролиза? Какие виды поляризации вы знаете и каковы причины их возникновения?
162*. При электролизе водного раствора SnCl2 на аноде выделилось 4,43 литра Cl2 (условия нормальные). Какое вещество и в каком количестве выделилось на катоде? Напишите схему электролиза.
163*. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора FeCl3 с инертным анодом. Какова последовательность окисления ионов и молекул на аноде при электролизе солей различных типов?
164*. Какой объем кислорода (н.у.) выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор KOH? Напишите схему электролиза водного раствора KOH.
165*. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора Ca(NO3)2 с инертными электродами. Какова последовательность восстановления ионов и молекул на катоде при электролизе солей различных типов?
166*. При какой силе тока можно получить на катоде 0,5 г никеля, подвергая электролизу раствор NiSO4 в течение 25 мин? Напишите схему процесса электролиза.
167*. При электролизе раствора хлорида двухвалентного металла на аноде выделилось 560 мл газа (условия нормальные), а на катоде за это же время выделилось 1,6 г металла. Какой это металл? Напишите схему электролиза раствора соли.
168*. Какая масса серебра выделится при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин? Напишите схему процесса электролиза раствора нитрата серебра.
169. При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Определите атомную массу металла.
170*. При электролизе водного раствора Cr2(SO4)3 током силой 2 А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз? Напишите схему процесса электролиза.
КОРРОЗИЯ МЕТАЛЛОВ
Примеры решения задач
Коррозия – это разрушение металлов в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты коррозии. Различают химическую коррозию и электрохимическую.
Химическая коррозия – характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания различают:
а) газовую коррозию–в газах, обычно при высокой температуре, при действии на металл, сухого газа, например  ,
,  и др.
и др.
б) коррозию в растворах неэлектролитов – агрессивных органических жидкостях, например, сернистая нефть.
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодные растворения металла и катодные восстановления окислителя внешней среды. Окислителями при этом служат молекулы кислорода 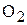 , растворенные в воде, хлора
, растворенные в воде, хлора 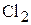 , ионы водорода
, ионы водорода 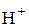 ,
, 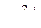 ,
, 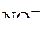 и др. Электрохимическая коррозия может протекать:
и др. Электрохимическая коррозия может протекать:
а) в электролитах водных растворах солей, кислот, щелочей, морскою воды;
б) в атмосфере любого влажного газа;
в) в почве.
Механизм электрохимической коррозии заключается в следующем.
На анодных участках коррозирующего металла протекает процесс анодного окисления металла:
 .
.
На катодных участках протекает процесс катодного восстановления окислителей.
Наиболее часто при коррозии наблюдается восстановление кислорода:
В нейтральной или щелочной среде
В кислой среде 
и выделение водорода 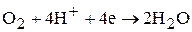
 .
.
Кроме анодных и катодных реакций при электрохимической коррозии происходит движение электронов в металле и ионов в электролите, в котором металл находится. Протекают вторичные химические реакции. Например, взаимодействие ионов металла, образующихся на анодных участках, с гидроксид–ионами, образующихся в результате катодных процессов:

 где
где  –является продуктом коррозии металла.
–является продуктом коррозии металла.
Процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а движутся внутри металла.
Коррозия – процесс самопроизвольный, и энергия Гиббса реакций имеет отрицательно значения. Так как 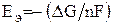 , возможность протекания коррозии может быть установлена по знаку ЭДС элемента. Если ЭДС имеет положительное значение
, возможность протекания коррозии может быть установлена по знаку ЭДС элемента. Если ЭДС имеет положительное значение 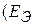 > 0) то коррозия, возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя
> 0) то коррозия, возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя 
 то коррозия возможна при условии, что потенциал окислителя положительнее потенциала металла:
то коррозия возможна при условии, что потенциал окислителя положительнее потенциала металла:
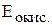 >
> 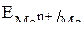
Дата: 2018-11-18, просмотров: 821.