Концентрационный гальванический элемент – это элемент, в котором оба электрода выполнены из одного металла, и разность потенциалов образуется за счет того, что эти электроды опущены в растворы своих солей с различной концентрацией.
На электроде, опущенном в раствор соли с меньшей концентрацией потенциалопределяющих ионов, возникает более отрицательный потенциал, и этот электрод будет анодом. На электроде, опущенном в раствор с большей концентрацией соли, возникает более положительный потенциал; этот электрод будет катодом.
Примеры и решения задач
Пример 1.
Рассчитайте ЭДС цинково – медного гальванического элемента с концентрацией потенциал определяющих ионов цинка 1 моль/л и ионов меди 0,01 моль/л. Напишите уравнения реакций, протекающих на электродах и суммарную токообразующую реакцию. Составьте схему работы данного гальванического элемента.
Так как концентрация ионов меди отличается от стандартного значения концентрации, равного 1 моль/л, то равновесный потенциал медного электрода рассчитываем по уравнению Нернста.
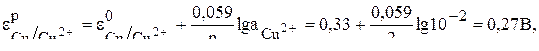
Равновесный потенциал цинкового электрода будет равен его стандартному значению (–0,76В), так как концентрация ионов цинка в растворе равна 1 моль/л.
Анодом в данном гальваническом элементе будет цинк, так как его потенциал более отрицательный, чем потенциал медного электрода. Тогда электродвижущая сила гальванического элемента по уравнению (7) будет равна разности потенциалов медного и цинкового электродов.

На аноде гальванического элемента протекает реакция окисления цинка:

на катоде идет реакция восстановления ионов меди:

Суммарная токообразующая реакция получается алгебраическим сложением электродных реакций

Схема гальванического элемента:
A (-) Zn | Zn2+ || Cu2+| Cu (+) K
Anionn-
←
Пример 2.
Напишите уравнение реакции, протекающей на водородном электроде никелевого – водородного гальванического элемента при стандартных условиях.
Из таблицы стандартных потенциалов запишем стандартные потенциалы электродов. Стандартный потенциал водородного электрода 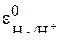 равен (+0,00В), а стандартный потенциал никелевого электрода
равен (+0,00В), а стандартный потенциал никелевого электрода 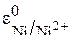 равен (–0,25В). Так как потенциал никелевого электрода более отрицательный, то он будет анодом, а водородный электрод – катодом. Поэтому запишем для водородного электрода реакцию восстановления:
равен (–0,25В). Так как потенциал никелевого электрода более отрицательный, то он будет анодом, а водородный электрод – катодом. Поэтому запишем для водородного электрода реакцию восстановления:

 .
.
Пример 3.
Рассчитайте ЭДС медного концентрационного гальванического элемента при концентрации потенциалопределяющих ионов 0,01 моль/л и 1 моль/л. Напишите уравнения реакций, протекающих на электродах и суммарную реакцию, составьте схему элемента.
Чтобы определить анод и катод в концентрационном гальваническом элементе, надо рассчитать равновесные потенциалы его электродов. Значение потенциала электрода с концентрацией ионов меди 1 моль/л можно взять из таблицы 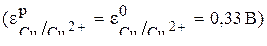 . Для концентрации 0,01 моль/л необходимо рассчитать равновесный потенциал электрода по уравнению Нернста (4):
. Для концентрации 0,01 моль/л необходимо рассчитать равновесный потенциал электрода по уравнению Нернста (4):
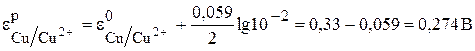 .
.
Сравнивая эти два потенциала, видим, что электрод с концентрацией потенциалопределяющих ионов 0,01 моль/л имеет более отрицательный потенциал (0,27В). Этот электрод будет анодом, а второй электрод–катодом.
Рассчитаем ЭДС по уравнению (6)

Запишем уравнения электродных реакций и суммарную токообразующую реакцию:

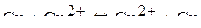
Схема медного концентрационного элемента
A (-) Cu | Cu2+ || Cu2+| Cu (+) K
aCu2+= 10-2 моль/л Anionn- aCu2+= 1моль/л
←
Пример 4.
При какой активности ионов 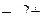 равновесный потенциал железного электрода при 298 К будет равен стандартному потенциалу цинкового электрода.
равновесный потенциал железного электрода при 298 К будет равен стандартному потенциалу цинкового электрода.
Зависимость электродного потенциала от концентрации выражается уравнением Нернста:
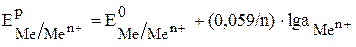
Для железного электрода это уравнение будет иметь вид:
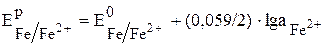 .
.
По условию задачи:
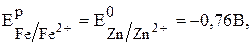
Стандартные потенциалы цинка (–0,76В) и железа (– 0,44В) взяты из таблицы стандартных потенциалов. Тогда можно записать:
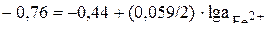

Пример 5.
Рассчитайте потенциал кислородного электрода со стандартным давлением кислорода и рН4.
Равновесный потенциал кислородного электрода по уравнению (6) равен:
 рН.
рН.
Подставляя в уравнение данные из условия задачи, получаем:
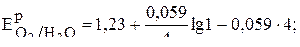
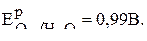
Контрольные задания
141*. На сколько изменится потенциал цинкового электрода, если раствор цинка, в который он погружен, разбавить в 10 раз?
Таблица 6. Стандартные потенциалы  некоторых
некоторых
металлических и газовых электродов (Т=298 К)
| Электрод | Электродная реакция |  , В , В
|
| K+ / K | K+ +  = K = K
| –2,925 |
| Ba2+ / Ba | Ba2+ + 2  = Ba = Ba
| –2,906 |
| Ca2+ / Ca | Ca2+ + 2  = Ca = Ca
| –2,866 |
| Mg2+ / Mg | Mg2+ + 2  = Mg = Mg
| –2,363 |
| Mn2+ / Mn | Mn2+ + 2  = Mn = Mn
| –1,180 |
| Zn2+ / Zn | Zn2+ + 2  = Zn = Zn
| –0,763 |
| Cr2+ / Cr | Cr2+ + 2  = Cr = Cr
| –0,744 |
| Fe2+ / Fe | Fe2+ + 2  =Fe =Fe
| –0,440 |
| Cd2+ / Cd | Cd2+ + 2  = Cd = Cd
| –0,403 |
| Ni2+ / Ni | Ni2+ + 2  =Ni =Ni
| –0,250 |
| Sn2+ / Sn | Sn2+ + 2  = Sn = Sn
| –0,136 |
| Pb2+ / Pb | Pb2+ + 2  = Pb = Pb
| –0,126 |
| Fe3+ / Fe | Fe3+ + 3  = Fe = Fe
| –0,036 |
| H+ / H | H+ +  = H = H
| +0,000 |
| Cu2+ / Cu | Cu2+ + 2  =Cu =Cu
| +0,337 |
| Ag+ / Ag | Ag+ +  = Ag = Ag
| +0,799 |
142*. Вычислите потенциал водородного электрода, если [H+]=
= 3,8·10-3 моль/ л.
143*. Потенциал водородного электрода равен 0,145 В. Определите pH раствора.
144*. Вычислите, как изменится электродный потенциал цинка, если концентрация раствора сульфата цинка, в который погружена цинковая пластина, уменьшится от 0,1 до 0,01 моль/л.
145*. Потенциал марганцевого электрода, помещенного в раствор его соли, составил 1,1 В. Вычислите концентрацию ионов марганца Mn2+ (моль/л).
146*. Вычислите потенциал железного электрода, погруженного в раствор, содержащий 0,0699 г FeCl2 в 0,5 л.
147*. Рассчитайте электродные потенциалы магния в растворе его соли при концентрациях иона Mg2+ 0,1; 0,01; 0,001 моль/л.
148*. Вычислите концентрацию ионов Н+ в растворе, в котором потенциал водородного электрода равен 236 мВ.
149*. Определите величину электродного потенциала меди, погру-женной в 0,0005 М раствор Cu(NO3)2.
150*. При какой концентрации ионов Сu2+ (моль/л) значение по-тенциала медного электрода становится равным стандартному потенциалу водородного электрода?
151*. ЭДС гальванического элемента, образованного никелем, по-груженным в раствор его соли с концентрацией ионов никеля 10-4 моль/л, и серебром, погруженным в раствор его соли, равен 1,108 В. Определите концентрацию ионов Ag+ в растворе его соли.
152*. Составьте схему работы гальванического элемента, образо-ванного железом и свинцом, погруженными в 0,005 М растворы их солей. Рассчитайте ЭДС этого элемента.
153*. Cоставьте схему процессов, происходящих при работе медно-кадмиевого гальванического элемента в стандартных условиях, рассчитайте его ЭДС. Что такое концентрационный гальванический элемент? Приведите пример.
154*. Вычислите ЭДС серебряно-цинкового гальванического элемента, если образующие его электроды погружены в растворы с концентрацией катиона 0,002 моль/л. Cоставьте схему элемента.
155*. Рассчитайте ЭДС гальванического элемента, образованного магнием и цинком, погруженными в растворы их солей с концентрациями ионов [Mg2+]=1,8·10-5 , [Zn2+]=2,5·10-2 моль/ л.
156*. Составьте схему концентрационного гальванического элемента: серебряный электрод в растворе его соли с [Ag+]=10-4 моль/л и серебряный электрод в растворе с [Ag+]=10-5 моль/ л. Укажите, какой из электродов будет анодом, какой - катодом. Рассчитайте ЭДС элемента.
157*. Рассчитайте ЭДС гальванического элемента, состоящего из двух медных пластин, погруженных в раствор соли меди с концентрацией у одного из электродов [Cu2+]=1,0 моль/ л, а у другого - [Cu2+]=10-3 моль/л.
158*. Гальваническая цепь составлена из железа, погруженного в раствор его соли с концентрацией ионов Fe2+, равной 0,001 моль/л, и меди, погружённой в раствор её соли. Какой концентрации должен быть раствор меди, чтобы ЭДС цепи была равной нулю?
159*. Составьте схему, напишите уравнения электродных процессов элемента, состоящего из медной и кадмиевой пластин, погруженных в раствор, содержащий собственные ионы с концентрацией [Cd2+]=[Cu2+] = 1,0 моль/л. Рассчитайте ЭДС этого элемента.
160*. Гальванический элемент состоит из никеля, погруженного в раствор его соли с концентрацией ионов Ni2+, равной 10-4 моль/л, и серебра, погруженного в раствор его соли с концентрацией ионов Ag+, равной 10-2 моль/л. Рассчитайте ЭДС гальванического элемента.
ЭЛЕКТРОЛИЗ
Примеры решения задач
Электролизом называют процессы, происходящие под действием электрического тока подаваемого от внешнего источника на электроды, опущенные в расплав или раствор электролита.
На электроде, соединенном с положительным полюсом постоянного источника тока, протекают реакции окисления. Этот электрод является анодом. Растворимые аноды изготавливают из цветных металлов (цинк, медь, олово и др.) Нерастворимые аноды – из золота, металлов платиновой группы, а также из угля или графита.
На электроде, соединенном с отрицательным полюсом постоянного источника тока, происходят реакции восстановления, этот электрод будет являться катодом.
Рассмотрим электродные реакции, происходящие при электролизе расплава хлористого натрия на графитовых электродах.
При плавлении происходит термическая диссоциация соли. Ионный состав электролита будет следующий:

При наложении на электроды напряжения от внешнего источника тока в электролите начнется направленное движение ионов, причем, отрицательно заряженные ионы (анионы) будут перемещаться к аноду, а положительно заряженные ионы (катионы) – к катоду.
В данном случае к аноду будут притягиваться анионы хлора, и на
аноде будет идти процесс их окисления:

К катоду будут притягиваться катионы натрия, и на нем пойдет процесс восстановления:
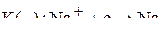
Суммарная реакция:
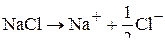
В результате электролиза расплавов солей можно получить металлы в чистом виде.
Дата: 2018-11-18, просмотров: 1358.