Примеры решения задач
Количественный состав раствора выражается с помощью понятия «концентрация», под которым понимается содержание растворенного вещества в единице массы или объема раствора. Чаще всего для выражения состава раствора используют массовую долю, молярную концентрацию (молярность), эквивалентную концентрацию, титр раствора.
Массовая доля – это отношение массы растворенного вещества к общей массе раствора:
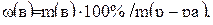 (1)
(1)
где – 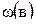 массовая доля растворенного вещества; m(в) – масса растворенного вещества, г; m(p-pa) – масса раствора, г.
массовая доля растворенного вещества; m(в) – масса растворенного вещества, г; m(p-pa) – масса раствора, г.
Масса раствора является суммой масс растворенного вещества и растворителя. Поэтому можно записать
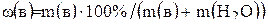 (2)
(2)
Массовую долю выражают в долях единицы или в процентах.
Если известен объем раствора и его плотность, то процентную концентрацию можно рассчитать по формуле:
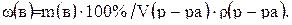 (3)
(3)
где 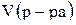 – объем раствора, мл;
– объем раствора, мл; 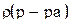 – плотность раствора, г/мл.
– плотность раствора, г/мл.
Молярная концентрация – (молярность) показывает число молей растворенного вещества, содержащего в 1 л раствора:
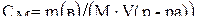 , (4)
, (4)
где 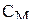 – молярная концентрация моль/л,
– молярная концентрация моль/л, 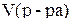 – объем раствора, л; m(в) – масса растворенного вещества, (г);
– объем раствора, л; m(в) – масса растворенного вещества, (г); 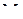 – молярная масса растворенного вещества, г/моль.
– молярная масса растворенного вещества, г/моль.
Молярная концентрация выражается в моль/л. Эта размерность иногда обозначается М, например: 3М KOH.
Молярная концентрация эквивалента (нормальность, эквивалентная концентрация, нормальная концентрация) показывает, сколько молей эквивалентов растворенного вещества содержится в 1 л раствора:
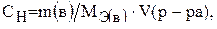 (5)
(5)
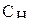 – молярная концентрация эквивалента (моль/л), m(в) – масса растворенного вещества, г; V – объем, (л);
– молярная концентрация эквивалента (моль/л), m(в) – масса растворенного вещества, г; V – объем, (л); 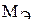 – молярная масса эквивалентов вещества, г/моль.
– молярная масса эквивалентов вещества, г/моль.
Молярная концентрация эквивалентов вещества выражается в моль/л. Это размерность иногда изображается н., например 2н. 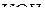 .
.
Титр (Т) – число граммов растворенного вещества в 1 мл раствора.
Титр можно рассчитать по формуле:
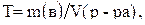 (6)
(6)
где m(в-ва) – масса вещества, в г; 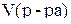 – объем раствора, в мл. Единицы измерения титра – г/мл.
– объем раствора, в мл. Единицы измерения титра – г/мл.
Пример 1.
В воде объемом 240 мл растворили 40 г 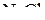 . Рассчитайте массовую долю (%) полученного раствора.
. Рассчитайте массовую долю (%) полученного раствора.
В этой задаче раствор состоит из 240 г воды (т.к. плотность воды 1г/моль) и 40 г растворенного вещества 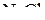 . Масса раствора будет:
. Масса раствора будет:
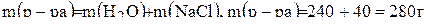 .
.
Далее решаем задачу по формуле (2):

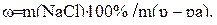
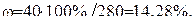
Пример 2.
Рассчитайте процентную концентрацию сульфата магния в растворе, содержащем 55 г 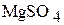 0,5 л раствора. Плотность раствора
0,5 л раствора. Плотность раствора 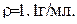
Для решения задачи можно воспользоваться формулой (3):
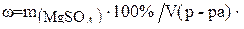
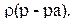
Подставляя данные задачи, получим:
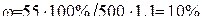
Пример 3.
Рассчитайте молярность, нормальность и титр 31% раствора, 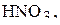 плотность которого равна 1,2 г/мл.
плотность которого равна 1,2 г/мл.
Из определения молярной и нормальной концентраций известно, что если в задаче не указан объем раствора, то концентрации рассчитываются на 1л раствора. Эти концентрации можно найти по формулам (4) и (5) и (6).
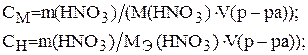
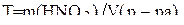
Молярную массу HNO3 находят по периодической таблице элементов Д. И. Менделеева, складывая атомные массы водорода, азота и кислорода M(HNO3)×= 63 г/моль. Молярную массу эквивалента HNO3 находят по формуле:
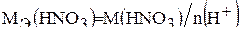 ,
, 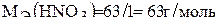 .
.
Неизвестную массу HNO3 можно найти по формуле расчета процентного концентрации:
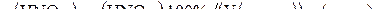 .
.
Отсюда масса азотной кислоты будет равна:
m (HNO3) = (31×1000×1,2 )=372 г.
Находим молярную концентрацию, нормальную и титр раствора: 
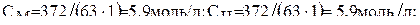
T = 372:1000 = 0,372 г/мл.
Пример 4.
Какой объем 2М раствора Na2SO4 нужно взять для приготовления 800 мл 0,5 н раствора?
Так как молярная концентрация связана с молярной массой растворенного вещества, а нормальная – с молярной массой эквивалента, то для решения этой задачи необходимо найти:
М (Na2SO4) = 23×2 + 32+16×4 = 142 г/моль,
МЭ (Na2SO4) = М (Na2SO4) / (В(Na+)×n (Na+) = 142 / (1× 2) = 71г/моль.
Рассчитываем массу Na2SO4, которая должна находится в 800 мл 0,5 н раствора из формулы (5):
СН = m(Na2SO4)/(MЭ(Na2SO4) × V(p-pa));
m(Na2SO4)= СН×( МЭ (Na2SO4)×V(p-pa));
m(Na2SO4) = 0,5 × 71 × 0,8=28,4 г.
Рассчитываем объем 2М раствора Na2SO4, которую надо взять, чтобы в нем содержалось 28,4 г Na2SO4, из формулы (4):
СM = m(Na2SO4)/ (М (Na2SO4) × V(p-pa));
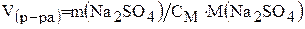 ;
;

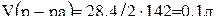 .
.
Пример 5.
Сколько литров 0,05 н H2SO4 можно приготовить из 50 мл 96% раствора H2SO4 с плотностью, равной 1,84 г/мл?
Рассчитываем массу H2SO4, которая содержится в 50 мл 96% раствора из формулы (3):
w = (m (H2SO4) × 100% / (V(p-pa) × r(p-pa)),
отсюда:
m (H2SO4) = (w × V(p-pa)× r(p-pa)) /100;
m (H2SO4) = (96 × 50 ×1,84)/100 = 88,32 г.
Для перехода к нормальной концентрации необходимо рассчитать величину молярной массы эквивалента H2SO4 по формуле:
МЭ (H2SO4) = M (H2SO4) / n(H+);
МЭ (H2SO4) =98/2=49 г/моль.
Рассчитываем сколько литров 0,05н H2SO4 можно приготовить, имея 50 мл 96% раствора H2SO4 по формуле (5):
СН = m(H2SO4) / (MЭ(H2SO4) × V(p-pa));
V (p-pa) = m(H2SO4) / (СН× MЭ(H2SO4));
V (p-pa) = 88,32 /(0,05 × 49) = 36,05 л.
Контрольные задания
81. Какой объем 10%-ного раствора гидроксида калия (=1,08 г/см3) можно приготовить из 15 г КОН?
82. В 450 мл воды растворили 50 г гидроксида натрия. Рассчитайте процентную концентрацию полученного раствора.
83. Сколько граммов сульфата натрия нужно взять для приготовления 10 л 8%-ного раствора (=1,075 г/см3)?
84. Плотность 10%-ного раствора гидроксида натрия равна 1,1 г/см3. Сколько граммов гидроксида натрия потребуется для приготовления 40 мл этого раствора?
85. Чему равна молярность раствора едкого калия, если 600 мл его содержат 16,8 г едкого калия?
86. Вычислите молярную концентрацию раствора сульфата калия, в 20 мл которого содержится 2,74 г растворенного вещества.
87. В 100 мл раствора содержится 1 г хлорида натрия. Рассчитайте молярность этого раствора.
88. Сколько граммов хлорида бария содержится в 0,025 л 0,25 н. раствора?
89. В 33,3 мл воды растворили 16,7 г серной кислоты. Плотность полученного раствора 1,28 г/см3. Рассчитайте нормальную концентрацию этого раствора.
90. Рассчитайте молярную концентрацию 8%-ного раствора сульфата натрия ( = 1,075 г/см3).
91. Какое количество 20%-ного раствора хлорида калия ( = =1,13 г/см3) потребуется для приготовления 10 л 0,05 М раствора хлорида калия?
92. Рассчитайте молярную концентрацию 0,6 н. раствора нитрата алюминия.
93. Какое количество 2 М раствора серной кислоты потребуется для приготовления 500 мл 0,05 М раствора серной кислоты?
94. Вычислите массовую долю (в процентах) и молярность 8 н. раствора азотной кислоты, плотность которого равна 1,246 г/см3.
95. Сколько литров 0,1 н. раствора HNO3 можно приготовить из 0,07 л 30%-ного раствора HNO3 ( = 1,180 г/см3)?
96. Какой объем 2М раствора Na2CO3 нужно взять для приготовления 1 л 0,25 н. раствора?
97. Сколько миллилитров 96%-ного раствора серной кислоты (= =1,84 г/см3) нужно взять для приготовления 1 л 0,25 н. раствора?
98. Сколько миллилитров концентрированной соляной кислоты (= =1.19 г/см3), содержащей 38% НСl, нужно взять для приготовления 1 л 2 н. раствора?
99. Рассчитайте молярную концентрацию эквивалента (нормальность) концентрированной соляной кислоты ( = 1,18 г/см3) с массовой долей 36,5%.
100. В 1 кг воды растворено 666 г КОН ( =1,395 г/см3). Найдите молярность раствора.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Примеры решения задач.
Электролитами называют вещества, расплавы и растворы которых проводят электрический ток. Для них характерна ионная проводимость.
Условно электролиты делят на слабые и сильные электролиты. Слабые электролиты – вещества, которые в растворах лишь частично диссоциируют на ионы, и в которых наряду с ионами содержатся недиссоциированные молекулы.
К слабым электролитам относят соединения с полярными ковалентными связями: кислоты Н2СО3, Н2S, НСN, НNO2, H2SO3 и др; основания р – и d – элементов В(ОН)3, Al(OH)3, Cu(OH)2, Fe(OH)3, Fe(OH)2, NH4OH и др., воду (Н2О).
Слабые электролиты характеризуется степенью диссоциации a и константою диссоциации КД, которые связаны между собой уравнением:
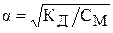 ,
,
где, a – степень диссоциации слабого электролита; 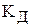 – его константа диссоциации; СМ – кнцентрация раствора, моль/л.
– его константа диссоциации; СМ – кнцентрация раствора, моль/л.
Данное уравнение называется законом разведение Оствальда.
Сильные электролиты – при растворении, в воде или расплаве практически полностью диссоциируют на ионы, вследствие чего хорошо проводят электрический ток. К сильным электролитам относятся соединения с ионными или сильно полярными связями: кислоты HCl, HBr, HJ, НСlO4, Н2SO4, НNO3; основания LiOH, NaOH, КОН, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Са(ОН)2; соли.
В растворах сильных электролитов из-за полной их диссоциации возрастает число ионов в растворе, и увеличиваются силы межмолекулярного взаимодействия между ними.
Каждый ион окружен ионной атмосферой, образованной противоположно заряженными ионами, поэтому концентрацию ионов заменяют их активностью, т.е. условного (эффективной) концентрацией:
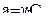
где – коэффициент активности, с–концентрация иона в растворе, моль/л.
В разбавленных растворах электролитов коэффициент активности иона зависит от ионного силы раствора J, которая равна:
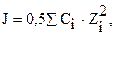
где Сi – концентрация i – того иона в растворе; Zi–заряд иона.
Дата: 2018-11-18, просмотров: 755.