И АНАЛИЗВЕЩЕСТВА
Литература. [1], гл. XVI, § 16.1-16.3; вопросы для самоконтроля: с. 515, № 16.9 – 16.12.
Вопросы для самопроверки
1. Что такое химическая идентификация вещества?
2. Перечислите известные вам методы количественного анализа.
3. Какие методы анализа относят к химическим методам и какие к инструментальным?
4. Какие принципы лежат в основе известных вам методов анализа?
5. Изложите основы гравиметрического метода анализа.
6. Какие методы с применением титрования вы знаете и в каких случаях они применяются?
7. Какие основные электрохимические методы используются при
анализе?
8. На чем основан хроматографический метод анализа и каковы области его применения?
9. Перечислите основные оптические методы анализа.
Должен знать: понятие о качественном и количественном анализе; наиболее распространенные методы химического и инструментального анализа и области их применения.
Должен уметь: объяснять принципы, лежащие в основе методов качественного и количественного анализа веществ.
ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Каждый студент выполняет вариант контрольной работы, обозначенный двумя последними цифрами его учебного шифра в зачетной книжке.
1. ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ
Примеры решения задач
Химический эквивалент – это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентно одному иону водорода в кислотно-основных, ионообменных реакциях или одному электрону в окислительно–восстановительных реакциях.
Эквивалент элемента (Э), атомная масса (А) и валентность (В) связаны соотношением:
Э = А/В.
Масса одного эквивалента элемента или вещества называется молярной массой эквивалента 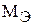 . Размерность – г/моль.
. Размерность – г/моль.
Пример 1.
Определите молярную массу эквивалента следующих элементов и соединений: алюминия, серы, хлороводородной кислоты, серной кислоты, гидроксида кальция, сульфата алюминия.
Молярная масса эквивалента элемента 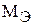 определяется по формуле
определяется по формуле
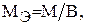 (1)
(1)
где М – молярная масса элемента, г/моль; В - валентность элемента.
Для алюминия молярная масса эквивалента равна:
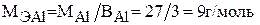
Для серы величина молярной массы эквивалента будет переменной в зависимости от значения ее валентности:
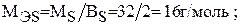

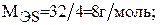
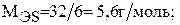
Молярная масса эквивалента кислоты определяется по формуле:
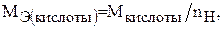 (2)
(2)
где 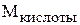 – молярная масса кислоты;
– молярная масса кислоты; 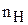 – число атомов водорода, которое замещается в реакции (основность кислоты).
– число атомов водорода, которое замещается в реакции (основность кислоты).
Определяем молярную массу эквивалента хлороводородной кислоты:
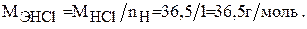
Молярная масса эквивалента серной кислоты равна:
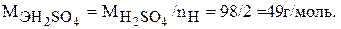
Молярная масса эквивалента основания определяется по формуле:
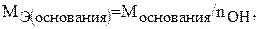 (3)
(3)
где М – молярная масса основания; 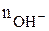 – число
– число 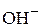 – групп, которое замещается в реакции (кислотность).
– групп, которое замещается в реакции (кислотность).
Молярная масса эквивалента гидроксида кальция равна:
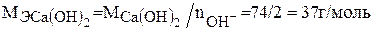
Молярная масса эквивалента соли определяется по формуле:
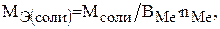 (4)
(4)
где М – молярная масса соли; ВМе – валентность металла, nМе – число атомов металла.
Молярная масса эквивалента сульфата алюминия равна:

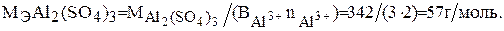
Пример 2.
Определите: а) молярную массу эквивалента фосфорной кислоты при взаимодействии ее со щелочью с образованием продуктов NaH2PO4, Na2HPO4, Na3PO4; б) молярную массу эквивалента гидроксида меди (II) при взаимодействии его с хлороводородной кислотой с образованием Сu(OH)Cl и СuCl2.
Молярные массы эквивалентов кислот и оснований зависят от числа обмениваемых ионов водорода и гидроксогрупп в уравнениях реакции.
а) Составляем уравнение взаимодействия фосфорной кислоты с гидроксидом натрия:
H3PO4 + NaOH = NaH2PO4 + H2O
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
H3PO4 + 3NaOH = Na3PO4 + 3H2O
В первой реакции в молекуле фосфорной кислоты замещается один атом водорода, во второй реакции замещается два атома водорода, в третьей реакции замещаются три атома водорода. Молярная масса эквивалента кислоты, рассчитываемая по формуле (2), в каждом случае будет равна:
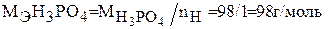
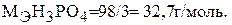
б) Составляем уравнения взаимодействия гидроксида меди (II) с хлороводородной кислотой:
Сu(OH)2 + HCl = Cu(OH)Cl + H2O;
Сu(OH)2 + 2HCl = CuCl2 + 2H2O.
В первой реакции одна группа OH- замещается на хлорид – ион т.е. 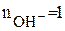 ; во второй реакции замещаются две гидроксильные группы –
; во второй реакции замещаются две гидроксильные группы – 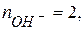 тогда:
тогда:
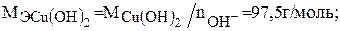
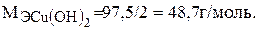
Пример 3.
Рассчитайте молярную массу эквивалента оксида марганца.
Молярная масса эквивалента окиси рассчитывается по формуле:
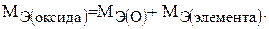 (5)
(5)
Рассчитываем эквиваленты кислорода и марганца по формуле (1):

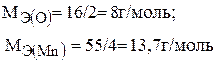
Тогда эквивалент оксида марганца (IV) будет:
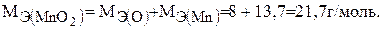
Пример 4.
Хлорид металла содержит 69% хлора. Вычислить молярную массу эквивалента металла.
По закону эквивалентов все вещества реагируют друг с другом пропорционально молярным массам их эквивалентов:
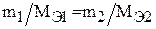
где m1 и m2 – массы взаимодействующих веществ, г; 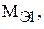
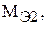 – молярные массы их эквивалентов, г/моль.
– молярные массы их эквивалентов, г/моль.
Запишем уравнение закона эквивалентов для условия задачи:
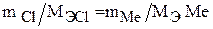
Отсюда молярная масса эквивалента металла будет равна:
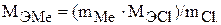
Находим массовую долю металла в хлориде:
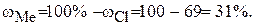
Молярную массу эквивалента хлора находим по формуле (1):
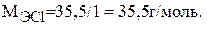
Тогда молярная масса эквивалента будет равна:
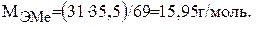
Пример 5.
Сколько граммов цинка вступило в реакцию с кислотой, если при этом выделилось 2,8 л водорода при н.у. ?
Так как одно из веществ взято в газообразном состоянии, то закон эквивалентов запишется:
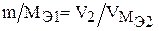
где 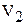 - объем газообразного вещества, л или мл;
- объем газообразного вещества, л или мл; 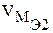 – объем одного моля эквивалента газообразного вещества, л.
– объем одного моля эквивалента газообразного вещества, л.
Запишем закон эквивалентов для данной задачи:
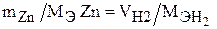
Молярную массу эквивалента цинка находим по формуле (1):
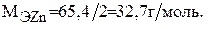
Объем, занимаемый эквивалентом водорода находящегося в газообразном состоянии при н.у., равен 11,2 л.
Тогда:
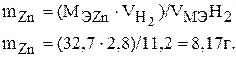
Пример 6.
Какой объем занимает один моль эквивалентов кислорода при н.у.?
Молярная масса эквивалента кислорода по формуле (1) равна:
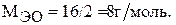
Известно, что один моль кислорода  имеет массу 32г/моль и занимает объем при н.у. 22,4 л, тогда один моль эквивалентов
имеет массу 32г/моль и занимает объем при н.у. 22,4 л, тогда один моль эквивалентов  при н.у. будет занимать объем
при н.у. будет занимать объем 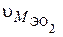 :
:
32г/моль 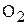 – 22,4л
– 22,4л
8г/моль 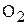 –
– 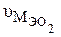
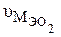 =(8×22,4)/32=5,6л
=(8×22,4)/32=5,6л
Контрольные задания
1. Один грамм четырехвалентного металла соединяется с 0,27 г кислорода. Вычислите атомную массу металла.
2. Два грамма двухвалентного металла вытесняют 1,12 л водорода при н.у. Вычислите молярную массу эквивалента металла и его атомную массу.
3. Чему равна молярная масса эквивалента фосфорной кислоты в реакции
H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O ?
4. Чему равна молярная масса эквивалента Вa(OH)2 в реакции
Ва(ОН)2 + Н2SO4 = BaSO4 + 2H2O ?
5. Какой объем водорода выделится при взаимодействии 3,25 г цинка с соляной кислотой при н.у. ?
6. Чему равна молярная масса эквивалента железа в оксиде железа, если известно, что 80 г Fe2O3 содержат 56 г железа ?
7. Определите молярную массу эквивалента кадмия, если известно, что при растворении 10 г кадмия в соляной кислоте выделяется 2 л водорода при н.у.
8. В каком количестве NaOH содержится столько же молей эквивалентов, сколько в 168 г КОН ?
9. 0,934 г металла вытеснили из кислоты 348 мл водорода при н.у. Определите молярную массу эквивалента металла.
10. Какой объем водорода потребуется для реакции с 5,6 л кислорода при получении воды при н.у.?
2. СТРОЕНИЕ АТОМА. ПЕРИОДИЧЕСКАЯ СИСТЕМА
Д. И. МЕНДЕЛЕЕВА
Примеры решения задач
Пример 1.
Напишите полные электронные формулы и сокращенные элементов с порядковыми номерами 11, 17 и 23. Определите валентность этих элементов в нормальном и возбужденном состояниях.
Элемент с порядковым номером 11 – натрий. Натрий располагается в третьем периоде в первой группе, главная подгруппа. Он относится к  –
–
элементам. Порядковый номер показывает величину положительного заряда ядра и число электронов в оболочке атома. В атоме натрия 11 электронов и величина заряда ядра (+11).
Полная электронная формула натрия будет:
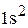
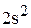
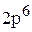
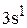 .
.
В сокращенную электронную формулу элемента входят подуровни с валентными электронами. Для s– элементов сокращенная электронная формула в общем, виде:
… 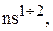
где n – номер внешнего уровня или номер периода, в котором находится элемент.
Для натрия сокращенная электронная формула будет:
… 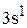 .
.
Сокращенная электронная формула в виде квантовых ячеек имеет вид:
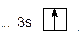
Валентность элемента определяется числом неспаренных электронов, находящихся на внешнем энергетическом уровне. Так как на внешнем энергетическом уровне в атоме натрий находится один электрон, его валентность равна 1.
 Переменная валентность возможна в случае, когда на внешнем уровне атома имеются спаренные электроны, которые могут разъединяться и переходить на другие подуровни и свободные атомные орбитали. Но этот переход возможен только в пределах одного квантового уровня
Переменная валентность возможна в случае, когда на внешнем уровне атома имеются спаренные электроны, которые могут разъединяться и переходить на другие подуровни и свободные атомные орбитали. Но этот переход возможен только в пределах одного квантового уровня
В атоме натрия на внешнем уровне нет спаренных электронов, поэтому у него возможно только одно валентное состояние.
Элемент с порядковым номером 17 – хлор. Хлор располагается в 3 периоде, 7 группе, главной подгруппе. Относится к р – элементам. Заряд ядра атома (+17) и в оболочке атома 17 электрона.
Полная электронная формула хлора:
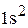
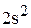
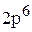
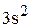
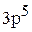 .
.
Сокращенная электронная формула для 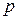 – элементов:
– элементов:
… 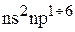 ,
,
где n – номер внешнего уровня или номер периода, в котором находится элемент.
Для хлора сокращенная электронная формула будет:
… 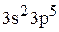 .
.
Сокращенная электронная формула хлора в виде квантовых ячеек имеет вид:
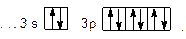
Так как на внешнем энергетическом уровне атома хлора в нормальном состоянии имеется один неспаренный электрон, то его валентность в этом состоянии равна 1.
При возбуждении атома спаренные электроны 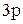 – подуровня разъединяются и переходят на свободный
– подуровня разъединяются и переходят на свободный 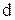 – подуровень третьего энергетического уровня:
– подуровень третьего энергетического уровня:
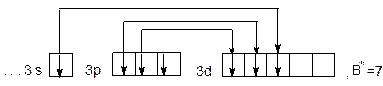
Число неспаренных электронов на внешнем уровне увеличивается до 7. Валентность хлора в возбужденном состоянии максимально равна 7.
Элемент с порядковым номером 23 – ванадий. Ванадий располагается в 4 периоде, 5 группе, побочной подгруппе. Относится к 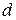 – элементам. Заряд ядра атома ванадия (+23), число электронов в оболочке – 17.
– элементам. Заряд ядра атома ванадия (+23), число электронов в оболочке – 17.
Полная электронная формула ванадия:
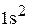
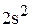
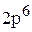
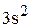
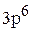
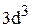
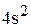 .
.
Сокращенная электронная формула 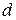 – элементов в общем, виде:
– элементов в общем, виде:
… 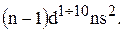
Для ванадия будет:
… 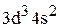 .
.
Сокращенная электронная формула ванадия в виде квантовых ячеек:
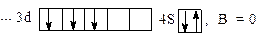
Так как на внешнем 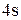 – подуровне в нормальном состоянии нет неспаренных электронов, валентность ванадия будет равна 0.
– подуровне в нормальном состоянии нет неспаренных электронов, валентность ванадия будет равна 0.
При возбуждении атома происходит разъединение внешних спаренных 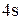 – электронов, один из которых перейдет на свободный 4р – подуровень (так как распаривание электронов возможно только в пределах одного энергетического уровня и на
– электронов, один из которых перейдет на свободный 4р – подуровень (так как распаривание электронов возможно только в пределах одного энергетического уровня и на 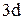 – подуровень электрон не сможет перейти, т.к. это другой уровень):
– подуровень электрон не сможет перейти, т.к. это другой уровень):
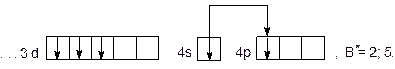
Валентность ванадия в возбужденном состоянии будет равна 2, и максимальная валентность – 5.
Контрольные задания
11. Сколько протонов, нейтронов и электронов содержится в атомах элементов с порядковыми номерами 34 и 47? Напишите их полные электронные формулы. Укажите валентные электроны, число неспаренных электронов.
12. Напишите электронные формулы атомов элементов с порядковыми номерами 48 и 80. Укажите их положение в периодической системе: период, группа, подгруппа.
Дайте определение понятию "изотоп".
13. Напишите электронные формулы атомов элементов с порядковыми номерами 19, 28, 62. К какому типу (s-, p-, d-, f-) относятся эти элементы?
Сколько p-орбиталей возможно для данного значения главного квантового числа n и почему?
14. Напишите электронные формулы атомов хлора и марганца. Являются ли они электронными аналогами? Укажите их валентные электроны. К какому типу элементов (s-, p-, d-, f-) они относятся?
15. Укажите порядковые номера элементов, электронная формула которых имеет окончание ...ns1. Напишите полную электронную формулу элемента шестого периода (n=6).
16. Для элементов с порядковыми номерами 13 и 42 укажите число протонов, нейтронов и электронов. Напишите электронные формулы, укажите валентные электроны, число неспаренных электронов. К каким элементам (s-, p-, d- или f-) они относятся? Укажите их положение в периодической системе: период, группа, подгруппа.
17. Для атомов элементов с порядковыми номерами 20, 40 и 52 укажите число протонов, нейтронов и электронов. Напишите электронные формулы этих элементов, укажите валентные электроны.
Какие орбитали заполняются раньше: 5s или 4d и почему?
18. Напишите электронные формулы атомов с порядковыми номерами 12, 36 и 44. Укажите валентные электроны. К какому типу (s-, p-, d-, f-) относятся эти элементы?
19. Напишите электронные формулы атомов серы и хрома. Являются ли они электронными аналогами? Укажите их валентные электроны. К какому типу элементов (s-, p-, d-, f-) они относятся?
20. Укажите порядковые номера элементов, электронная формула которых имеет окончание ...ns2np3. Напишите полную электронную формулу элемента четвертого периода (n=4). Сформулируйте правило Гунда и объясните его на примере электронных формул рассмотренных выше элементов.
21. Напишите электронную формулу атомов элемента с порядковым номером 35. Укажите его электронные аналоги и запишите их сокращенные электронные формулы в общем виде.
Приведите современную формулировку периодического закона Д.И.Менделеева.
22. Назовите элементы, имеющие по два электрона на подуровнях: а) 4p; б) 4d; в) 4f. Напишите электронные формулы атомов этих элементов и укажите их положение в периодической системе: период, группа, подгруппа.
23. Укажите порядковый номер элемента, в атоме которого завер-шается заполнение электронами третьего квантового уровня. Напишите его электронную формулу.
Cформулируйте принцип Паули.
24. Напишите электронные формулы элементов второго периода. Укажите валентные электроны.
Что такое степень окисления атома и как степень окисления связана с номером группы, в которой находится тот или иной элемент?
25. Укажите порядковый номер элемента с окончанием электронной формулы ...6s26p3. Назовите для него элемент, являющийся электронным аналогом.
26. Назовите элементы, имеющие по одному электрону на подуровне: а) 3d; б) 4d; в) 5р. Напишите электронные формулы атомов этих элементов и укажите их положение в периодической системе: период, группа, подгруппа.
Могут ли d-электроны находиться на втором энергетическом уровне? Дайте пояснение.
27. Назовите элементы 4-го периода, атомы которых содержат наибольшее число неспаренных d-электронов. Напишите их электронные формулы.
Сформулируйте правила Клечковского и покажите их выполнение на примере элементов 4-го периода.
28. Укажите порядковый номер элемента, электронная формула которого имеет окончание ...5s25p5. Напишите его полную электронную формулу.
Могут ли f-электроны находиться на третьем энергетическом уровне? Дайте пояснение.
29. Напишите электронные формулы двух р-элементов 5-го периода: с одним неспаренным электроном и двумя неспаренными электронами. Назовите их порядковые номера, число протонов и нейтронов в их атомах.
Дайте объяснение понятию "электронной орбитали".
30. Укажите порядковый номер элемента, в атоме которого завер-шается заполнение электронами четвертого квантового уровня. Сколько подуровней включает четвертый квантовый уровень? Какое максимальное число электронов может находиться на четвертом энергетическом уровне? Ответ поясните.
ХИМИЧЕСКАЯ СВЯЗЬ
Примеры решения задач
Пример 1.
Постройте и охарактеризуйте молекулу BeCl2.
Запишем сокращенные электронные формулы элементов, из которых состоит данная молекула.
Be … 2s2;  Cl …
Cl … 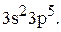
По электронной формуле в виде квантовых ячеек определим валентности элементов в нормальном состоянии:
Be…2s  , ВBe = 0;
, ВBe = 0; 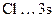

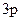


 , ВCl = 1.
, ВCl = 1.
В нормальном состоянии валентность ,бериллия равна 0, поэтому он не может взаимодействовать с хлором, валентность которого равна 1.
Необходимо перевести магний в возбужденное двух – валентное состояние:
Be*…3s 
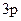


 , ВBe* = 2.
, ВBe* = 2.
В возбужденном состоянии в атоме бериллия в образовании связи с хлором будут одновременно участвовать 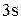 – и
– и 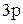 – электроны, в результате чего произойдет их взаимное смешение, т.е. гибридизация. Из двух простых электронных облаков образуются два гибридных с выровненной электронной плотностью. Данный тип гибридизации (из одного s– электронного облака и одного
– электроны, в результате чего произойдет их взаимное смешение, т.е. гибридизация. Из двух простых электронных облаков образуются два гибридных с выровненной электронной плотностью. Данный тип гибридизации (из одного s– электронного облака и одного 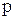 – электронного облака) называется
– электронного облака) называется 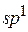 – гибридизацией. Графически эти электронные облака будут иметь вид:
– гибридизацией. Графически эти электронные облака будут иметь вид:

С 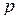 – электронами хлора будут перекрываться гибридные электронные облака магния, валентный угол между которыми 1800:
– электронами хлора будут перекрываться гибридные электронные облака магния, валентный угол между которыми 1800:

Характеристика молекулы. Молекула BeCl2 – линейная, так как угол между связями 1800. Связь между, бериллием и хлором полярна, так как это атомы с разной электроотрицательностью, и общая электронная пара смещена в сторону более электроотрицательного хлора. Молекула в целом неполярна, так как симметрична.
По типу перекрывания электронных облаков – это 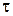 – перекрывание, так как происходит вдоль линии, соединяющей ядра атомов
– перекрывание, так как происходит вдоль линии, соединяющей ядра атомов
Пример 2.
Постройте и охарактеризуйте молекулу 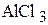 .
.
Запишем сокращенные формулы алюминия и хлора:
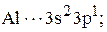
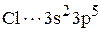
По электронной формуле в виде квантовых ячеек определяем валентности алюминия и хлора.
Al 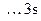

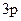


 , ВAl = 1; Cl
, ВAl = 1; Cl 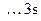

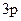


 , ВCl = 1.
, ВCl = 1.
Для образования соединения 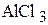 необходимо перевести атом алюминия в возбужденное трехвалентное состояние:
необходимо перевести атом алюминия в возбужденное трехвалентное состояние:
Al* 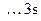

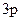


 , ВAl = 3.
, ВAl = 3.
При этом в атоме алюминия произойдет 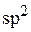 – гибридизация, так как в образовании связи с хлором будут одновременно участвовать один
– гибридизация, так как в образовании связи с хлором будут одновременно участвовать один 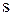 – электрон и два p– электрона. В результате образуется три гибридных облака под углом 1200.
– электрон и два p– электрона. В результате образуется три гибридных облака под углом 1200.

Произошел переход Al 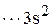
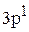 в Al*
в Al* 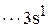
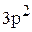 .
.
В образовании связи с 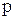
 – электронами хлора будут участвовать гибридные облака алюминия:
– электронами хлора будут участвовать гибридные облака алюминия:
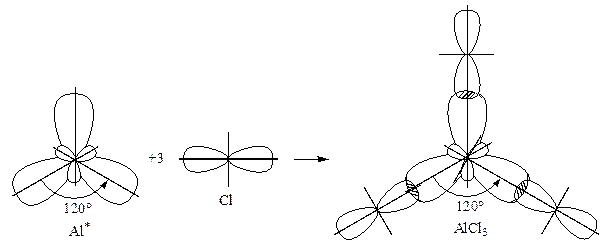
Характеристика молекулы. Молекулы 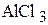 – это плоский треугольник, с углом между связями 1200.
– это плоский треугольник, с углом между связями 1200.
Тип перекрывания электронных облаков – 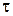 перекрывание, так как происходит по линии, соединяющей ядра атомов. Связь между алюминием и хлором полярна, так как это элементы с разной электроотрицательностью и область взаимного перекрывания электронных облаков смещена в сторону более электроотрицательного хлора. Молекула в целом неполярна, так как симметрична.
перекрывание, так как происходит по линии, соединяющей ядра атомов. Связь между алюминием и хлором полярна, так как это элементы с разной электроотрицательностью и область взаимного перекрывания электронных облаков смещена в сторону более электроотрицательного хлора. Молекула в целом неполярна, так как симметрична.
Пример 3.
Постройте и охарактеризуйте молекулу 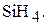
Запишем сокращенные формулы кремния и водорода:

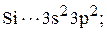
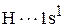 .
.
Определяем валентности кремния и водорода:
Si 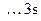

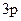


 , ВSi = 2; H
, ВSi = 2; H 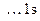
 , ВH = 1.
, ВH = 1.
Для образования соединения 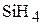 необходимо перевести атом кремния в возбужденное четырехвалентное состояния:
необходимо перевести атом кремния в возбужденное четырехвалентное состояния:
Si 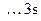

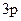


 , ВSi = 4.
, ВSi = 4.
При этом в атоме кремния происходит 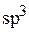 – гибридизация (смешение одного
– гибридизация (смешение одного 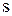 – и трех
– и трех 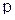 – электронов), в результате образуются четыре гибридных облака под углом 109°.
– электронов), в результате образуются четыре гибридных облака под углом 109°.

В образовании связи с s– электронами водорода будут участвовать гибридные облака кремния:
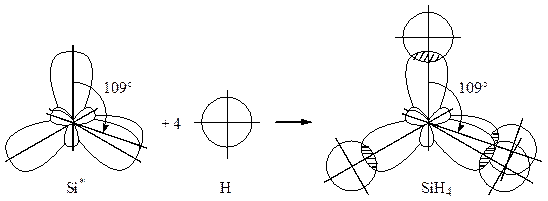
Характеристика молекулы.
Молекула 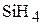 – тетраэдрическая пирамида с углом между связями 1090. Тип перекрывания электронных облаков –
– тетраэдрическая пирамида с углом между связями 1090. Тип перекрывания электронных облаков – 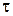 – перекрывание. Связь между кремнием и водородом полярна, так как это элементы с разной электроотрицательностью, общая электронная пара смещена в сторону водорода. Молекула в целом неполярная, так как симметрична.
– перекрывание. Связь между кремнием и водородом полярна, так как это элементы с разной электроотрицательностью, общая электронная пара смещена в сторону водорода. Молекула в целом неполярная, так как симметрична.
Контрольные задания
31. Какая химическая связь называется ионной? Каков механизм ее образования? Приведите примеры соединений с ионной связью.
32. Какую химическую связь называют ковалентной? Приведите примеры соединений с полярной и неполярной ковалентной связью.
33. Объясните механизм образования молекулы O2 по методу валентных связей и молекулярных орбиталей.
34. Опишите с позиций метода валентных связей электронное строение молекулы BF3.
35. Опишите электронное строение молекулы Н2О в рамках метода валентных связей.
36. Опишите химическую связь в молекуле F2 в рамках метода молекулярных орбиталей.
37. Покажите перекрывание атомных орбиталей и охарактеризуйте химические связи в молекуле метана СН4 с позиций теории валентных связей. Полярна ли молекула СН4?
38. Опишите основные свойства ковалентной связи. Почему молекула BeF2 неполярна?
39. Опишите донорно-акцепторный механизм образования химической связи. Приведите примеры.
40. Как метод молекулярных орбиталей объясняет парамагнетизм молекулы О2?
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Примеры решения задач
Тепловым эффектом химической реакции называется изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакого другого работы, кроме работы расширение.
Если в результате реакции теплота выделяется, т.е. энтальпия реакции понижается (D Н< 0),то реакция называется экзотермической. Реакция, протекающая с поглощением теплоты, т.е. с повышением энтальпии (D Н> 0), называется эндотермической.
Тепловые эффекты реакции рассчитывают по следствию из закона Гесса на основании стандартных теплот образования энтальпий веществ – D Н0 298 образования вещества. Стандартные теплоты образования простых веществ равны нулю.
Следствие из закона Гесса: тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ, взятых с учетом их стехиометрических коэффициентов.
По следствию из закона Гесса можно рассчитывать и другие термодинамические функции: энтальпию, энтропию, энергию Гиббса.
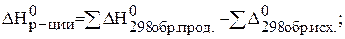
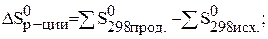
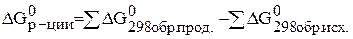
Критерием самопроизвольного протекания процесса является изобарно–изотермический потенциал или энергия Гиббса, которую можно рассчитать по формуле (через энтальпию и энтропию):
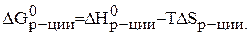
В изобарно–изотермических условиях самопроизвольно протекают процессы с уменьшением энергии Гиббса:
D G<0.
Состояния равновесия  системы достигается при D G = 0, т.е.
системы достигается при D G = 0, т.е.
0 = DН–Т D S. Из этого уравнения можно найти температуру, при которой наступает состояния равновесия:
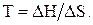
Все стандартные значения термодинамических функций приведены в справочных таблицах 1, 2, 3.
Пример 1.
Вычислите тепловой эффект реакции :
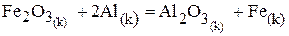
при 298 К и постоянная давлении.
На основании следствия из закона Гесса и табличных данных стандартных энтальпий 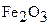 и
и 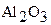 учитывая, что энтальпия простых веществ (Al и Fe) равны нулю, составляем уравнение:
учитывая, что энтальпия простых веществ (Al и Fe) равны нулю, составляем уравнение:

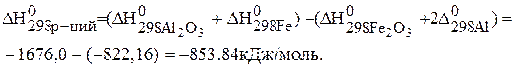
Данная реакция является экзотермическая, так как 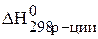 < 0, т.е. протекает с выделением тепла.
< 0, т.е. протекает с выделением тепла.
Пример 2.
Вычислите изменения энтропии в газообразной системе в результате протекания реакции CH4(г)+H2O = CO(г)+ 3H2(г) при 298 К и постоянном давлении.
По следствию из закона Гесса можно записать:

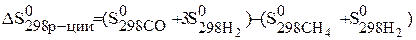
Значения стандартных энтропий находим в таблице и подставляем в уравнение и рассчитываем энтропию реакцию:
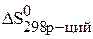 = (197,54+ 3×130,58)–(186,19+188,7)= 214,39 Дж/к × моль.
= (197,54+ 3×130,58)–(186,19+188,7)= 214,39 Дж/к × моль.
Пример 3.
Определите температуру Т, при которой установится равновесие реакции 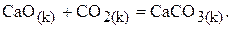
Определяем величины изменения энтальпии и энтропии реакции:
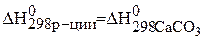 –
– 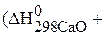
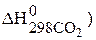 ,
,
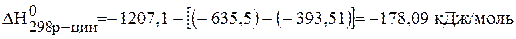 ;
;
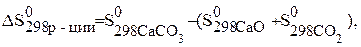
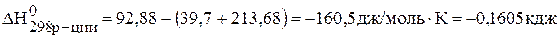
В состоянии равновесия 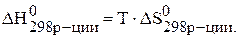 .
.
Тогда температура будет равна:
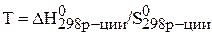 .
.
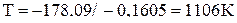 .
.
Пример 4.
В каком направлении при стандартных условиях может самопроизвольно протекать реакция 3 SO2 (г) « S(ромб) + 2SO3 (г)?
Изменение энергии Гиббса реакции определяют по уравнению:
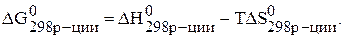
Температура Т – абсолютная температура (для стандартных условий Т=298 К). Энтальпию и энтропию реакции рассчитывают по следствию из закона Гесса: 
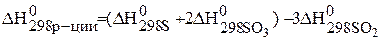
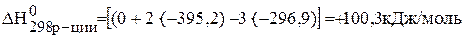
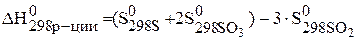
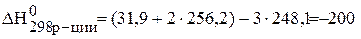 Дж/моль×К=0,200кДж/моль×К.
Дж/моль×К=0,200кДж/моль×К.
Рассчитываем энергию Гиббса реакции:
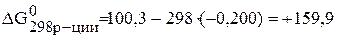 кДж/моль.
кДж/моль.
Так как 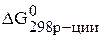 > 0,то данная реакция самопроизвольно может протекать в обратном направлении.
> 0,то данная реакция самопроизвольно может протекать в обратном направлении.
Пример 5.
Возможно, ли самопроизвольно протекание реакции 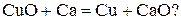
Записываем энергию Гиббса по следствию из закона Гесса:

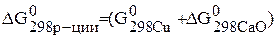 –
– 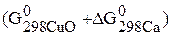
Подставляем конкретные значения в уравнения с учетом, что энергия Гиббса простых веществ равны нулю.

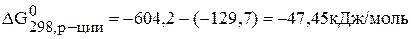 .
.
Так как – 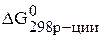 < 0, то самопроизвольное протекание данной реакции возможно.
< 0, то самопроизвольное протекание данной реакции возможно.
Контрольные задания
41*. Исходя из теплоты образования H2O(ж) и теплового эффекта реакции при стандартных условиях
Н2O2(ж) = H2O(ж) + 1/2 O2(г) ; H = 97,9 кДж,
вычислите 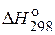 перекиси водорода Н2О2.
перекиси водорода Н2О2.
Таблица 1. Стандартные теплоты (энтальпии) образования 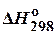 некоторых веществ
некоторых веществ
| Вещест- во | Состояние | 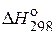 ,
кДж/моль ,
кДж/моль
| Вещест- во | Состояние | 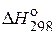 ,
кДж/моль ,
кДж/моль
| |
| Al2O3 | к (кристалли-ческое) | 1674 | CaO | к | 635,1 | |
| CO | г (газообразное) | 110,5 | CaCO3 | к | 1206 | |
| CO2 | г | 396,3 | FeO | к | 263,7 | |
| CH4 | г | 74,85 | H2O | ж (жидкое) | 285,84 | |
| С2H2 | г | 226,75 | H2O | г | 241,84 | |
| С2H6 | г | 84,67 | H2S | г | 20,15 | |
| СS2 | г | 115,3 | MgO | к | 601,2 | |
| SO2 | г | 296,9 | Fe2O3 | к | 821,3 |
42*. При сгорании газообразного этана С2Н6 образуются CO2(г) и Н2О(ж). Напишите термохимическое уравнение этой реакции и вычислите ее тепловой эффект.
43*. Сожжены с образованием Н2О(г) равные объемы водорода и ацетилена С2Н2, взятые при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз?
44*. Вычислите тепловой эффект реакции при стандартных условиях 2Mg(к)+ CO2(г) = 2MgO(к)+ C(графит).
45*. Вычислите тепловой эффект реакции восстановления оксида цинка углем с образованием СО, если теплота образования ZnO(к) при стандартных условиях равна 348 кДж/моль.
46*. Исходя из теплоты образования газообразного диоксида углерода ( 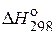 = 396,3 кДж/моль) и термохимического уравнения
= 396,3 кДж/моль) и термохимического уравнения
C(графит) + 2N2О(г) = CO2(г) + 2N2(г) ; Н = 557,5 кДж
вычислите теплоту образования N2O(г).
47*. При взаимодействии газообразных метана СН4 и сероводорода Н2S образуются сероуглерод СS2(г) и водород. Напишите термохимическое уравнение этой реакции и вычислите ее тепловой эффект при стандартных условиях.
48*. Исходя из уравнения реакции
СН3ОН(ж) + 3/2 О2(г) = CO2(г) + 2H2O(ж); Н= 726,5 кДж
вычислите стандартную теплоту образования метилового спирта СН3ОН(ж).
49. Исходя из реакции
SiO2 + 2Mg = 2MgO + Si; Н= 372 кДж
вычислите стандартную теплоту образования SiO2(к), если стандартная теплота образования MgO(к) равна 601,2 кДж/моль.
50*. Вычислите теплоту образования СаС2(к) исходя из стандартных теплот образования СаО(к) и СО(г) и стандартного теплового эффекта реакции СаО(к) + 3С(к) = СаС2(к) + СО(г) ; Н = 460 кДж.
51*. Восстановление Fe2O3 водородом протекает по уравнению
Fe2O3(к) + 3Н2(г) = Fe(к) + 3Н2О(г) ; Н= 96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии S = 0,1387 кДж/(мольК)?
52**. Рассчитайте значение 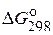 реакции
реакции
Pb(к) + CuO(к) = PbO(к) + Cu(к)
и установите, в каком направлении она может протекать самопроизвольно при стандартных условиях.
53**. Укажите, какая из двух реакций будет протекать самопроиз-вольно при стандартных условиях:
Fe(к) + Al2O3(к) = Al(к) + Fe2O3(к);
Al(к) + Fe2O3(к) = Fe(к) + Al2O3(к).
Ответ подтвердите расчетом.
54**. Установите возможность (или невозможность) самопроиз- вольного протекания реакции
CuO(к) + Н2(г) = Cu(к) + H2O(ж)
при стандартных условиях. Ответ подтвердите расчетом.
Таблица 2. Стандартные энергии Гиббса образования 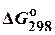 некоторых веществ
некоторых веществ
| Вещество | Состояние | 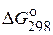 ,
кДж/моль ,
кДж/моль
| Вещество | Состояние | 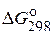 ,
кДж/моль ,
кДж/моль
| |
| Al2O3 | к | –1580 | Fe2O3 | к | –741,5 | |
| BaCO3 | к | –528,4 | H2O | ж | –237,2 | |
| BaO | к | –1139 | H2O | г | –228,4 | |
| CO2 | г | –394,4 | NH3 | г | –16,7 | |
| CuO | к | –127,0 | NO2 | г | –51,8 | |
| H2S | г | –33,3 | PbO | к | –188,5 | |
| SO2 | г | –300,4 | FeO | к | –244,3 |
55**. Определите возможность или невозможность самопроизвольного протекания реакции
4NН3(г) + 5О2(г) = 4NО2(г) + 6H2O(г)
при стандартных условиях. Ответ подтвердите расчетом.
56**. Определите, какая из реакций
BaO(к) + CO2(г) = BaCO3(к);
BaCO3(к) = BaO(к) + CO2(г)
термодинамически возможна при стандартных условиях. Ответ подтвердите расчетом.
57. На основании стандартных теплот образования * и стандартных энтропий соответствующих веществ *** вычислите 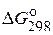 реакции, протекающей по уравнению
реакции, протекающей по уравнению
CO(г) + H2O(ж) = CO2(г) + H2(г).
58. Вычислите 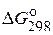 для реакции
для реакции
СаСО3(к) = СаО(к) + CO2(г)
при 25, 500 и 1500 С. Зависимостью 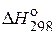 * и
* и 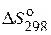 *** от температуры пренебречь. Сделайте вывод о возможности протекания реакции при указанных температурах.
*** от температуры пренебречь. Сделайте вывод о возможности протекания реакции при указанных температурах.
Таблица 3. Стандартные абсолютные энтропии 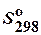 некоторых веществ
некоторых веществ
| Вещество | Состоя-ние | 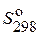 ,
Дж/(моль·К) ,
Дж/(моль·К)
| Вещество | Состоя-ние | 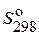 ,
Дж/(моль·К) ,
Дж/(моль·К)
| |
| CO | г | 197,4 | CaCO3 | к | 92,90 | |
| CO2 | г | 213,6 | H2 | г | 130,6 | |
| CaO | к | 39,70 | H2O | ж | 70,1 |
59*. Вычислите 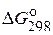 реакции и определите принципиальную возможность или невозможность осуществления при стандартных условиях реакции
реакции и определите принципиальную возможность или невозможность осуществления при стандартных условиях реакции
SO2(г) + 2H2S(г) = 3S(к) + 2H2O(ж).
60*. Можно ли оксид железа FeO восстановить алюминием при стандартных условиях? Ответ подтвердите расчетом.
ХИМИЧЕСКАЯ КИНЕТИКА
Примеры решения задач
Химическая кинетика изучает скорости химических реакций и механизмы их протекания, а также факторы, влияющие на них.
Скорость химической реакции равна изменению количества вещества в единицу времени в единице объема реакционного пространства:
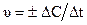 ,
,
где D С – изменение молярного концентрации, D t – промежуток времени.
Единицы измерения скорости (моль/л × с).
Скорость химической реакции зависит от природы реагирующих веществ, концентрации реагентов, температуры, давления, присутствия катализатора.
Дата: 2018-11-18, просмотров: 783.