| Окислительное фосфорилирование, коэффициент Р/О
Фосфорилирование ADP – это синтез АТР (суть процесса рассматривалась ранее).
Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТР. Электроны от FAD-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуется только 2 молекулы АТР.
Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование ADP, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают как Р/О.
Для NADH Р/О = 3, для сукцината Р/О = 2. Эти величины отражают теоретический максимум синтеза АТР, фактически эта величина меньше.
Дыхательный контроль
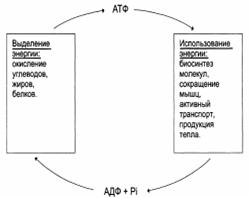
Общее содержание АТР в организме 30-50 г, но каждая молекула АТР в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40-60 кг АТР и столько же распадается.
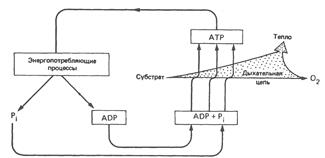
Скорость дыхания митохондрий может контролироваться концентрацией ADP. Это обусловлено тем, что окисление и фосфорилирование жестко сопряжены, т.е. функционирование дыхательной цепи не может осуществляться, если оно не сопровождается фосфорилированием ADP. Чане и Уильяме предложили рассматривать 5 состояний, при которых скорость дыхания митохондрий лимитируется определенными факторами (таблица → → → →).
Обычно большая часть клеток, находящихся в покоящемся состоянии, пребывает в состоянии 4, при котором скорость дыхания определяется доступностью ADP. Энергия, необходимая для совершения работы, поставляется за счет превращения АТР в ADP; в результате создаются условия для увеличения скорости дыхания, что в свою очередь приводит к восполнению запасов АТР (рисунок → → → →).
Очевидно, что при определенных условиях на скорость работы дыхательной цепи может влиять и концентрация неорганического фосфата. При повышении
скорости дыхания (вызванном, например, физической работой) клетка приближается к состоянию 3 или состоянию 5: либо исчерпываются возможности дыхательной цепи, либо величина Ро опускается ниже значения Км для цитохрома а3 Скорость-лимитирующим фактором может оказаться ATP/ADP-транслокатор, обеспечивающий поступление ADP из цитозоля в митохондрии.
Таким образом, механизм, с помощью которого улавливается свободная энергия окисления пищевых продуктов, является ступенчатым, эффективным (40-45%) и регулируемым, а не взрывоподобным, неэффективным и неконтролируемым. Часть свободной энергии, которая не улавливается в форме высокоэнергетических фосфатов, освобождается в форме теплоты. Это совсем не означает, что она пропадает напрасно – у теплокровных животных она используется для поддержания температуры тела.
Ингибиторы дыхательной цепи и разобщители с окислительным фосфорилированием
Значительная информация о дыхательной цепи была получена при использовании различных ингибиторов; предполагаемые места их действия показаны на рисунке. Ингибиторы можно разделить на 3 группы: 1) ингибиторы собственно дыхательной цепи, 2) ингибиторы окислительного фосфорилирования, 3) разобщители окислительного фосфорилирования.
Ингибиторы, блокирующие дыхательную цепь, по-видимому, действуют в трех местах. Одно из них ингибируется барбитуратами (например, амобарбиталом), а также антибиотиком пиерицидином А и ротеноном. Эти ингибиторы препятствуют окислению субстратов, которые поставляют восстановительные эквиваленты в дыхательную цепь при участии NAD-зависимых дегидрогеназ, примером таких субстратов является гидроксибутират.
Димеркапрол и антимицин А ингибируют дыхательную цепь на участке между цитохромом b и цитохромом с. Классические яды – H2S, окись углерода и цианид – ингибируют цитохромоксидазу. Карбоксин и TTFA (теноилтрифторацегон) специфически ингибируют переход восстановительных эквивалентов от сукцинатдегидрогеназы на кофермент Q, а малонат является конкурентным ингибитором сукцинатдегидрогеназы. Антибиотик олигомицин полностью блокирует окисление и фосфорилирование в интактных митохондриях. Однако если вместе с олигомицином добавить к системе разобщитель динитрофенол, то окисление протекает, но без фосфорилирования. Это означает, что олигомицин не действует непосредственно на дыхательную цепь, а подавляет стадию фосфорилирования.
Атрактилозид ингибирует окислительное фосфорилирование, блокируя транспорт адениновых нуклеотидов через внутреннюю митохондриальную мембрану. Он ингибирует транспорт ADP в митохондрии и выход АТР из митохондрий.
Разобщители нарушают систему сопряжения процессов окисления в дыхательной цепи и фосфорилирования. В этих условиях процесс дыхания происходит неконтролируемым образом, поскольку концентрации ADP или Р, не являются лимитирующими. Чаще всего в качестве разобщителя используют 2,4-динитрофенол. Аналогичное действие оказывает ряд других соединений: динитрокрезол, пентахлорфенол, СССР (карбонилцианид-м-хлорфенилгидразон). Последний по эффективности в 100 раз превосходит динитрофенол.
|
Состояния дыхательного контроля
 Роль ADP в дыхательном контроле
Роль ADP в дыхательном контроле
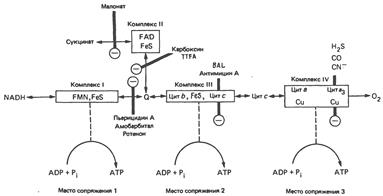 Предполагаемые участки ингибирования (Θ) дыхательной цепи специфическими лекарственными веществами, химическими реагентами и антибиотиками. Указаны участки, где предположительно происходит сопряжение с фосфорилированием. BAL – димеркапрол; TTFA – хелатобразующий реагент на железо. Комплекс I – NADH: убихинон-оксидоредуктаза; комплекс II – сукцинат: убихинон-оксидоредуктаза; комплекс III – убихинол: феррицитохром с-оксидоредуктаза; комплекс IV – ферроцитохром с: кислород-оксидоредуктаза. FeS – железо-серный белок; Q—убихинон.
АТФ-цикл и теплопродукция
Предполагаемые участки ингибирования (Θ) дыхательной цепи специфическими лекарственными веществами, химическими реагентами и антибиотиками. Указаны участки, где предположительно происходит сопряжение с фосфорилированием. BAL – димеркапрол; TTFA – хелатобразующий реагент на железо. Комплекс I – NADH: убихинон-оксидоредуктаза; комплекс II – сукцинат: убихинон-оксидоредуктаза; комплекс III – убихинол: феррицитохром с-оксидоредуктаза; комплекс IV – ферроцитохром с: кислород-оксидоредуктаза. FeS – железо-серный белок; Q—убихинон.
АТФ-цикл и теплопродукция
|
Образование токсичных форм кислорода в ЦПЭ
В ЦПЭ поглощается около 90 % поступающего в клетки О2. Остальная часть О2 используется в других окислительно-восстановительных реакциях. Ферменты, участвующие в окислительно-восстановительных реакциях с использованием кислорода, делятся на 2 группы: оксидазы и оксигеназы.
Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2.
Оксигеназы включают один (монооксигеназы) или два (диоксигеназы) атома кислорода в образующийся продукт реакции.
Хотя эти реакции не сопровождаются синтезом АТФ, они необходимы для многих специфических реакций в обмене аминокислот, синтезе жёлчных кислот и стероидов, в реакциях обезвреживания чужеродных веществ в печени.
В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
В невозбуждённом состоянии кислород не токсичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамически стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон.
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:
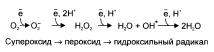 Супероксид, пероксид и гидроксильный радикал – активные окислители, что представляет серьёзную опасность для многих структур клетки.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции.
Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего при функционировании QН2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса («утечки») электронов с QН2 на кислород (рисунок → → → →)
Супероксид, пероксид и гидроксильный радикал – активные окислители, что представляет серьёзную опасность для многих структур клетки.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции.
Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего при функционировании QН2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса («утечки») электронов с QН2 на кислород (рисунок → → → →)
|
Повреждающее действие свободных радикалов на компоненты клетки
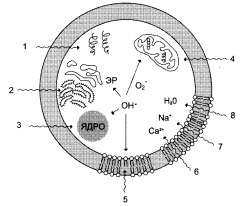 1 – разрушение белков; 2 – повреждение ЭПР; 3 – разрушение ядерной мембраны и повреждение ДНК; 4 – разрушение мембраны митохондрий; 5 – перекисное окисление липидов (ПОЛ) клеточной мембраны; 6,7,8 – проникновение в клетку воды и ионов.
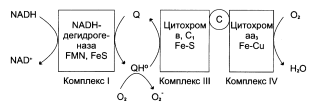
Образование супероксида в ЦПЭ
«Утечка» электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-радикал семихинона. Этот радикал неферментативно взаимодействует с О2 с образованием супероксидного радикала.
1 – разрушение белков; 2 – повреждение ЭПР; 3 – разрушение ядерной мембраны и повреждение ДНК; 4 – разрушение мембраны митохондрий; 5 – перекисное окисление липидов (ПОЛ) клеточной мембраны; 6,7,8 – проникновение в клетку воды и ионов.
Образование супероксида в ЦПЭ
«Утечка» электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-радикал семихинона. Этот радикал неферментативно взаимодействует с О2 с образованием супероксидного радикала.
|
 Роль ADP в дыхательном контроле
Роль ADP в дыхательном контроле

 Предполагаемые участки ингибирования (Θ) дыхательной цепи специфическими лекарственными веществами, химическими реагентами и антибиотиками. Указаны участки, где предположительно происходит сопряжение с фосфорилированием. BAL – димеркапрол; TTFA – хелатобразующий реагент на железо. Комплекс I – NADH: убихинон-оксидоредуктаза; комплекс II – сукцинат: убихинон-оксидоредуктаза; комплекс III – убихинол: феррицитохром с-оксидоредуктаза; комплекс IV – ферроцитохром с: кислород-оксидоредуктаза. FeS – железо-серный белок; Q—убихинон.
АТФ-цикл и теплопродукция
Предполагаемые участки ингибирования (Θ) дыхательной цепи специфическими лекарственными веществами, химическими реагентами и антибиотиками. Указаны участки, где предположительно происходит сопряжение с фосфорилированием. BAL – димеркапрол; TTFA – хелатобразующий реагент на железо. Комплекс I – NADH: убихинон-оксидоредуктаза; комплекс II – сукцинат: убихинон-оксидоредуктаза; комплекс III – убихинол: феррицитохром с-оксидоредуктаза; комплекс IV – ферроцитохром с: кислород-оксидоредуктаза. FeS – железо-серный белок; Q—убихинон.
АТФ-цикл и теплопродукция

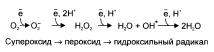 Супероксид, пероксид и гидроксильный радикал – активные окислители, что представляет серьёзную опасность для многих структур клетки.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции.
Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего при функционировании QН2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса («утечки») электронов с QН2 на кислород (рисунок → → → →)
Супероксид, пероксид и гидроксильный радикал – активные окислители, что представляет серьёзную опасность для многих структур клетки.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции.
Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего при функционировании QН2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса («утечки») электронов с QН2 на кислород (рисунок → → → →)
 1 – разрушение белков; 2 – повреждение ЭПР; 3 – разрушение ядерной мембраны и повреждение ДНК; 4 – разрушение мембраны митохондрий; 5 – перекисное окисление липидов (ПОЛ) клеточной мембраны; 6,7,8 – проникновение в клетку воды и ионов.
Образование супероксида в ЦПЭ
«Утечка» электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-радикал семихинона. Этот радикал неферментативно взаимодействует с О2 с образованием супероксидного радикала.
1 – разрушение белков; 2 – повреждение ЭПР; 3 – разрушение ядерной мембраны и повреждение ДНК; 4 – разрушение мембраны митохондрий; 5 – перекисное окисление липидов (ПОЛ) клеточной мембраны; 6,7,8 – проникновение в клетку воды и ионов.
Образование супероксида в ЦПЭ
«Утечка» электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-радикал семихинона. Этот радикал неферментативно взаимодействует с О2 с образованием супероксидного радикала.
