Потенц. энергия взаимод-я электрона с ядром обладает заданным 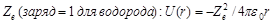 , где
, где 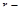 расстояние между электроном и ядром. Состояние электрона в атоме водорода описывается волновой ф-цией, удовл. ур-нию Шредингера:
расстояние между электроном и ядром. Состояние электрона в атоме водорода описывается волновой ф-цией, удовл. ур-нию Шредингера: 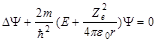 , где
, где 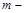 масса электрона в атоме, а
масса электрона в атоме, а 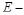 потенц. энергия электрона в атоме.
потенц. энергия электрона в атоме.
Т.к. электрон имеет 4 степени свободы, то для хар-ки его поведения в атоме требуется 4 квант-х числа: 1) главное квант. число –n, определяет энергетические уровни в атоме n=1,2,3…, чем больше n, тем слабее электрон связан с ядром 2) орбитальное квант. число l, определяет момент импульса электрона в атоме, 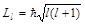 , l=0,1…(n-1)
, l=0,1…(n-1)
3) маг. квант. число 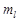 , определяет проекцию момента импульса электрона на заданное направление,
, определяет проекцию момента импульса электрона на заданное направление, 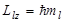 ,
, 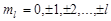 .
. 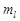 - характеризует ориентацию электронного облака в пр-ве.
- характеризует ориентацию электронного облака в пр-ве.
Квант. числа n, l характеризуют размер и форму электронного облака. В атомной ф-ке состояние электрона характеризующееся квант. числами l=0 - s-состояние, l=1-p -состояние, l=2 - d - состояние, l=3 - f-состояние. Значение главного квант. числа указ-ся перед обозначением орбит. квант. числа. Пример: n=2, l=0: 2s .
4) Спин электрона - квант. вел., это внутр. неотъемлемое св-во электрона. Спин квантуется по закону 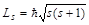 - это момент импульса (спин),
- это момент импульса (спин), 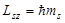 , где
, где 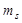 -маг. спиновое квант. число,
-маг. спиновое квант. число, 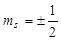 .
.
Периодическая система элементов:
Введем понятие порядкового номера Z хим. эл-та, z=числу протонов в ядре и соотв. общему числу электронов в электронной оболочке атома. Расположив хим. эл-ты в порядке возр. порядковых номеров получили периодичность в изменении хим. св-в эл-тов. Водород H-1s, гелий He-1  , литий Li-1
, литий Li-1  2
2 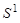 /…
/…
Следствие: открытая Менделеевым периодичность в хим. св-вах эл-тов, объясняется повторяемостью в структуре внешних оболочек у атомов родственных эл-тов. Во внешней оболочке щелочных металлов (литий, натрий, калий, рубидий, цезий, франций) имеет лишь 1 s-электрон во внешней оболочке; щелочно-земельных металлов (барий, радий, бериллий, магний, кальций); галоиды( фтор, хлор, бром, йод, астат) имеют внешние оболочки в к-ых не хватает одного электрона до оболочки энертного газа.
1s2s2p3s3p3d4s4p4d4f.
Атомное ядро. Хар-ки.
Ядро- центральная часть атома в которой сосредоточено практически вся масса атома и его и его положительный заряд. Все атомное ядро сост. из элемент. частиц: протонов и нейтронов, которые считаются двумя зарядовыми сост. одной частицы-нуклонов. Протон имеет положит.эл.заряд.=по абс.велич. заряду электронов, нейтрон не имеет эл. заряда. Заряд ядра- это величина 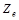 (e-величина заряда протона, z- порядковый номер хим.эл-та в период. сист.) равный числу протонов в ядре. Число нуклонов в ядре
(e-величина заряда протона, z- порядковый номер хим.эл-та в период. сист.) равный числу протонов в ядре. Число нуклонов в ядре 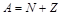 - массовое число. у нуклонов А=1,у электронов А=0. Ядра с одинаковым Z, но разным А, наз. изотопами. Ядра, которые при одинаковом А имеют разное Z наз. изобарами. Ядро хим.эл-та Х обозн.
- массовое число. у нуклонов А=1,у электронов А=0. Ядра с одинаковым Z, но разным А, наз. изотопами. Ядра, которые при одинаковом А имеют разное Z наз. изобарами. Ядро хим.эл-та Х обозн. 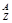 Х (символ хим. эл-та). Размер ядра хар-ся радиусом ядра. При образовании ядра происходит уменьшение его массы (масса ядра меньше чем сумма масс сост. его нуклонов, уменьш. массы ядра при его образ. объясняется выдел. энергии связи)
Х (символ хим. эл-та). Размер ядра хар-ся радиусом ядра. При образовании ядра происходит уменьшение его массы (масса ядра меньше чем сумма масс сост. его нуклонов, уменьш. массы ядра при его образ. объясняется выдел. энергии связи)
Ядерные силы- мощные силы протекающие внутри атом. ядер.(силы притяжения)
Св-ва:1. Короткодействующие. 2. Зарядовая независимость (яд. силы= между р и р, р и n, n и n). 3.Насыщение (Нуклон взаимод. только с огранич. числом ближайших к нему нуклонов), 4. завис. от взаимной ориентац. спинов. взаимод. нуклонов. 5. Не явл. центральными, т.е действ по линии.
Капельная модель ядра (Бор) первая модель ядра, основана на аналогии между поведением нуклонов в ядре и поведением молекул в капле жидкости.
Оболочечная модель- распределение нуклонов в ядре по дискретным энергетическим уровням.
Радиоактивность – это всякий стабилизированный процесс спонтанного распада с превращением его в др. ядра и частицы. Атомное ядро испытыв. радиоактив. распад назыв. материнским, а возник. ядро- дочерним. 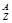 Х
Х 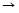
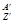 Y+
Y+ 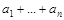 . Х-материн., Y- дочерние, а- прочие частицы.
. Х-материн., Y- дочерние, а- прочие частицы.
Основной закон радиоактив. распада: 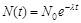 , где
, где 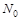 - нач. число нераспавшихся ядер в момент времени t=0,
- нач. число нераспавшихся ядер в момент времени t=0, 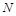 - число нераспав.ядер в момент времени t,
- число нераспав.ядер в момент времени t, 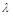 - постоянная радиоактив. распада.
- постоянная радиоактив. распада.
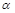 - распад – радиоактивное превращение ядер с испусканием
- распад – радиоактивное превращение ядер с испусканием 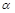 частиц (Не).
частиц (Не).
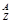 Х
Х 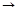
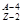 Y+
Y+ 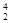 Не+Q возр.
Не+Q возр.
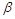 -распад: 1.
-распад: 1. 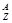 Х
Х 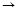
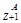 Y+
Y+ 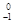 е +
е + 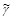 - электронный распад.
- электронный распад. 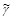 - антинейтрино.
- антинейтрино.
2. 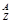 Х
Х 
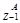 Y+
Y+ 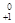 е +
е + 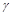 - позитронный распад .
- позитронный распад . 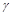 - нейтрино.
- нейтрино.
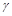 излучение – Эл.маг. излучения возникающие при переходе ядра из возбужденного в более низкие энергетические сост.
излучение – Эл.маг. излучения возникающие при переходе ядра из возбужденного в более низкие энергетические сост.
Дата: 2019-12-22, просмотров: 331.