В Периодическая система химических элементов
Предварительные знания
Расположение электронов в атомах (8.1А.)
Ряд активности металлов (8.2.А)
Данный раздел расширяет понимание учащихся о значении периодической таблицы и основных принципах химии, которые были освещены в материалах, изученных ранее. Рассматриваются вопросы о свойствах химических элементов и их соединений с позиции электронного строения, а также расположения данного химического элемента в периодической таблице. Эти знания представляют основу для понимания основ неорганической химии, которую они продолжат изучать в последующих разделах.
Языковые цели (по предмету) в этом разделе
Пример языковой цели по использованию соответствующего академического языка для учащихся представлен ниже.
Другие языковые цели учитель формулирует самостоятельно, используя руководство «Введение в языковые цели».
Краткий обзор
Учащиеся повторяют некоторые общие элементарные знания о структуре Периодической таблице, расположение в ней элементов и их электронное строение. Они продолжают расширять свои знания о структуре таблицы и закономерностях изменения свойств соединений элементов, вырабатывая общие правила и концепции.
| Ссылка в предметной программе | Цели обучения | Предлагаемая преподавательская деятельность | Заметки учителя | Ресурсы обучения |
| 9.2.1.1 знать распределение элементов в Периодической таблице; 9.2.1.2 объяснять физический смысл атомного номера, группы, периода 9.2.1.3 понимать, что элементы одной группы содержат на внешнем энергетическом уровне одинаковое количество электронов; 9.2.1.4 объяснять закономерности изменения химических свойств элементов и их соединений в группах и периодах | (К) (И) (О) Раздайте учащимся «скелетную» периодическую таблицу, цветные карандаши или фломастеры. Попросите их написать в них группы и периоды, символы металл и неметалл, указать номер группы, порядковые номера химических элементов. и т.д. (см.ссылку справа). Попросите их указать области таблицы, в которых содержатся металлы, неметаллы, твердые вещества , жидкости и газы и т.д. (У, К) Объясните учащимся, что замена атомной массы зарядом ядра была первым шагом в раскрытии физического смысла периодического закона. Задайте проблемный вопрос: почему появилась необходимость такой замены ( учащиеся должны привести примеры элементов, расположенных не по возрастанию атомных масс) ? Вместе с учащимися рассмотрите вопрос физического смысла понятия «атомный номер». Через ряд вопросов низкого и высокого уровня сложности. Например, Как вы понимаете понятие «Атомный номер»? Что он обозначает? Чему равен атомный номер водорода, кальция, серы, хлора и т.д. Как узнать количество протонов и электронов у атома фосфора, железа, цинка и т.д.? (К) Обсудите вопрос значения номера группы, периода с точки зрения строения атома. Учащиеся должны понять, что номер периода с точки зрения строения атома обозначает количество энергетических уровней или электронных оболочек. А номер группы обозначает число электронов на внешнем энергетическом уровне. (К) Раздайте учащимся копии периодической таблицы с указанными значениями электронных конфигураций атомов и попросите их посмотреть число электронов на внешней оболочке для каждого элемента. (К) (О) Спросите, какая возникает закономерность. Учащиеся должны увидеть, что количество электронов на внешней оболочке данного элемента равно номеру группы, в котором расположен этот элемент. (К) Попросите учащихся выделить желтым контуром в таблице 1-2 группу и подписать эти группы как s-блок. С 3 по 12 группу выделить зеленым цветом и это будет d-блок. С 13 по 18 группу выделить фиолетовым цветом и это будет p-блок. Лантаноиды выделить голубым цветом, актиноиды – красным. Подписать их как f-блок. (Г, К) Можно устроить «мозговой штурм» с химическими элементами. Переставьте группы периодической таблицы, и попросите их заполнить ячейки элементов названиями, которые они «штурмовали». Спросите, сколько электронов они имеют на внешней оболочке. (О ) Спросите, какую информацию они получили исходя из количества электронов. (У, К) Напомните учащимся, что химические свойства элементов и их соединений напрямую зависят от строения атома. В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет. (И) или (Г) Попросите учащихся на примере шестой группы (подгруппа кислорода) обсудить вопросы: - Как изменяется радиус атома в группе сверху вниз? \ -Какова сила притяжения электронов к ядру атома? - Как изменяется способность атомов отдавать и принимать электроны? - В каком случае элемент обладает металлическими свойствами? (И) (О) Попросите учащихся разработать правила закономерностей изменения химических свойств элементов и их соединений в группах. (К) (Г) или (И) Предложите учащимся на примере элементов второго периода (Li-Ne) ответить на следующие вопросы: - Как изменяются радиусы атомов химических элементов в периоде? - Что происходит с электронами последнего энергетического уровня? (К) Также учащиеся должны написать в тетрадях закономерность изменения химических свойств элементов и их соединений в периодах. (Г) или (И) Попросите учащихся определить «Короля Неметаллов» и «Короля Металлов» и объяснить свой выбор. (У, К) Акцентируйте внимание учащихся, что есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические свойства. Попросите учащихся выписать их в тетради: Zn, Cr, Al, Sn, Pb, Mn, Fe, Be. (О ) Попросите учащихся сделать надписи в копиях таблиц, в виде стрелочек указывающих закономерности: а) окислительных и неметаллических свойств в периодах; б) восстановительных и металлических свойств в периодах; в) восстановительных и металлических свойств в группах. Затем подвести итог: С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне. (О ) (И) Проведите проверочный тест по данной теме в виде различных видов активных форм обучения и дифференциации заданий. | Они должны указать каждый элемент в таблице. Убедитесь, что данную работу выполняет каждый учащийся.
Физический смысл атомного (порядкового номера )Z элемента в периодической системе элементов был установлен в ядерной модели атома Резерфорда: Z совпадает с числом положительных элементарных зарядов в ядре, закономерно возрастающих на единицу при переходе от предыдущего элемента к последующему.
Таблица должна быть длиннопериодная
(Г) Можно украсить лабораторию Постерами.
Помогите учащимся понять, что электроны на внешней оболочке обозначают, сколько связей элемент может образовать.
Также скажите, что валентными электронами называют электроны, находящиеся на внешней (валентной) оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях, а именно, сколько связей может образовать данный элемент.
(О) (И) Eсли вы располагаете временем, вы можете предложить учащимся написать рассказ о своем любимом элементе.
Убедитесь, что все учащиеся правильно понимают, что
В группах сверху вниз возрастают металлические свойства элементов
Усиливаются основные свойства их соединений
Следует обратить внимание на то, что понятие «электроотрицательность» в этом разделе не вводится. Оно встретится в разделе «Химическая связь».
Убедитесь, что все учащиеся правильно поняли, что:
В периодах слева направо возрастают неметаллические свойства элементов;
усиливаются кислотные свойства их соединений.
Это должно выглядеть примерно так:
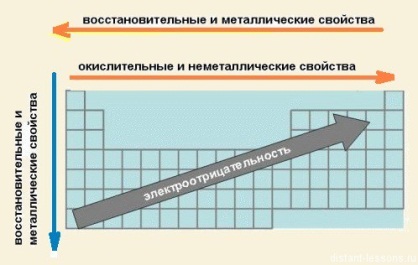
| Вы можете найти полезные таблицы здесь: http://www.nclark.net/KnowPeriodicTable.htm Песня-анимация про элементы: http://www.privatehand.com/flash/elements.html Брошюра по химическим элементам: http://www.nclark.net/ElementBrochure.html Другие полезные и занимательные идеи: http://www.nclark.net/PeriodicTable Физический смысл закона периодичности: http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch1_3.html Периодический закон и периодическая система: http://maratakm.narod.ru/index3.files/Page544.htm Элементарные сведения о строении атома: http://him.1september.ru/article.php?ID=200800603 Закономерности в периодической таблице http://serc.carleton.edu/sp/mnstep/activities/19801.html Закономерности изменения химических свойств элементов и соединений: https://distant-lessons.ru/ximiya/zakonomernosti-izmeneniya-ximicheskix-svojstv-elementov-i-ix-soedinenij Объяснение структуры Периодической таблицы ХЭ: http://prosto-o-slognom.ru/chimia/09_Periodicheskaya_tablitsa.html · Тест с ответами на тему: Периодическая система элементов Д.И.... testdoc.ru/ximiya/test-s-... копия |
Примечание: Лабораторная работа представляет собой потенциальный риск для штата сотрудников и учащихся. Назарбаев Интеллектуальные Школы несут ответственность за определение и использование мер предосторожности. Информация по мерам безопасности отображена схематически и поэтому может быть неполной. Ни МЭС, ни консультанты по программе не несут ответственности за последствия в случае нарушения мер безопасности.
К- методы обучения учащихся всего класса
Г - групповая работа
П - работа в паре
И - индивидуальная работа
Э - ученический эксперимент
Д - демонстрация учителя
У - объяснения учителя
О- оценивание
ТБ - техника безопасности
Дата: 2019-03-05, просмотров: 214. |