m1 – маса внутрішнього стакана, (г)
m2 – маса зовнішнього стакана, (г)
t1 – температура на початок експерименту, (0С)
t2 – максимальна температура під час експерименту, (0С)
Теплота, що виділяється при реакції нейтралізації, витрачається на нагрівання розчину: q = cm(t2 - t1) (13)
Теплоємкість розчину дорівнює теплоємності води, тобто 4,2 Дж/моль. Теплоту, що витрачається на нагрівання калориметру можна зневажати.
Знаходимо масу розчину: m = m2 – m1. (14)
Зверніть увагу, що дані для експерименту кислоти є одноосновними, а луги – однокислотними. Це означає, що для даних речовин співпадають числові значення молярної і еквівалентної (нормальної) концентрації. Тому маємо:
СН = СМ =  (15),
(15),
де ν – кількість розчиненої речовини (кислоти або лугу) у розчині (моль)
V – об’єм даного розчину кислоти або лугу (л).
З рівняння (15) знаходимо кількість розчиненої речовини:
ν = СМ * V; ν = 1 * 0,025 = 0,025 моль
Визначену з рівняння (14) масу розчину підставляємо у рівняння (13). Отримуємо теплоту реакції нейтралізації в “Дж/г”.
Ентальпія реакції відноситься до одного моля і виражається у кілоджоулях. Тому:
ΔН = 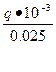 , кДж/моль.
, кДж/моль.
Теоретичне значення ентальпії (ΔН) реакції нейтралізації сильної кислоти лугом дорівнює 56,5 кДж/моль. Визначте відносну помилку (у %) експериментально знайденого теплового ефекту:
η = 
КОНТРОЛЬНІ ПИТАННЯ.
1. Що вивчає термохімія?
2. Сформулюйте закон Лавуазьє – Лапласа.
3. Сформулюйте закон Гесса, наслідок з нього.
4. В чому полягає суть принципу Бертло – Томсена?
5. Які процеси в термохімії називаються ізобарними? Ізохорними?
6. Дайте визначення поняттям: ентальпія, ентропія, ізобарний потенціал.
7. При яких температурах зростає вплив ентропійного фактора на протікання хімічної реакції?
ЗАДАЧІ
1. Вкажіть, як позначаються основні термодинамічні функції? Які їх одиниці розміру? Що таке ентропійна одиниця?
2. Який термодинамічний стан хімічної системи відповідає випадкам: ΔG<0; ΔG>0; ΔG = 0?
3. Користуючись таблицею стандартних ентальпій утворення визначте екзо – або ендотермічність реакції 2 NO + O2 = 2 NO2. Підрахуйте ΔН0 цієї реакції.
4. Підрахуйте зміну ентропії при випаровуванні одного моля води при 1000С і тиску 101,33 кПа (760 мм рт. ст.).
5. Розрахуйте ΔG реакції NO (Г) + ½ O2 (Г) = NO2 (Г) . В якому напрямку буде протікати ця реакція?
РЕКОМЕНДОВАНА ЛІТЕРАТУРА
1. Кульман А.Г. Общая химия, М.: Колос.1979г.с.160 – 178.
2. Глинка Н.Л. Общая химия, Л.: Химия.1981г.с.182 – 189.
3. Глинка Н.Л. Задачи и упражнения по общей химии, Л.: Химия. 1981г.с.80 – 95.
Таблиця 1.
Термодинамічні характеристики деяких речовин у стандартних умовах.
| Речовина, стан | ΔΗ0298, кДж/моль | ΔS0298, кДж/моль | ΔG0298, кДж/моль |
| Al2O3 корунд (к) | -1676,00 | 50,92 | -1582,00 |
| CaO (к) | -635,50 | 39,70 | -604,20 |
| CaCO3 кальцит (к) | -1206,90 | 92,90 | -1128,80 |
| Ca3(PO4)2 (к) | -4137,60 | 236,00 | -3899,50 |
| CH4 (г) | -74,85 | 186,19 | -50,79 |
| C2H2 (г) | 226,75 | 200,80 | 209,20 |
| CO (г) | -110,50 | 197,56 | -137,30 |
| CO2 (г) | -393,51 | 213,65 | -394,36 |
| Cr2O3 (к) | -1140,60 | 81,20 | -1059,00 |
| Fe2O3 гематит (к) | -822,20 | 87,40 | -740,30 |
| Fe(OH)2 (к) | -561,70 | 86,00 | -479,70 |
| Fe(OH)3 (к) | -826,60 | 105,00 | -699,60 |
| H2 (г) | 0,00 | 130,52 | 0,00 |
| H2O (г) | -241,82 | 188,72 | -228,61 |
| H2O (р) | -285,83 | 70,08 | -237,24 |
| H2O (г) | -91,80 | 186,80 | -94,79 |
| MgO (к) | -601,80 | 26,90 | -569,60 |
| MgCO3 магнезит (к) | -1113,00 | 65,70 | -1029,30 |
| N2 (г) | 0,00 | 199,90 | 0,00 |
| NH3 (г) | -46,19 | 192,60 | -16,71 |
| NH4Cl (к) | -314,20 | 95,80 | -203,20 |
| NO (г) | 90,25 | 210,60 | 86,58 |
| NO2 (г) | 33,00 | 240,20 | 51,50 |
| O2 (г) | 0,00 | 205,04 | 0,00 |
| P2O5 (к) | -2891,00 | 228,90 | -2697,60 |
| ZnO (к) | -350,60 | 43,64 | -320,70 |
Лабораторна робота №5.
КІНЕТИКА ТА ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ
Мета роботи – ознайомитися із впливом концентрації, температури і наявності каталізатора на швидкість хімічної реакції; із впливом зміни зовнішніх факторів на зрушення хімічної рівноваги.
ВИМОГИ ДО ЗНАНЬ ТА УМІНЬ
Студент повинен знати:що розуміти під швидкістю хімічної реакції, які фактори впливають на швидкість хімічної реакції, закон діючих мас, закон Вант – Гоффа, що таке хімічна рівновага. Принцип Ле-Шател’є
Студент повинен вміти:вірно орієнтуватися в хімічних процесах, що протікають за різною швидкістю; обґрунтувати і розрахувати швидкість протікання хімічної реакції у потрібному напрямку.
ТЕОРЕТИЧНА ЧАСТИНА
Кожна хімічна реакція протікає з певною швидкістю. Одні йдуть миттєво. З вибухом, інші йдуть на протязі хвилин, годин, а деякі – роками (руйнування гірських порід, утворення деяких солей).
Швидкість реакції вимірюють зміною концентрації реагуючих речовин в одиницю часу.Концентрацію виражають в моль/л, час – у хвилинах або секундах. Необхідно враховувати, що хімічні реакції можуть бути гомогенні, якщо вони протікають в однорідній системі, і гетерогенні, якщо реагуючи речовини знаходяться у різному агрегатному стані або просто між ними є межа розділу.
У гомогенних системах реакція протікає у всьому об’ємі і швидкість вимірюється кількістю речовини, що реагує за одиницю часу в одиниці об’єму.
В гетерогенних системах реакція йде на межі розділу фаз і залежить від величини поверхні розділу. Тому швидкість реакції вимірюється кількістю речовини, що реагує за одиницю часу на одиниці поверхні фази.
Швидкість хімічної реакції залежить від багатьох факторів: концентрації, тиску ( якщо реагуючи речовини знаходяться у стані пари або газу), температури, наявності каталізатора, від природи і стану реагуючих речовин тощо.
Залежність швидкості хімічної реакції від концентрації визначається законом діючих мас, що був сформульований норвезькими вченими Гульбергом і Вааге у 1867 році.
Дата: 2016-10-02, просмотров: 389.