P У випадку, коли розбився прилад, склянка з агресивною рідиною, розлита значна кількість органічних розчинників (більш ніж 0,05л) і починають виділятися отруйні гази і пара, треба негайно вивести всіх студентів з приміщення і після цього приступити до ліквідації наслідків, користуючись засобами індивідуального захисту (халат, гумові рукавиці, респіратори, протигази):
- загасити в приміщенні всі пальники і вимкнути всі електричні прилади;
- відчинити вікна і зачинити двері;
- розлиту рідину засипати піском або тирсою і за допомогою дерев'яного совка або двох дерев'яних дощечок зібрати в тару;
- провітрювання приміщення припинити тільки тоді, коли повністю зникне запах розлитої речовини або газу.
P У разі травмування (поранення, порізи рук склом, опіки гарячими предметами, кислотами, лугами тощо) або при недомаганнях повідомте викладача. В особливо серйозних випадках необхідно негайно звернутись до лікаря.
P При поранені склом видаліть скалки з рани, змажте краї рани розчином йоду і перев’яжіть бинтом.
P У випадку необережного поводження з лугами слід негайно змити їх залишки зі шкіри водою або слабким розчином борної кислоти, у разі потрапляння на шкіру кислоти -слабким розчином питної соди.
P У разі потрапляння в очі будь-якої речовини негайно промийте їх великою кількістю води. Після цього у разі потрапляння в очі кислоти накладіть ватний тампон, змочений розчином натрій гідрокарбонату з масовою часткою 3%, у разі потрапляння лугу - промийте додатково розчином борної кислоти з масовою часткою 2% (1 чайна ложка борної кислоти на склянку води). Після заключного промивання чистою водою під повіки слід ввести 2-3 краплі натрій альбуциду з масовою часткою розчиненої речовини 30%.
P При опіку гарячою рідиною або гарячим предметом опечене місце обробіть свіже виготовленим розчином перманганату калію, змажте опечене місце маззю від опіку або вазеліном. Можна також присипати опік содою або перебинтувати.
P У разі виникнення загоряння необхідно:
- вивести студентів з приміщення;
- повідомити пожежну охорону;
- зачинити вікна і двері, щоб вогонь не поширювався до сусідніх приміщень;
- вимкнути електромережу;
- приступити до ліквідації осередку вогню, при цьому легкозаймисті та горючі рідини і електропроводку слід гасити піском, вогнетривким покривалом, порошковим вогнегасником; знеструмлену електропроводку можна гасити водою або будь-якими наявними вогнегасниками; загорання у витяжній шафі ліквідується вогнегасниками після вимкнення вентилятора.
P У випадку займання горючих речовин швидко погасити пальник, вимкнути електронагрівальні прилади відставити посудину з вогненебезпечною речовиною та гасить пожежу:
- палаючі рідини прикрити азбестом, а потім, якщо потрібно, засипати піском, але не заливайте водою;
- палаючий фосфор погасити вологим піском або водою;
- у разі займання лужних металів погасити полум’я тільки сухим піском, але не водою.
Розділ І. Неорганічна хімія
Лабораторна робота №1.
КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
Мета роботи – повторити матеріал середньої школи і пригадати символіку, класифікацію і номенклатуру хімічних сполук, написати рівняння хімічних реакцій.
ВИМОГИ ДО ЗНАНЬ ТА УМІНЬ
Студент повинен знати: - які сполуки називаються оксидами, їх класифікація і номенклатура;
- які сполуки відносяться до гідроксидів;
- що називається кислотами, гідроксидами, солями, їх класифікація і номенклатура.
Студент повинен вміти: - скласти рівняння реакції і практично здійснити їх;
- по формулі оксиду скласти відповідну формулу кислоти чи гідроксиду;
- записати ступінчату дисоціацію кислот, гідроксидів, солей.
ТЕОРЕТИЧНА ЧАСТИНА
Усі хімічні речовини діляться на прості і складні. Прості складаються з одного і того ж елемента (H2, O2, Fe, Cu, і т.д.) ; складні – із двох і більше елементів (ZnO, NaCl, CaOHCl, NaHCO3 і т.д.).
Прості діляться на метали і неметали. Складні на органічні і неорганічні. До класу неорганічних сполук відносяться оксиди, кислоти, гідроксиди і солі.
ОКСИДИ.
Оксиди – хімічні сполуки елемента з киснем. Формула ЭxOy.
Назва оксиду – складається так. Спочатку говоримо слово оксид, потім називаємо елемент, який утворює цей оксид, Na2O - оксид натрію, BaO – оксид барію. Коли елемент утворює декілька оксидів, то в їх назві указують ступінь окислення елемента (римською цифрою в дужках). Наприклад: СО – оксид вуглецю (ІІ), СО2 – оксид вуглецю (IV).
Класифікація: Оксиди бувають солеутворюючими (Na2O, CaO, Fe2O3) і несолеутворюючими (CO, SiO, N2O,NO). Солеутворюючи оксиди поділяються на основні, кислотні та амфотерні.
Основні – оксиди, гідрати яких є основи . Наприклад: (Na2O, BaO, CuO). Їм відповідають гідроксиди: NaOH, Ba(OH)2, Cu(OH)2.
Кислотні – оксиди, гідрати яких є кислоти.Наприклад: СО, SO3, P2O5, їм відповідають кислоти H2CO3, H2SO4, H3PO4.
Амфотерні (амфоліти) – оксиди, гідрати яких є основи або кислоти в залежності від рН середовища. Наприклад: ZnO, SnO, Al2O3. Їм відповідають гідроксиди Zn(OН)2 , Sn(OН)2 , Al(OН)3 або кислоти H2ZnO2 , H2SnO2 , (HAlO2 · H2O).
КИСЛОТИ.
Кислоти – електроліти, які у водних розчинах дисоціюють тільки на катіони водню і аніони кислотного залишку.
HCl → H+ + Cl-
H2SO4→ H++HSO 
HSO  → H++ SO
→ H++ SO 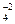
Кислоти бувають кисневмісні (HNO3, H2SO4, H3PO4) і безкисневі (HCl, HBr, H2S).
По кількості атомів водню в кислоті вони бувають одно -, двох -, трьох - і багатоосновні. Наприклад: HCl – одноосновна, H2SO4 – двохосновна, H3PO4 – трьохосновна.
Назва кисневмісних кислот залежить від елементу, який утворює цю кислоту з додатком закінчення – на, коли ступінь окислення елемента відповідає номеру групи в періодичній системі H2SO4 – сірчана кислота, HNO3 - азотна.
По мірі зниження ступеня окислення суфікси змінюються у слідуючому порядку: - вата, - иста, - ватиста. Наприклад: HClO4 – хлорна кислота, HClO3 – хлорновата кислота, HClO2 – хлориста кислота, HСlO – хлорноватиста кислота.
Коли елемент в одній і тій же ступені окислення утворює декілька кисневмісних кислот, то до назви кислоти з меншим числом кисневих атомів добавляють приставку мета, з більшим – орто. HPO3 – метафосфорна кислота, H3PO4 - ортофосфорна кислота.
Назва безкисневмісних кислот залежить від назви елемента, який утворює цю кислоту з додаванням закінчення “о” і додаванням слова “воднева”. HCl – хлороводнева, або соляна кислота, HBr - бромоводнева.
ОСНОВИ.
Основи – електроліти, які у водних розчинах дисоціюють тільки на аніони гідроксильних групі катіони металів.
Наприклад: NaOH→ Na+ + OH-
Ba(OH)2→BaOH++ OH-
BaOH+ →Ba+2 + OH-
Основи бувають розчинні і нерозчинні. Розчинні називаються ще лугами. По кількості гідроксильких груп основи бувають одно-, двох-, трьох- і багатокислотні.
КОН – однокислотне, Са(ОН)2 – двукислотне, Al(OH)3 – трьохкислотне.
Назва основ утворюється із слова “гідроксид” і назви металу в родовому відмінку. NaOH – гідроксид натрію, Са(ОН)2 – гідроксид кальцію.
Коли метали мають переміну ступінь окислення, то в дужках позначають римською літерою ступень окислення металу в цій основі.
Fe(OH)2 – гідроксид заліза (ІІ), Fe(OH)3 – гідроксид заліза (ІІІ)
АМФОЛІТИ.
Труднорозчинні у воді гідроксиди характеризуються тим, що розчинна їх частина може вести себе як основа, або як кислота в залежності від рН середовища. В кислому середовищі амфоліти ведуть себе як основи, в лужному середовищі – як кислоти.
 2Н+ + ZnO
2Н+ + ZnO  ↔H2ZnO2=Zn(OH)2 ↔Zn+2 + 2OH-
↔H2ZnO2=Zn(OH)2 ↔Zn+2 + 2OH-
кислота осадок основа
Zn(OH)2 + 2HCl → ZnCl2 + H2O
H2ZnO2 + 2NaOH → Na2ZnO2 + 2H2O
СОЛІ.
Солі – електроліти, які у водних розчинах дисоціюють на катіони металів і аніони кислотного залишку.
NaCl→Na+ +Cl-
KNO3 →K++ NO 
Солі бувають нормальні (середні) – NaCl, CaSO4, KNO3,
гідросолі (кислі) – KHSO4, NaH2PO4, Na2HPO4,
гідроксосолі (основні) – CaOHCl, AlOHSO4, CaOHNO3.
подвійні – KAl(SO4)2,
змішані – CaClClO,
комплексні – [Cu(NH3)4]SO4.
В назвах солей кисневмісних кислот застосовують закінчення – іт, - ат, -ід.
- іт – коли елемент, утворюючий кислоту, проявляє низьку ступінь окислення. Наприклад: K2SO3 – сульфіт калію.
- ат – коли ступінь окислення вища. Наприклад: Na2SO4 – сульфат натрію.
- ід – в назвах солей безкисневих кислот. Наприклад: ZnS – сульфід цинку.
- KHSO4 – гідросульфат калію,
- NaH2PO4 – дігідрофосфат натрію,
- CaOHCl – гідроксохлорид кальцію.
ПАСПОРТ РОБОТИ
| 1. Натрій. 2. Кальцій. 3. Магній. 4. Цинк. 5. Мідь. 6. Гідроксид амонію. 7. Гідроксид натрію. 8. Гідроксид кальцію. 9. Гідроксид барію. 10. Сірчана кислота. 11. Хлороводнева (соляна) кислота. 12. Сульфат натрію. 13. Сульфат міді. 14. Сульфат нікелю. | 15. Сульфат заліза (ІІ). 16. Сульфат цинку. 17. Сульфат алюмінію. 18. Хлорид барію. 19. Хлорид заліза (ІІІ). 20. Ацетат свинцю. 21. Хлористе олово . 22. Фенолфталеїн. 23. Лакмус. 24. Щипці тигельні. 25. Пінцет. 26. Мікрошпатель. 27. Чашки Петрі. 28. Апарат Кіппа |
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Техніка безпеки.
1. Досліди пов’язані з добуванням оксидів при згорянні простих речовин (металів), проводяться у витяжному шафі.
Метал брати тільки лабораторними щипцями.
2. Досліди зв’язані з добуванням гідроксидів при взаємодії метала з водою, робити тільки під витяжкою.
3. У випадку попадання кислоти або лугу на одяг або тіло, треба негайно їх змити водою. Кислоту ще змивають розчином соди, а луги 5% розчином оцтової кислоти. Потім ще раз водою.
Дослід 1. Одержання і властивості оксидів.
Одержати оксиди металів.
Робоче місце № 1 – оксид натрію.
Робоче місце № 2 – оксид кальцію.
Робоче місце № 3 – оксид магнію.
Робоче місце № 4 – оксид міді
До якого типу вони відносяться. Запишіть рівняння реакції.
Дослід 2. Одержання і властивості розчинних у воді основ.
Робоче місце № 1 – гідроксид натрію, використовуючи відповідний метал і воду.
Робоче місце № 2 – гідроксид кальцію, використовуючи відповідний метал і воду.
Робоче місце № 3 – провести реакцію нейтралізації основи з кислотою.
Робоче місце № 4 – взаємодія основи з кислотою.
Яким чином можна доказати, що це основа. Запишіть рівняння реакції.
Дослід 3. Одержання важкорозчинних у воді основ.
Робоче місце № 1 – гідроксид міді, використовуючи розчинну сіль міді і основу.
Робоче місце № 2 – гідроксид нікелю, використовуючи розчинну сіль нікелю і основу.
Робоче місце № 3 – гідроксид заліза (ІІ), використовуючи розчинну сіль заліза і основу.
Робоче місце № 4 – гідроксид заліза (ІІІ), використовуючи розчинну сіль трьохвалентного заліза і основу.
Напишіть рівняння реакції.
Дослід 4. Властивості кислот.
Робоче місце № 1 – взаємодія кислоти з металом.
Робоче місце № 2 – взаємодія кислоти з оксидом.
Робоче місце № 3 – взаємодія кислоти з сіллю.
Робоче місце № 4 – взаємодія кислоти з основами.
Напишіть рівняння реакції.
Дослід 5. Одержання і властивості амфолітів.
Робоче місце № 1 – гідроксид цинку, використовуючи відповідну сіль і гідроксид амонію.
Робоче місце № 2 – гідроксид алюмінію, використовуючи відповідну сіль алюмінію і гідроксид амонію.
Робоче місце № 3 – гідроксид свинцю, використовуючи відповідну сіль і гідроксид амонію.
Робоче місце № 4 – гідроксид олова, використовуючи відповідну сіль і гідроксид амонію.
Щоб доказати їх амфотерність, розділіть осад на дві половини. В одну з них прилийте кислоти, в другу – лугу.
Напишіть рівняння реакції.
Дослід 6. Одержання і властивості солей.
Робоче місце № 1 – хлорид свинцю, використовуючи відповідну сіль і кислоту .
Робоче місце № 2 – сульфат свинцю, використовуючи відповідну сіль і кислоту.
Робоче місце № 3 – сульфат барію, використовуючи відповідні розчини солей.
Робоче місце № 4 – сульфат кальцію, використовуючи відповідну сіль і кислоту.
Напишіть рівняння реакції.
КОНТРОЛЬНІ ПИТАННЯ
1. На які класи діляться неорганічні сполуки?
2. Які сполуки називаються окислами, основами, кислотами, солями з точки зору електролітичної дисоціації?
3. Що таке амфоліти?
4. Класифікація (які бувають) окислів, основ, кислот і солей.
5. Назви окислів, основ, кислот і солей.
6. Напишіть структурні формули сполук: CO2, Al2O3, H2SO4, H3PO4, CaOHCl, Na2HPO4.
7. При допомозі яких реакцій можна здійснити переходи.
Cu → CuO → Cu(OH)2 → CuCl2
Mg → MgO → Mg(OH)2 → MgSO4
CaCO3 → CaO → CaSO4
ЗАДАЧІ
1. Назвіть слідуючи сполуки: K2O2, MnO2, BaO2, MnO, CrO3, V2O5.
2. Чи можливо здійснити у розчинах слідуючи реакції:
CuSO4 + BaCl2 → BaSO4 + CuCl2
FeS + K2SO4 → FeSO4 + K2S
AgCl + KNO3 → AgNO3 + KCl
3. Складіть рівняння реакцій отримання хлориду магнію: а) дією кислоти на метал; б) дією кислоти на основу; в) дією солі на сіль.
4. Напишіть рівняння реакцій, за допомогою яких можна отримати в лабораторії слідуючи речовини: а) хлороводень; б) сульфід свинцю; в) сульфат барію; г) орто-фосфат срібла; д) гідроксид заліза (ІІІ); е) нітрат міді (ІІ).
5. Які з указаних гідроксидів можуть утворити основні солі: а) Cu(OH)2; б) Ca(OH)2; в) LiOH; г) Al(OH)3; д) KOH.
РЕКОМЕНДОВАНА ЛІТЕРАТУРА
1. Класи неорганічних сполук. Методичні вказівки кафедри.
2. Глинка Н.Л. Задачи и упражнения по общей химии.1983.
3. Глинка Н.Л. Общая химия. 1986.
Лабораторна робота №2.
БУДОВА АТОМА.
Мета роботи – вивчити квантову теорію будови атомів і виходячи з їх будови вміти пояснювати фізичну і хімічну сутність періодичних властивостей елементів і їх сполук.
ВИМОГИ ДО ЗНАНЬ ТА УМІНЬ
Студент повинен знати:основні відомості про будову атомів.
Елементарні часточки (протон, нейтрон, електрон). Ізотопи, ізобари. Сучасне поняття про хімічний елемент. Будова електронних оболонок атомів. Енергетичний стан електронів в атомах. Квантові числа. Орбіталі та їх типи. Порядок заповнення енергетичних рівнів і підрівнів, їх електронну ємність. Принцип Паулі. Формули будови електронних оболонок атомів, їх графічне вираження. Правило Хунда та В.М.Клечковського. Знати структуру періодичної системи Д.І.Менделєєва, як графічне відображення періодичного закону, в чому полягає суть менделеївської та сучасного тлумачення періодичного закону. Наукове та філософське значення періодичного закону і системи.
Студент повинен вміти: написати електронну формулу s, p, d, f- елементів і їх графічне вираження, використовуючи принцип Паулі, правило Клечковського і Хунда, виходячи з електронної формули елемента в періодичній системі, визначити положення елемента (період, група, підгрупа, родина, валентність).
ТЕОРЕТИЧНА ЧАСТИНА
І. Будова атома.
До кінця ХІХ ст., в хімії панувало уявлення, що атом це найменша частинка простої речовини, що він неподільний. Відкриття катодних променів та явище радіоактивності показало, що атом має складну будову.
Після дослідів з α частинками Е.Резерфорд запропонував одну з перших моделей будови атома – планетарну. Будучи недостатньо науковою вона не могла відповісти на питання що до стабільності атома та природи лінійних спектрів газів.
Створення квантової теорії М.Планка дало змогу Н.Бору сформулювати основні положення своєї теорії у вигляді постулатів. Але й ця теорія була досить недосконалою, так як не могла з’ясувати місце знаходження електрона при переході з одного квантового рівня на інший, та її застосування було обмежено лише атомом водню.
20 р.р. ХХ ст. дали новий поштовх для розвитку теорії будови атомів. Завдяки роботам де-Бройля, Е.Шредінгера, В.Гейзенберга та ін. Було розроблено основи хвильової теорії про двоїсту корпускулярно-хвильову природу світла; де-Бройлем було виведено основне рівняння хвильової механіки:  . З цього рівняння випливає, що частинці з масою m, яка рухається з швидкістю V, відповідає хвиля довжиною λ. Це рівняння можна використовувати для характеристики руху не лише фотону, але й інших матеріальних частинок : електрона, протона, нейтрона та ін.. Отже електрон є одночасно частинкою і хвилею. У 1925р. В.Гейзенберг запропонував принцип невизначеності, згідно з яким не можна одночасно становити місце перебування електрона у просторі, його швидкість, імпульс. Все це дало змогу сформулювати сучасну модель будови атома.
. З цього рівняння випливає, що частинці з масою m, яка рухається з швидкістю V, відповідає хвиля довжиною λ. Це рівняння можна використовувати для характеристики руху не лише фотону, але й інших матеріальних частинок : електрона, протона, нейтрона та ін.. Отже електрон є одночасно частинкою і хвилею. У 1925р. В.Гейзенберг запропонував принцип невизначеності, згідно з яким не можна одночасно становити місце перебування електрона у просторі, його швидкість, імпульс. Все це дало змогу сформулювати сучасну модель будови атома.
Сучасна модель:
1. Основується на корпускулярно-хвильовій природі електрона.
2. Розглядає ймовірність знаходження електрона у просторі навколо ядра.
3. Електронна густина нерівномірно розподілена навколо ядра.
4. Атомна орбіталь – простір навколо ядра, де вірогідність знаходження електрона 90%.
5. Атомне ядро
 |  | ||
нейтрони протони
n01 р+1
Ar = Z + N , де Z – кількість протонів,
N – кількість нейтронів.
Ядро заряджене позитивно, а електрони заряджені негативно. Атом в цілому електронейтральний із-за взаємної компенсації зарядів.
Ізотопи – атоми з однаковим зарядом ядра, але різною масою.

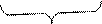 4018Ar і 39 18 Ar ; 11H , 21D, 31 Т.
4018Ar і 39 18 Ar ; 11H , 21D, 31 Т.
Ізобари – атоми з однаковою масою, але різними зарядами.
4018 Ar і 4019К.
1. Стан електронів в атомі характеризується набором певних характерис-тик - квантових чисел.
Їх усього чотири : n, l, m, s. Щоб з’ясувати суть квантових чисел треба зрозуміти, що всі ці числа характеризують електрони на різних енергетичних рівнях в атомі.
Рівні
N = 1 2 3 4
|





ядро
підрівні s s p s p d s p d f
L = 0 0 1 0 1 2 0 1 2 3
орбіталі
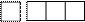
 ml = ↑↓
ml = ↑↓
¯ ¯¯¯
| ¯ | ¯ | ¯ | ¯ | | | | | |
| ¯ | ¯ | ¯ | ¯ | | | | | | | | | | | | |
mS
кожний рівень складається з підрівнів, а кожен підрівень з орбіталей, на яких і знаходяться електрони.
n – головне квантове число; характеризує:
1. енергію електрона в атомі або на рівні;
2. розмір електронної хмари.
Приймає значення від 1 до ∞.
Енергетичні рівні з різним значенням (n) прийнято позначати великими латинськими літерами.
n = 1 2 3 4 5 6 7
рівні К L M N O P Q
якщо n = 3, це означає, що електрон знаходиться на 3 рівні. По значенню (n) можна визначити максимальну кількість електронів на рівні:
N = 2 n2
l – орбітальне квантове число; характеризує:
1. енергію електрона на підрівні.
2. форму електронної орбіталі.
Приймає значення від 0 до (n - 1), кожному значенню l відповідає певний підрівень.
l = 0 1 2 3
підрівень s р d f
якщо l = 3, це означає, що електрон знаходиться на f- підрівні. Кількість підрівнів дорівнює номеру рівня – s, р і т.д. (див. схему).кількість електронів на підрівні розраховується за формулою: N = 2(2l + 1) звідси N е (s) = 2; N е (р) = 6; N е (d) = 10; N е (f) = 14.
ml – магнітне квантове число; характеризує орієнтацію орбіталів у просторі. Воно визначає кількість орбіталей в одному й тому електронному рівні і розраховується по формулі (2l + 1).
m = 0 -1,0,1 -2,-1,0,+1,+2 -3,-2,-1,0,+1,+2,+3
Кількість 1-s 3-р 5-d 7-f
орбіталей
 mS - спін характеризує оберт електрона навколо власної осі. Приймає значення +½ і -½ . ¯
mS - спін характеризує оберт електрона навколо власної осі. Приймає значення +½ і -½ . ¯
Заповнення енергетичних рівнів у незбудженних атомах відбувається згідно з принципом найменшої енергії: найбільш стійким станом електронів в атомі відповідає мінімальна із можливих його енергій. Тому спочатку заповнюються рівні з найменшою енергією. Зміст енергії електрона визначається правилом В.М.Клечковського:
· заповнення електронних шарів йде у напрямку збільшення сум головного і орбітального квантових чисел (n + l).
Звідси зрозуміло, чому зразу заповнюється 4s підрівень, а потім 3d тобто:
Для 4s (n + l = 4), а для 3d (n + l = 5), якщо сума однакова , то спочатку йде заповнення підрівня з найменшим значенням (n).
При заповненні електронних рівнів крім правила Клечковського використовують принцип Паулі і правило Хунда.
Принцип Паулі: в атомі не може бути двох електронів з однаковим значенням всіх чотирьох квантових чисел.
Це означає, що на одній орбіталі може бути не більш 2-х електронів для яких значення n, m, l однакові, а спіни антипаралельні
| ↑↓ |
Правило Хунда: при заповненні енергетичних підрівнів електрони роз- ташовуються так, щоб їх сумарний спін був максимальний.
 | |||||
 |  | ||||

| ↑↓ | ↑↓ | ↑↓ |
↑↑ ↓↓ ↑↑
Не правильно


 ↑ ↓ ↑ правильно
↑ ↓ ↑ правильно
ПРАВИЛО НАПИСАННЯ ЕЛЕКТРОННИХ ФОРМУЛ *.
1. В періодичній системі знаходимо порядковий номер елементу, його величина показує заряд ядра і загальну кількість електронів в атомі.
2. По періодичній системі знаходимо номер періоду даного елементу, його числове значення показує кількість енергетичних рівнів в даному атомі.
3. По періодичній системі знаходимо номер групи даного елементу, його числове значення показує: кількість електронів на останньому енергетичному рівні (якщо це s- чи р-елемент), якщо це d елемент, то їх, як правило, 2, а у де-яких 1 (Cr, Nb, Mo, Ru, Rh, Pt, Cu).
4. Використовуючи формулу Ne = 2 n2 записуємо максимальне число електронів на кожному рівні, крім передостанньому. Кількість електронів на передостанньому визначаємо як різницю між порядковим номером атому елементу і кількістю електронів в атомі, крім передостаннього рівня.
5. Записуємо електронну формулу користуючись правилом Клечковського, Хунда, Паулі.
Наприклад : записати електронну формулу Se.
1. Se 34 Z = +34; ∑ Nе = 34.



 2. Se 4 період
2. Se 4 період



 3. VІ гр. р елемент , на останньому шарі 6 ē
3. VІ гр. р елемент , на останньому шарі 6 ē



 4. N ē = 2 n2 для 1-го N ē =2 6
4. N ē = 2 n2 для 1-го N ē =2 6
для 2-го N ē = 8


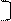
 х = 34 – 16 =18 2 8 х 6
х = 34 – 16 =18 2 8 х 6
2 8 18 6
5. 1s2 2s2 2р6 3 s2 3р6 4 s2 3d10 4р4
*це правило не придатне для написання електронної формули f-елементів
ПАСПОРТ РОБОТИ
Плакати і таблиці.
1. Періодична система Д.І. Менделєєва.
2. Розкладення радіоактивного випромінювання (в електричному та магнітному полі).
3. Атом водню.
4. Оптичний спектр водню. Спектральні лінії та електронні рівні.
5. Види електронних хмар для 1s, 2s, 3s стану.
6. Форми електронних хмар.
7. Проекція орбітального моменту на напрямок поля (l = 2).
8. Екранування s-електронів в атомах селену і телуру.
9. Розподіл електронів по енергетичним коміркам атомів (Li – Ne).
10. Радіуси і енергія іонізації атомів.
Дата: 2016-10-02, просмотров: 327.