ПРИНЦИП МЕТОДУ. Крезолфтамінкомплексон утворює з кальцієм в лужному середовищі комплекс червоно-фіолетового кольору, інтенсивність забарвлення якого пропорційна концентрації кальцію. В реакційну суміш необхідно додати гамма-оксихінолін для зв’язування металів, які заважають визначенню кальцію.
ХІД РОБОТИ
В дві пробірки наливають по 3 мл розчину крезолфталеїнкомплексону. Потім в першу додають 0,05 мл екстракту кісткової тканини, а в другу – 0,05 мл стандартного розчину кальцію. Через 5 хв. колориметрують на ФЕКу при довжині хвилі 500-600 нм (зелений світлофільтр) проти робочого розчину крезолфталеїнкомплексону.
Розрахунок проводять за формулою:
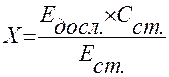 , де
, де
Х – концентрація кальцію в сироватці крові (ммоль/л);
Едосл. – екстинція дослідної проби;
Ест. – екстинція стандартного розчину;
Сст. – концентрація Са в стандартному розчині.
ВИЗНАЧЕННЯ ФОСФАТІВ в сироватці крові
ПРИНЦИП МЕТОДУ. Для виявлення фосфатів використовують їх здатність утворювати з молібденовокислим амонієм в азотнокислому середовищі при нагріванні жовту важкорозчинну комплексну сполуку – фосфорномолібденовокислий амоній.
ХІД РОБОТИ
Беруть дві пробірки: в першу наливають 1 мл сироватки крові, в другу - 1 мл стандартного розчину фосфату. Потім в обидві пробірки добавляють по 4 мл води і 5 мл розчину трихлороцтової кислоти. Через 10 хвилин центрифугують при 3000 об./хв. З обох пробірок відбирають 5 мл безбілкового фільтрату, додають по 1 мл розчину молібденовокислого амонію, 0,2 мл розчину ейконогену та по 1,8 мл води. Через 20 хвилин колориметрують проти води на ФЕКу при червоному світлофільтрі (630-690 нм).
Розрахунок проводять за формулою:
Едосл х Сст
Х = --------------- , де
Ест
Х – концентрація фосфату в сироватці крові, млмоль/л;
Едосл – екстинція дослідної проби;
Ест – екстинція стандартного розчину фосфату;
Сст – концентрація стандартного розчину.
КЛІНІКО – ДІАГНОСТИЧНЕ ЗНАЧЕННЯ
Гіперфосфатурія може спостерігатися при рахіті, коли порушується реабсорбція фосфору в проксимальних канальцях нирок, при гіперпараттиреозі, коли посилюється секреція фосфатів в дистальних канальцях нирок.
Гіпофосфатурія – при гіпопараттиреозі, рахіті з високим вмістом кальцію в їжі, остеопорозі, інфекційних захворюваннях, гострій атрофії печінки, акромегалії.
Література
- Гонський Я.І., Максимчук Т.П. Біохімія людини. Тернопіль: Укрмедкнига, 2001. – 736с.
- Губський Ю.І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. – 508с.
- Гонський Я.І., Максимчук Т.П., Калинський М.І. Біохімія людини. Підручник. – Тернопіль: Укрмедкнига, 2002. – 744с.
4.Скляров О.Я. Клінічна біохімія. – Київ: Здоров`я, 453с.
Обговорено і затверджено на засіданні кафедри, протокол №1 від 28.08.2008р.
Зав. кафедрою проф. Ерстенюк А.М.
Заняття № 30(26)
Тема: Біохімія м'язової тканини.
Актуальність: Знання біохімічного складу м'язової тканини, молекулярних механізмів, які лежать в основі роботи м'язів, необхідні для розуміння принципів діагностики та лікування захворювань м'язів.
Навчальні цілі
Знати: біохімічний склад, особливості метаболізму і молекулярні механізми роботи м'язів.
Вміти: визначати концентрацію креатиніну і трактувати одержані дані.
Самостійна позааудиторна робота
І. В зошитах для протоколів дайте відповіді на наступні запитання:
1. Напишіть рівняння синтезу креатину, вкажіть місце синтезу.
2. Напишіть рівняння реакції синтезу креатинфосфату, вкажіть фермент і місце синтезу.
3. Напишіть рівняння реакції утворення креатиніну.
4. Добове виділення з сечею креатину – 1,2 г, креатиніну – 0,3г, .
а) обчисліть креатиніновий показник;
б) при яких патологічних станах може спостерігатись?
5. Підготуйте вихідні дані для оформлення протоколу лабораторної роботи „Визначення креатиніну в сироватці крові”.
Контрольні питання
1. Біохімічний склад м'язів, особливості серцевого м'язу.
2. Джерела енергії м'язової діяльності (креатинфосфат).
3. Особливості енергетичного обміну серцевого м'язу.
4. Молекулярні механізми скорочення і розслаблення м'язів.
5. Біохімічні зміни при захворюваннях м'язів.
Самостійна аудиторна робота
1. Охарактеризуйте метаболічні шляхи в м'язах:
| Тип м'язів | Особливості будови | Метаболічні шляхи | Порушення |
2. Виконати лабораторні роботи „Визначення креатиніну в сироватці крові”.
Принцип методу. Креатинін при взаємодії з пікриновою кислотою в лужному середовищі утворює червоний таутомер пікрату креатиніну, який зумовлює появу стійкого оранжево-червоного забарвлення. Інтенсивність забарвлення пропорційна концентрації креатиніну. Вміст креатиніну в сироватці крові в нормі складає 50-100 мкмоль/л.
Хід роботи. До 2 мл сироватки додають 6 мл насиченого розчину пікринової кислоти. Через 5 хв пробірку ставлять на 15-20 сек. в киплячу водяну баню. Вміст пробірки центрифугують або фільтрують, після чого відбирають 4 мл надосадкової рідини і виливають в іншу пробірку. До центрифугату додають 0,2 мл 10% розчину їдкого натрію і добре перемішують. Якщо з'являється помутніння, яке може бути в результаті випадання в осад фосфатів, розчин центрифугують. Загальний об’єм розчину доводять дистильованою водою до 10 мл і залишають на 10 хвилин. Після цього колориметрують, порівнюючи з контрольною пробою при зеленому світлофільтрі (довжина хвилі 525 нм) в кюветі з товщиною шару 20 мм. Екстинкцію визначають не пізніше ніж через 20 хвилин після додавання їдкого натрію.
Контрольну пробу ставлять паралельно. Для цього до 3 мл насиченого розчину пікринової кислоти додають 0,2 мл 10% розчину їдкого натрію і загальний об’єм доводять дистильованою водою до 10 мл.
Для стандартної проби замість сироватки беруть 2 мл робочого стандартного розчину, в якому концентрація креатиніну дорівнює 0,1 ммоль/л. Проби при цьому не центрифугують.
Розрахунок концентрації креатиніну (Х) проводять за формулою:
Едосл
Х = --------- х 0,1 ммоль/л
Ест
де
Едосл - екстинкція дослідної проби;
Ест - екстинкція стандартної проби;
0,1 – концентрація креатиніну в стандартній пробі, ммоль/л.
Необхідно пам’ятати, що прямолінійна залежність між величиною екстинкції і вмістом креатиніну зберігається тільки при його концентрації в межах 0,026-0,352 ммоль/л.
Дата: 2016-10-02, просмотров: 373.