Лекция: Строение атома.
Большую роль в установлении сложной природы атома и расшифровке его структуры сыграло открытие и изучение радиоактивности (явление испускания некоторыми элементами излучения, способного проникать через вещества, ионизировать воздух, вызывать засвечивание фотографических пластинок). Впервые в 1896г. радиоактивность обнаружена А. Беккерелем у соединений урана. Мария и Пьер Склодовские-Кюри обнаружили радиоактивность и у соединений тория, а в 1898 г. они открыли в составе урановых руд присутствие двух новых радиоактивных элементов – полония и радия. Опыты супругов Кюри показали, что атомы радия в процессе радиоактивного излучения распадаются, превращаясь в атомы других элементов, в частности, в атомы гелия. Впоследствии было установлено, что другим продуктом распада радия является инертный газ радон.
В 1903 г. Дж. Томсон предложил модель строения атома, согласно которой атом состоит из положительного ядра и электронов. Развивая эти представления, Э. Резерфорд в 1911г. предложил ядерную модель строения атома. Существенным шагом в развитии представлений о строении атома стала предложенная в 1913г. Н. Бором теория, объединившая, по сути, ядерную модель атома с квантовой теорией света. Основные положения своей теории Бор сформулировал в виде следующих постулатов: 1) электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам (стационарным орбитам); 2) Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии; 3) Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую.
В 1900г. М. Планк предположил, что лучистая энергия испускается и поглощается телами не непрерывно, а дискретно. При этом, он определил энергию каждой такой порции как Е=h*n(уравнение Планка), где n – частота излучения; h=6,626*10-34 Дж*с – постоянная Планка. Т.о. согласно определению Планка квант – это минимальная порция электромагнитного излучения с определенной частотой. В 1905г. А. Эйнштейн при изучении явления фотоэлектрического эффекта пришел к выводу, что электромагнитная энергия существует только в форме квантов, а излучение представляет собой поток неделимых материальных «частиц» - фотонов, энергия которых определяется уравнением Планка. Фотон не является ни частицей, ни волной – ему свойственна корпускулярно-волновая двойственность.
Атом и его строение
Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом же атом – система электронейтральная. Атомное ядро состоит из нуклонов: протонов (заряд +1, массовое число 1) и нейтронов (заряд 0, массовое число 1). Заряд ядра, равный порядковому номеру элемента в таблице Д.И. Менделеева, совпадает с числом протонов: массовое число ядра равно суммарному количеству протонов и нейтронов. У одного элемента возможно существование атомов с различным массовым числом ядер – изотопов, т.е. атомов с различным числом нейтронов и одинаковым числом протонов.
Согласно современным представлениям, электрон обладает одновременно свойствами волны и частицы, поэтому для описания его поведения нельзя пользоваться привычными характеристиками, такими как скорость и траектория движения. Вместо этого используют полную энергию электрона (сумма потенциальной и кинетической энергии) и вероятность обнаружения электрона в заданной области пространства.
Состояние электрона в атоме характеризуется волновой функцией, являющейся решением волнового уравнения Шредингера. Из математического анализа уравнения вытекает дискретность значений энергии электрона, момента количества орбитального движения и проекции этого момента на выделенное в пространстве направление. Дискретность выражается квантовыми числами: главным – n, орбитальным – l, магнитным - ml . Четвёртое квантовое число - ms, называют спиновым. Волновая функция при определённых значениях трёх квантовых чисел (n, l ,ml) описывает состояние электрона, характеризующееся так называемой атомной орбиталью (АО).
Каждой АО соответствует область пространства определённого размера, формы и ориентации, равноценная понятию электронного облака. Электронное облако не имеет чётких границ, в связи с этим введено понятие граничная поверхность, т.е. поверхность с равной электронной плотностью, ограничивающая объём, который включает 90% заряда и массы электрона. Форма и размер граничной поверхности считается формой и размером электронного облака.
Главное квантовое число – n определяет энергию АО и номер энергетического уровня, на котором находится электрон (т.е. допустимые уровни энергии электрона) и может принимать значения от единицы до бесконечности.
Орбитальное квантовое число – 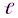 определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n-
определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n- 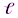 .
.
Магнитное квантовое число – ml определяет пространственную ориентацию данной АО и отчасти её форму (т.е. ориентацию электронных облаков в пространстве) и может принимать значения от – 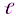 …0…+
…0…+ 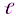 .
.
Спиновое квантовое число – ms характеризует собственный момент импульса и связанный с ним магнитный момент (т.е. вращение электрона вокруг оси), и может принимать значения ± 1/2.
Число АО в пределах энергетического подуровня определяется числовым значением магнитного квантового числа (2 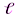 +1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
+1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
Строение атома фтора выражается электронной формулой 1s22s22p5 и электронно-графической формулой:
2s 2p
| 1s | ¯ | ¯ | ¯ | | |
| ¯ | |||||
При заполнении АО действует принцип Паули (или запрет Паули), согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа одинаковые. Основным следствием этого принципа является то, что на одной АО не может находиться более двух электронов. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа. При переходах электронов с одной орбиты на другую атом поглощает или излучает энергию.
Принцип Паули определяет ёмкость (максимальное число электронов) энергетических уровней и подуровней, которая соответственно равна 2n2 и 2(2  +1) т.е. удвоенному числу АО.
+1) т.е. удвоенному числу АО.
Заполнение энергетических подуровней подчиняется правилу Хунда, согласно которому устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Например, четыре валентных p – электрона атома кислорода размещаются в квантовых ячейках следующим образом:
2p
| ¯ | | |
Закономерная последовательность заполнения энергетических уровней и подуровней в атомах с увеличением порядкового номера элемента выражается правилами Клечковкого, которые называют правилом суммы n+ 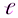 . Согласно I-му правилу Клечковского, при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел к орбиталям с большим значением этой суммы. При одинаковом значении этой суммы порядок заполнения электронами энергетических подуровней определяется II-ым правилом Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа. Т.о. первым заполняется подуровень с меньшим значением n в этой сумме:
. Согласно I-му правилу Клечковского, при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел к орбиталям с большим значением этой суммы. При одинаковом значении этой суммы порядок заполнения электронами энергетических подуровней определяется II-ым правилом Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа. Т.о. первым заполняется подуровень с меньшим значением n в этой сумме:
1 s ® 2 s ® 2 p ® 3 s ® 3 p ® 4 s ® 3 d ® 4 p ® 5 s ®
4 d ® 5 p ® 6 s ® …
Правила Клечковского позволяют заранее предвидеть появление в периодической системе Д.И. Менделеева рядов из d - , а затем из f - элементов, которые находятся между s – и p – элементами больших периодов.
Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней: s- элементы – заполнение внешнего s - подуровня при наличии на предвнешним уровне двух или восьми электронов, например:
Li 1s2 2s2
р- элементы – заполнение внешнего p- подуровня, например:
F 1s2 2s2 2p5
d- элементы – заполнение предвнешнего d- подуровня, например:
V 1s22s22p63s23p64s23d3
f- элементы – заполнение f- подуровня второго снаружи уровня, например:
N  d 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4
d 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4
Если на валентных энергетических уровнях имеются вакантные АО, то при возбуждении атома (получении ими порции энергии) становится возможным «разъединение» валентных электронов, то есть их переходы с тех подуровней, где все АО заняты полностью ( ¯) или частично (¯) на другие валентные подуровни того же уровня, имеющие незаполненные АО. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т.е. возможно несколько возбуждённых состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов). Например, валентными электронами атома осмия в основном состоянии являются следующее: 5d6 6s2. Их распределение по квантовым ячейкам:
5d 6s
| ¯ | | | | | ¯ |
(атом осмия находится в 4–валентном состоянии).
При этом как на пятом, так и на шестом уровнях имеются вакантные АО. Получение атомом осмия двух последовательных порций энергии приводит к следующим возбуждённым состояниям - атом осмия находится: 1) в шести валентном состоянии; 2) в 8 – валентном состоянии.
5d 6s
| ¯ | | | | | ¯ |
(атом осмия находится в 4–валентном состоянии).
При этом как на пятом, так и на шестом уровнях имеются вакантные АО. Получение атомом осмия двух последовательных порций энергии приводит к следующим возбуждённым состояниям - атом осмия находится: 1) в шести валентном состоянии; 2) в 8 – валентном состоянии.
Схемы реакций
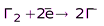 (НГ и их соли)
(НГ и их соли)
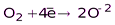 (H2O, оксиды и их производные)
(H2O, оксиды и их производные)
 (ЭНn и их соли)
(ЭНn и их соли)
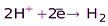
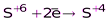 (SO2, H2SO3 и её соли)
(SO2, H2SO3 и её соли)
 (S¯)
(S¯)
 (H2S и её соли)
(H2S и её соли)
 (NO2)
(NO2)
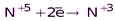 (N2O3, HNO2 и её соли)
(N2O3, HNO2 и её соли)
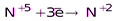 (NO)
(NO)
 (N2O)
(N2O)
 (N2)
(N2)
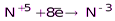 (NH3, NH4+ и соответствующие соли)
(NH3, NH4+ и соответствующие соли)
Схемы реакций
KMnO4
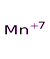
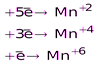
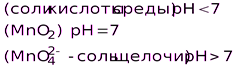
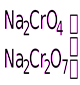

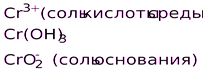
H2O2
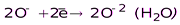
Катионы металлов высшей степени окисления (Fe+3, Sn+4, и т. п.)
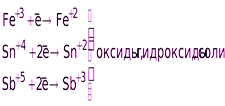
Восстановители
Простые вещества:
металлы (Ме)

Н2
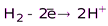 (H2O)
(H2O)
Неметаллы (S,C,P,N2,…)
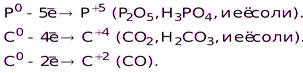
H2S и её соли, Na2S2O3
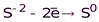
НГ и их соли
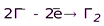
Катионы металлов в низших степенях окисления
(Fe+2, Sn+2, Sb+3, Cr+3 и т.д.)
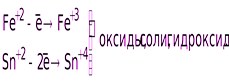
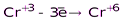
HNO2 и её соли.
 (HNO3 или ее соли).
(HNO3 или ее соли).
H2SO3 и её соли.
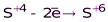 (H2SO4 или ее соли).
(H2SO4 или ее соли).
H2O2
Методы защиты от коррозии
Существует 4 основных метода защиты от коррозии:
Легирование
Защитные покрытия (металлические и неметаллические)
Антикоррозионная обработка среды (деаэрация, ингибиторы)
Электрохимическая защита.
Легирование.
Легирование – создание коррозионно-стойких сплавов. Если в состав углеродной стали ввести легирующие добавки (Cr, Ni, Ti, Al, и т. д.), которые образуют прочные оксидные плёнки на поверхности металла, то, несмотря на небольшое количество добавок, на поверхности металла образуется прочная защитная пленка оксидов. Но недостатком легирования является то, что основной металл устойчив только во влажной атмосфере воздуха и в воде.
Защитные покрытия.
Защитные покрытия бывают металлические и неметаллические. Металлические – лужение, покрытие оловом, никелирование, хромирование, цинкование и др.
Покрытие наносят погружением детали в расплавленный металл, а так же напылением и электролизом. Метод электролиза с растворимым анодом называется гольваностегия.
Рассмотрим пример хромирования:
В электролизёр заливают электролит Cr2(SO4)3, хром делают анодом, он будет окисляться, посылая в раствор ионы хрома, а катодом делают деталь, на которую нужно нанести металлическое покрытие, на ней будут восстанавливаться ионы хрома, покрывая деталь ровным слоем хрома:
анодный процесс: Cr0 – 3e = Cr3
катодный процесс: Cr3 3e = Cr0
Механизм защитного действия металлического покрытия.
Пока металлическое покрытие не повреждено, оно защищает металл от коррозии. Существует 2 вида покрытия: анодное и катодное. Анодным называется покрытие более активным металлом, чем основной, катодным называют покрытие менее активным металлом, чем основной.
Пример: железная пластина покрыта цинковым покрытием. При повреждении покрытия возникает коррозионная гальванопара:
A 
 Zn | H2SO4 | Fe К
Zn | H2SO4 | Fe К
анодный процесс: Zn – 2e = Zn2
катодный процесс: 2H 2e = H2↑
Zn 2H = Zn2 H2↑
Вывод: анодное покрытие защищает металл как механически, так и электрохимически, так как при повреждении покрытия разрушается металл покрытия, а не основной металл.
Рассмотрим пример с лужёным железом:


A Fe | H2SO4 | Sn K
анодный процесс: Fe – 2e = Fe2
катодный процесс: 2H 2e = H2↑
Fe 2H = Fe2 H2↑
Вывод: катодное покрытие только механически защищает основной металл, так как при повреждении покрытия разрушается основной металл.
Неметаллические покрытия.
Химические покрытия.
Оксидирование - покрытие изделия оксидной плёнкой. Например: железо можно поместить в раствор NaOH – 40%,нагретый до 140°С, KNO3 или K2CrO4.
3 Fe 2OH– – 2e = FeO H2O
1 2Fe 6OH– –6e = Fe2O3 H2O
3Fe 2Fe 8OH- = 3FeO Fe2O3 4H2O
FeO Fe2O3 à Fe3O4(чёрн.)
Фосфатирование. Создание на поверхности изделия защитной плёнки из трудно растворимых фосфатов и гидрофосфатов марганца железа.
Лакокрасочное покрытие. Краска, содержащая олифу и красящий пигмент, препятствует процессу коррозии.
Антикоррозионная обработка среды.
Антикоррозионная обработка среды применяется для замкнутых объёмов. Например деаэрация – удаление кислорода из раствора, используется для паровых котлов.
Ингибиторы – замедлители коррозии, это поверхностноактивные вещества, которые адсорбируются на поверхности металлов, т. е. они покрывают изделие адсорбционной плёнкой и таким образом защищают его от коррозии. Ингибиторы бывают летучие и контактные.
Электрохимические методы защиты от коррозии.
Протекторная защита. К основному металлу присоединяется кусок из более активного металла и при образовании гальванопары, этот кусок будет растворяться, а основной металл останется неповреждённым.
Катодная защита. К защищаемому изделию присоединяют кусок металла и подают небольшое напряжение, так, чтобы основной металл являлся катодом, а вспомогательный – анодом, тогда будет происходить электролиз с растворимым анодом и основной металл будет защищён.
Лекция: Основные классы неорганических соединений.
Основными классами неорганических соединений являются оксиды, кислоты, соли и основания.
Оксиды представляют собой соединения элементов с кислородом. Оксиды подразделяют на солеобразующие и несолеобразующие. Солеобразующие оксиды делят на основные (образуют соли с кислотами), кислотные (образуют соли с основаниями) и амфотерные (образуют соли как с кислотами, так и с основаниями). Основным оксидам отвечают основания, кислотным – кислоты, а амфотерным – гидраты, которые проявляют как кислотные, так и амфотерные свойства. Кислотные оксиды представляют собой ангидриды кислот (SO2 – серный ангидрид, N2O5 – азотный ангидрид).
Примеры: N2O, NO - несолеобразующие оксиды; SO3, SiO2 - кислотные оксиды; СаО, МgО – основные оксиды и т.д.
В настоящее время общепринятой является международная номенклатура оксидов. Согласно международной номенклатуре в названии оксида указывается валентность элемента: СuO и Cu2O – оксиды меди [II] и [III] соответственно. Существует также русская номенклатура, согласно которой окисью называется единственно возможный оксид элемента, в остальных случаях название дается в соответствии с числом атомов кислорода. Оксиды, в которых элемент проявляет низшую валентность, называются закисями.
Примеры: MgO – окись магния; NiO – одноокись никеля; Ni2O3 – полутораокись никеля; Сu2О – полуокись меди.
Пероксиды (перекиси) металлов являются солями перекиси водорода Н2О2 и лишь формально относятся к оксидам. Приставка пер в названии соединений обычно указывает на принадлежность соединения к перекисным, но существуют исключения: соли кислот НMnO4 (перманганаты) и НСlO4 (перхлораты) перекисными не являются, а приставка пер в названии этих соединений указывает на максимальную насыщенность соединений кислородом.
Гидроксиды (основания) классифицируют по их силе (сильные – все щелочи кроме NH4OH и слабые), а также по растворимости в воде (растворимые – щелочи и нерастворимые). Важнейшими щелочами являются КОН (едкое кали) и NaOH (едкий натр).
В состав кислот входит водород, способный замещаться металлом, а также кислотный остаток. Коэффициент х, отвечающий количеству атомов водорода, а, следовательно, равный валентности кислотного остатка, называют основностью кислоты. Кислоты классифицируют по их силе (H2SO4, HNO3 – сильные кислоты; HCN – слабая кислота), на кислородсодержащие (H2SO4, HNO3) и бескислородные (HCN, HI); а также по основности (х) -
HCN – одноосновная кислота, H2SO3 – двухосновная кислота, H3РO4– трехосновная кислота. Важнейшим свойством кислот является их способность образовывать соли с основаниями. Названия кислот образуют от того элемента, которым образована кислота, при этом названия бескислородных кислот оканчивается словом водород (HCN –циановодород или синильная кислота). Названия кислородсодержащих кислот образуют от того элемента, которым образована кислота, с добавлением слова кислота (H3AsO4 – мышьяковая кислота, H2CrO4 – хромовая кислота). В случаях, когда один элемент образует несколько кислот различие между кислотами проявляют в окончаниях названий (на ная или овая оканчиваются названия тех кислот, в которых элемент проявляет наивысшую валентность; на истая или овистая оканчиваются названия тех кислот, в которых элемент проявляет валентность ниже максимальной).
Примеры: HNO3 – азотная кислота, а HNO2 - азотистая кислота; H3AsO4 – мышьяковая кислота, а H3AsO3 – мышьяковистая кислота.
Одному и тому же оксиду могут соответствовать несколько кислот, при этом наиболее богатая водой форма имеет в названии приставку орто, а наименее богатая – мета (ортофосфорная кислота H3РO4 – на одну молекулу ангидрида Р2О5 приходится три молекулы воды; метафосфорная кислота HРO3 – на одну молекулу ангидрида Р2О5 приходится одна молекула воды). Следует также учитывать и то, что ряд кислот имеют исторически сложившиеся названия.
Соли являются продуктом замещения водорода в кислоте на металл или гидроксогрупп в основании на кислотный остаток. Нормальные (средние) соли получаются при полном замещении; кислые – при неполном замещении водорода кислоты на металл; основные – при неполном замещении гидроксогрупп основания на кислотный остаток. Кислая соль может быть образована только кислотой, основность которой 2 и более, а основная – металлом, заряд которого 2 и более.
Примеры: NaHS, KHCO3 – кислые соли (гидросульфид натрия и гидрокарбонат натрия); MgOHCl, CaOHCl – основные соли (хлориды гидроксо магния и кальция); NaCl, CuS – нормальные соли (хлорид натрия и сульфид меди).
| Название кислоты | Формула | Пример соли | Название соли |
| Серная | H2SO4 | K2SO4 | сульфат К |
| сернистая | H2SO3 | Na2SO3 | сульфит Na |
| соляная | HCl | Ca(Cl)2 | хлорид Са |
| иодоводородная | HI | KI | иодид К |
| сероводородная | H2S | Na2S | cульфид Na |
| азотная | HNO3 | KNO3 | нитрат К |
| азотистая | HNO2 | NaNO2 | нитрит Na |
| ортофосфорная | H3РO4 | K3РO4 | ортофосфат К |
| хлорная | НСlO4 | NaСlO4 | перхлорат Na |
| хлорноватая | НClO3 | NaСlO3 | хлорат Na |
| хлористая | НClO2 | NaСlO2 | хлорит Na |
| хлорноватистая | НСlO | NaСlO | гипохлорит Na |
| кремниевая | H2SiO3 | CaSiO3 | силикат Сa |
Продолжение табл.
| Название кислоты | Формула | Пример соли | Название соли |
| алюминиевая | H3AlO3 | K3AlO3 | алюминат К |
| ортоборная | H3BO3 | K3BO3 | ортоборат К |
| мышьяковая | H3AsO4 | K3AsO4 | арсенат К |
| мышьяковистая | H3AsO3 | K3AsO3 | арсенит К |
| двуфосфорная | H4P2O7 | K4P2O7 | дифосфат К |
| угольная | H2CO3 | K2CO3 | карбонат К |
| фосфористая | H3PO3 | K3PO3 | фосфит К |
| фтороводород | HF | KF | фторид К |
| хромовая | Н2СrO4 | K2СrO4 | хромат К |
| синильная | НCN | KCN | цианид К |
Лекция: Строение атома.
Большую роль в установлении сложной природы атома и расшифровке его структуры сыграло открытие и изучение радиоактивности (явление испускания некоторыми элементами излучения, способного проникать через вещества, ионизировать воздух, вызывать засвечивание фотографических пластинок). Впервые в 1896г. радиоактивность обнаружена А. Беккерелем у соединений урана. Мария и Пьер Склодовские-Кюри обнаружили радиоактивность и у соединений тория, а в 1898 г. они открыли в составе урановых руд присутствие двух новых радиоактивных элементов – полония и радия. Опыты супругов Кюри показали, что атомы радия в процессе радиоактивного излучения распадаются, превращаясь в атомы других элементов, в частности, в атомы гелия. Впоследствии было установлено, что другим продуктом распада радия является инертный газ радон.
В 1903 г. Дж. Томсон предложил модель строения атома, согласно которой атом состоит из положительного ядра и электронов. Развивая эти представления, Э. Резерфорд в 1911г. предложил ядерную модель строения атома. Существенным шагом в развитии представлений о строении атома стала предложенная в 1913г. Н. Бором теория, объединившая, по сути, ядерную модель атома с квантовой теорией света. Основные положения своей теории Бор сформулировал в виде следующих постулатов: 1) электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам (стационарным орбитам); 2) Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии; 3) Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую.
В 1900г. М. Планк предположил, что лучистая энергия испускается и поглощается телами не непрерывно, а дискретно. При этом, он определил энергию каждой такой порции как Е=h*n(уравнение Планка), где n – частота излучения; h=6,626*10-34 Дж*с – постоянная Планка. Т.о. согласно определению Планка квант – это минимальная порция электромагнитного излучения с определенной частотой. В 1905г. А. Эйнштейн при изучении явления фотоэлектрического эффекта пришел к выводу, что электромагнитная энергия существует только в форме квантов, а излучение представляет собой поток неделимых материальных «частиц» - фотонов, энергия которых определяется уравнением Планка. Фотон не является ни частицей, ни волной – ему свойственна корпускулярно-волновая двойственность.
Атом и его строение
Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом же атом – система электронейтральная. Атомное ядро состоит из нуклонов: протонов (заряд +1, массовое число 1) и нейтронов (заряд 0, массовое число 1). Заряд ядра, равный порядковому номеру элемента в таблице Д.И. Менделеева, совпадает с числом протонов: массовое число ядра равно суммарному количеству протонов и нейтронов. У одного элемента возможно существование атомов с различным массовым числом ядер – изотопов, т.е. атомов с различным числом нейтронов и одинаковым числом протонов.
Согласно современным представлениям, электрон обладает одновременно свойствами волны и частицы, поэтому для описания его поведения нельзя пользоваться привычными характеристиками, такими как скорость и траектория движения. Вместо этого используют полную энергию электрона (сумма потенциальной и кинетической энергии) и вероятность обнаружения электрона в заданной области пространства.
Состояние электрона в атоме характеризуется волновой функцией, являющейся решением волнового уравнения Шредингера. Из математического анализа уравнения вытекает дискретность значений энергии электрона, момента количества орбитального движения и проекции этого момента на выделенное в пространстве направление. Дискретность выражается квантовыми числами: главным – n, орбитальным – l, магнитным - ml . Четвёртое квантовое число - ms, называют спиновым. Волновая функция при определённых значениях трёх квантовых чисел (n, l ,ml) описывает состояние электрона, характеризующееся так называемой атомной орбиталью (АО).
Каждой АО соответствует область пространства определённого размера, формы и ориентации, равноценная понятию электронного облака. Электронное облако не имеет чётких границ, в связи с этим введено понятие граничная поверхность, т.е. поверхность с равной электронной плотностью, ограничивающая объём, который включает 90% заряда и массы электрона. Форма и размер граничной поверхности считается формой и размером электронного облака.
Главное квантовое число – n определяет энергию АО и номер энергетического уровня, на котором находится электрон (т.е. допустимые уровни энергии электрона) и может принимать значения от единицы до бесконечности.
Орбитальное квантовое число – 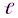 определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n-
определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n- 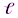 .
.
Магнитное квантовое число – ml определяет пространственную ориентацию данной АО и отчасти её форму (т.е. ориентацию электронных облаков в пространстве) и может принимать значения от – 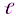 …0…+
…0…+ 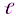 .
.
Спиновое квантовое число – ms характеризует собственный момент импульса и связанный с ним магнитный момент (т.е. вращение электрона вокруг оси), и может принимать значения ± 1/2.
Число АО в пределах энергетического подуровня определяется числовым значением магнитного квантового числа (2 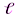 +1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
+1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
Строение атома фтора выражается электронной формулой 1s22s22p5 и электронно-графической формулой:
2s 2p
| 1s | ¯ | ¯ | ¯ | | |
| ¯ | |||||
При заполнении АО действует принцип Паули (или запрет Паули), согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа одинаковые. Основным следствием этого принципа является то, что на одной АО не может находиться более двух электронов. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа. При переходах электронов с одной орбиты на другую атом поглощает или излучает энергию.
Принцип Паули определяет ёмкость (максимальное число электронов) энергетических уровней и подуровней, которая соответственно равна 2n2 и 2(2  +1) т.е. удвоенному числу АО.
+1) т.е. удвоенному числу АО.
Заполнение энергетических подуровней подчиняется правилу Хунда, согласно которому устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Например, четыре валентных p – электрона атома кислорода размещаются в квантовых ячейках следующим образом:
2p
| ¯ | | |
Закономерная последовательность заполнения энергетических уровней и подуровней в атомах с увеличением порядкового номера элемента выражается правилами Клечковкого, которые называют правилом суммы n+ 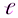 . Согласно I-му правилу Клечковского, при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел к орбиталям с большим значением этой суммы. При одинаковом значении этой суммы порядок заполнения электронами энергетических подуровней определяется II-ым правилом Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа. Т.о. первым заполняется подуровень с меньшим значением n в этой сумме:
. Согласно I-му правилу Клечковского, при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел к орбиталям с большим значением этой суммы. При одинаковом значении этой суммы порядок заполнения электронами энергетических подуровней определяется II-ым правилом Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа. Т.о. первым заполняется подуровень с меньшим значением n в этой сумме:
1 s ® 2 s ® 2 p ® 3 s ® 3 p ® 4 s ® 3 d ® 4 p ® 5 s ®
4 d ® 5 p ® 6 s ® …
Правила Клечковского позволяют заранее предвидеть появление в периодической системе Д.И. Менделеева рядов из d - , а затем из f - элементов, которые находятся между s – и p – элементами больших периодов.
Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней: s- элементы – заполнение внешнего s - подуровня при наличии на предвнешним уровне двух или восьми электронов, например:
Li 1s2 2s2
р- элементы – заполнение внешнего p- подуровня, например:
F 1s2 2s2 2p5
d- элементы – заполнение предвнешнего d- подуровня, например:
V 1s22s22p63s23p64s23d3
f- элементы – заполнение f- подуровня второго снаружи уровня, например:
N  d 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4
d 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4
Если на валентных энергетических уровнях имеются вакантные АО, то при возбуждении атома (получении ими порции энергии) становится возможным «разъединение» валентных электронов, то есть их переходы с тех подуровней, где все АО заняты полностью ( ¯) или частично (¯) на другие валентные подуровни того же уровня, имеющие незаполненные АО. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т.е. возможно несколько возбуждённых состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов). Например, валентными электронами атома осмия в основном состоянии являются следующее: 5d6 6s2. Их распределение по квантовым ячейкам:
5d 6s
| ¯ | | | | | ¯ |
(атом осмия находится в 4–валентном состоянии).
При этом как на пятом, так и на шестом уровнях имеются вакантные АО. Получение атомом осмия двух последовательных порций энергии приводит к следующим возбуждённым состояниям - атом осмия находится: 1) в шести валентном состоянии; 2) в 8 – валентном состоянии.
5d 6s
| ¯ | | | | | ¯ |
(атом осмия находится в 4–валентном состоянии).
При этом как на пятом, так и на шестом уровнях имеются вакантные АО. Получение атомом осмия двух последовательных порций энергии приводит к следующим возбуждённым состояниям - атом осмия находится: 1) в шести валентном состоянии; 2) в 8 – валентном состоянии.
Дата: 2019-11-01, просмотров: 301.