
Наиболее известным примером служит фторид-селективный электрод, мембраной которого является пластинка из монокристалла LaF3 с добавками европия (III) для увлечения электропроводности. Фторид лантана очень мало растворим, и электрод обладает нернстовсим откликом к F- до концентрации порядка 1*1-5М, не нернстовским (тангенс угла наклона градировочного графика отличается от теоретического) – даже до1*10-6М. Селективность этого электрода по отношению к фторид-ионам почти в 100 раз больше чем хлорид-, бромид-, иодид-, натрат-, сульфат-, гидрофосфат- и гидрокарбонат-ионам, и в 10 раз выше, чем к гидроксид-ионам. Определению фторида серьезно мешает только гидроксид-ион. При использовании фторид-селективного электрода интервал pH ограничен в кислой среде образованием фторситоводородной кислоты, а в щелочной – откликом электрода к ионам OH-. Это сужает рабочий диапазон при pH от 4 до 9. Фторид-селективный электрод - один из самых лучших ионоселективных электродов Его с успехом применяют для определения фторидов, что чрезвычайно сложно сделать с помощью других методов.
Для минимизации помех при работе с фторид-селективным электродом полезно использовать раствор, содержащий ацетатную буферную смесь с pH 5,0-5,5 М NaCl и циклогесилендинитрилтетрауксусную кислоту (ЦДТА). Если этим раствором разбавить в соотношении 1:1 стандартные и анализируемые растворы, величина ионной силы этих растворов будет практически одинаковой и большой, а за счет этого и потенциал жидкостного соединения, и коэффициент активности фторид-иона будут постоянными для всех растворов. Указанная буферная смесь создает pH, при котором не образуются заметные количества HF и отсутствует отклик электрода на гидроксид ион. ЦДТА, является комплексообразующим лигандом и поэтому маскирует такие многозарядные ионы, как Al3+, Fe3+ и Si4+, реагирующие с F- и изменяющие его активность.
Широко используемыми электродами данного типа является электрод с мембраной из Ag2S. Этот электрод селективен и по отношению к иону Ag+, и к иону S2- до концентрации порядка 1*10-8 М, хотя судя по величине растворимости Ag2S (Ks≈10-51) можно было ожидать более низкого предела обнаружения. Скорее всего это связано с трудностями приготовления таких разбавленных растворов, а также адсорбцией (и десорбцией) ионов на поверхности электрода и стенках сосудов, содержащих эти растворы. Мембрана обладает хорошо ионной проводимостью и низким сопротивлением, поэтому из смеси Ag2S и другой соли серебра или сульфида другого металла, сопротивление которых может быть достаточно высоким, можно приготовить мембрану электрода, селективного к этим ионам. Например, электрод с мембраной AgI/ Ag2S, кроме ионов Ag+ и S2-, обладает откликом на ион I-, а смесь CuS/ Ag2S можно использовать для изготовления электрода, селективного к ионам Cu2+.
Главное ограничение при изготовлении электродов с поликристаллическими мембранами на основе смеси солей связано с тем, что растворимость второй соли должна быть существенно выше растворимости Ag2S, но все же достаточно низкой, поскольку в противном случае снизится чувствительность определения. Пока такая мембрана содержит достаточно Ag2S для обеспечения электропроводности, обусловленной ионами серебра, электрод дает отклик на ионы Ag+. В этом случае отклик на определяемый ион возникает за счет его участия в равновесиях. Таким образом концентрация ионов серебра определяется равновесием осадок-раствор. Известны и другие электроды с поликристаллическими мембранами содержащими Ag2S – это электроды для определения 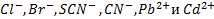 .Определению, конечно, будут мешать ионы, реагирующие с Ag+ (в случае анионоселективных электродов) или с S2 (для катионоселективных).
.Определению, конечно, будут мешать ионы, реагирующие с Ag+ (в случае анионоселективных электродов) или с S2 (для катионоселективных).
Дата: 2019-11-01, просмотров: 415.