Гальванический элемент.
Рассмотрим окс. -вост. Реакцию в гальваническом элементе.
|
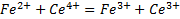
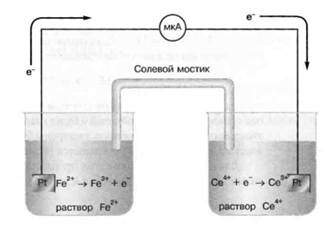
Поместим в каждый из сосудов инертные платиновые проволочки и соединим их, в результате получим гальванический элемент. С помощью микроамперметра можно обнаружить ток во внешней цепи. На одном из платиновых электродов (на аноде) окисляется 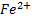
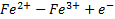
Высвобожденные электроны по внешнему проводнику (токоотводу) переходят на платиновый электрод (катод), находящийся в другом сосуде, на нем восстанавливается 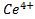 .
.
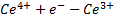
Протекающий процесс обусловлен способностью этих ионов обмениваться электронами, суммарный результат выражается реакцией(выше) , которая протекала бы и в том случае, если бы ноны 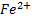 и
и 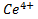 находились в одном сосуде. Платиновые проволочки служат электродами. Потенциал каждого из них обусловлен способностью ионов отдавать или принимать электроны и называется электродным потенциалом. С помощью вольтметра во внешней цепи можно измерять разность потенциалов этих двух электродов. Она тем больше, чем выше способность
находились в одном сосуде. Платиновые проволочки служат электродами. Потенциал каждого из них обусловлен способностью ионов отдавать или принимать электроны и называется электродным потенциалом. С помощью вольтметра во внешней цепи можно измерять разность потенциалов этих двух электродов. Она тем больше, чем выше способность 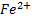 и
и 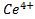 реагировать между собой. Движущую силу химической реакции (разность потенциалов) можно использовать, например, для освещенияс помощью электрической лампочки или для запуска мотора, как это и делают с помощью аккумулятора.
реагировать между собой. Движущую силу химической реакции (разность потенциалов) можно использовать, например, для освещенияс помощью электрической лампочки или для запуска мотора, как это и делают с помощью аккумулятора.
2.Электрод сравнения и измерительные электроды. Их называние, требование к электродам.
Стандартным электродом сравнения служит стандартный водородный электрод. Это газовый электрод, состоящий из платиновой проволоки, покрытой слоем платиновой черни, находящийся в атмосфере водорода под давлением 1 атм (1, 013 ·10^5 Па) и погруженный в водный раствор с активностью ионов 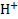 , равной 1 моль/ л. В соответствии с международным соглашением потенциал стандартного водородного электрода условно принят за нуль:
, равной 1 моль/ л. В соответствии с международным соглашением потенциал стандартного водородного электрода условно принят за нуль:
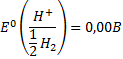
Все табличные значения стандартных электродных потенциалов измерены относительно стандартного водородного электрода. Однако практическое применение стандартного водородного электрода имеет ряд очевидных неудобств. Поэтому на практике в качестве электродов сравнения обычно используют другие электроды или хлоридсеребряный электроды.
Электроды сравнения должны обладать устойчивым во времени воспроизводимым потенциалом, не меняющимся при прохождении небольшого тока. Чаще всего в качестве электродов сравнения применяют электроды второго рода: хлорсеребряный и каломельный.
|
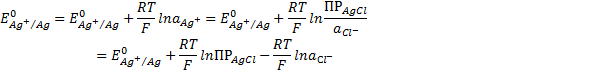
Первые два слагаемых зависят только от температуры :
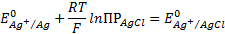
При сочетании этого уравнения получаем
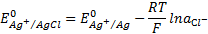
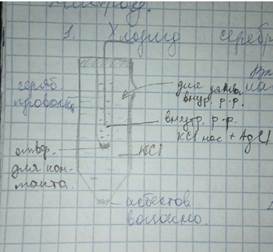
Как видно, потенциал хлорсеребряного электрода определяется активностью хлорид-иона в растворе. Обычно используется насыщенный раствор КСI. Потенциал электрода второго рода, вообще
говоря, зависит от активности аниона малорастворимого соединения, входящего в состав электрода.
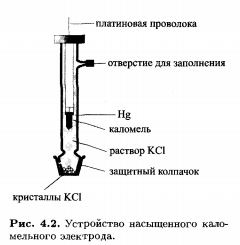
Каломельный электрод состоит из металлической ртути, каломели и раствора КСI. Его потенциал также зависит от активности хлорид-ионов:
|
Точное значение потенциала электрода сравнения для многих потенциометрических измерений часто не требуется, важно лишь его постоянство. Однако его значение необходимо при выполнении таких измерений, когда представляет интерес не только ЭДС, но и потенциал индикаторного электрода. Если нет особых оговорок, потенциал индикаторного электрода обычно пересчитывается и относится к стандартному водородному электроду. Эта величина, конечно, уже не зависит от выбранного электрода сравнения.
Общее понятие об электрохимических ячейках. Гальванический элемент. Электролитическая ячейка.
|
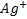 и
и 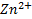 которые разделены диафрагмой для того, чтобы обеспечить возможность протекания тока без смешения растворов. В каждый из растворов погружен электрод, изготовленный из соответствующего металла (серебра, цинка). Схематическое устройство такой ячейки изображено.
которые разделены диафрагмой для того, чтобы обеспечить возможность протекания тока без смешения растворов. В каждый из растворов погружен электрод, изготовленный из соответствующего металла (серебра, цинка). Схематическое устройство такой ячейки изображено.
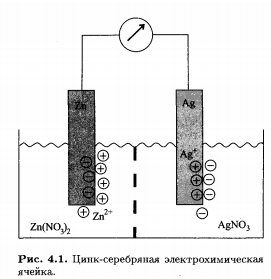
Электрохимической ячейкой называется многофазная система, состоящая по меньшей мере из двух полуэлементов, в которых жидкие фазы находятся между собой в электролитическом контакте. Границу раздела твердой и жидкой фаз обычно обозначают символом «|», а электролитический контакт двух жидких фаз- символом «||». Таким образом, схему рассматриваемой ячейки можно представить в следующем виде
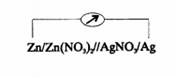
Суммарная электрохимическая реакция, протекающая в ячейке, складывается из двух процессов, происходящих в каждом из полуэлементов:
2 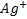 + Zn =2Ag +
+ Zn =2Ag + 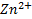
Направление самопроизвольного протекания этого процесса в стандартных условиях можно определить из величин стандартных электродных (окислительно-восстановительных) потенциалов соответствующих электрохимических пар.
Существуют два вида электрохимических ячеек -гальванические элементы и электролитические ячейки. В гальваническом элементе самопроизвольно протекает химическая реакция, в результате чего он является источником электрической энергии. Типичные примеры— свинцовая батарея и обычный карманный фонарик (электрическая энергия вырабатывается лишь при замыкании цепи, как например, при включении карманного фонарика). Напряжение ячейки (например, батарейки) определяется разностью потенциалов двух полурeакций. По мере протекания реакции ячейка истощается и ее потенциал приближается к нулю (батарейка садится). В электролитической ячейке, наоборот, электрическая энергия внешнего источника напряжения необходима для протекания несамопроизвольной химической реакции в направлении противоположном по сравнению с реакцией в гальваническом элементе. Примером может служить электролиз воды. В ячейках обоих типов электрод, на котором происходит окисление, называют анодом, а электрод, на котором идет восстановление, — катодом. Гальванические элементы применяют в потенциометрии (это обсуждается в двух следующих главах). Электролитические ячейки используют в таких электрохимических методах, как вольтамперометрия. Электроактивные вещества, например, ионы металла, восстанавливаются на электроде, и при соответствующем потенциале в результате несамопроизвольной реакции протекает ток, величина которого пропорциональна концентрации электроактивного вещества.
Гальванический элемент.
Рассмотрим окс. -вост. Реакцию в гальваническом элементе.
|
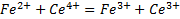

Поместим в каждый из сосудов инертные платиновые проволочки и соединим их, в результате получим гальванический элемент. С помощью микроамперметра можно обнаружить ток во внешней цепи. На одном из платиновых электродов (на аноде) окисляется 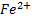
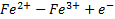
Высвобожденные электроны по внешнему проводнику (токоотводу) переходят на платиновый электрод (катод), находящийся в другом сосуде, на нем восстанавливается 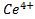 .
.
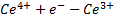
Протекающий процесс обусловлен способностью этих ионов обмениваться электронами, суммарный результат выражается реакцией(выше) , которая протекала бы и в том случае, если бы ноны 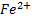 и
и 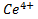 находились в одном сосуде. Платиновые проволочки служат электродами. Потенциал каждого из них обусловлен способностью ионов отдавать или принимать электроны и называется электродным потенциалом. С помощью вольтметра во внешней цепи можно измерять разность потенциалов этих двух электродов. Она тем больше, чем выше способность
находились в одном сосуде. Платиновые проволочки служат электродами. Потенциал каждого из них обусловлен способностью ионов отдавать или принимать электроны и называется электродным потенциалом. С помощью вольтметра во внешней цепи можно измерять разность потенциалов этих двух электродов. Она тем больше, чем выше способность 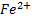 и
и 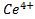 реагировать между собой. Движущую силу химической реакции (разность потенциалов) можно использовать, например, для освещенияс помощью электрической лампочки или для запуска мотора, как это и делают с помощью аккумулятора.
реагировать между собой. Движущую силу химической реакции (разность потенциалов) можно использовать, например, для освещенияс помощью электрической лампочки или для запуска мотора, как это и делают с помощью аккумулятора.
2.Электрод сравнения и измерительные электроды. Их называние, требование к электродам.
Стандартным электродом сравнения служит стандартный водородный электрод. Это газовый электрод, состоящий из платиновой проволоки, покрытой слоем платиновой черни, находящийся в атмосфере водорода под давлением 1 атм (1, 013 ·10^5 Па) и погруженный в водный раствор с активностью ионов 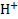 , равной 1 моль/ л. В соответствии с международным соглашением потенциал стандартного водородного электрода условно принят за нуль:
, равной 1 моль/ л. В соответствии с международным соглашением потенциал стандартного водородного электрода условно принят за нуль:
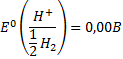
Все табличные значения стандартных электродных потенциалов измерены относительно стандартного водородного электрода. Однако практическое применение стандартного водородного электрода имеет ряд очевидных неудобств. Поэтому на практике в качестве электродов сравнения обычно используют другие электроды или хлоридсеребряный электроды.
Электроды сравнения должны обладать устойчивым во времени воспроизводимым потенциалом, не меняющимся при прохождении небольшого тока. Чаще всего в качестве электродов сравнения применяют электроды второго рода: хлорсеребряный и каломельный.
|

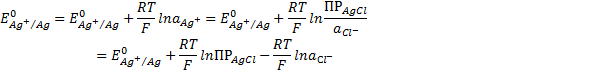
Первые два слагаемых зависят только от температуры :
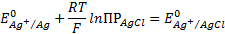
При сочетании этого уравнения получаем
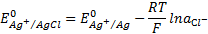
Как видно, потенциал хлорсеребряного электрода определяется активностью хлорид-иона в растворе. Обычно используется насыщенный раствор КСI. Потенциал электрода второго рода, вообще
говоря, зависит от активности аниона малорастворимого соединения, входящего в состав электрода.
Каломельный электрод состоит из металлической ртути, каломели и раствора КСI. Его потенциал также зависит от активности хлорид-ионов:
|

Точное значение потенциала электрода сравнения для многих потенциометрических измерений часто не требуется, важно лишь его постоянство. Однако его значение необходимо при выполнении таких измерений, когда представляет интерес не только ЭДС, но и потенциал индикаторного электрода. Если нет особых оговорок, потенциал индикаторного электрода обычно пересчитывается и относится к стандартному водородному электроду. Эта величина, конечно, уже не зависит от выбранного электрода сравнения.
Дата: 2019-11-01, просмотров: 479.
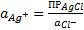 .
Подставляем эту величину в уравнение Нернста для серебряного электрода:
.
Подставляем эту величину в уравнение Нернста для серебряного электрода:
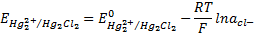 Где
Где
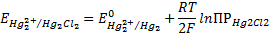 Потенциалы хлорсеребряного, каломельного и ряда других электродов сравнения изучены при различных концентрацион- ных и температурных условиях и их величины по отношению к стандартному водородному электроду хорошо известны.
Потенциалы хлорсеребряного, каломельного и ряда других электродов сравнения изучены при различных концентрацион- ных и температурных условиях и их величины по отношению к стандартному водородному электроду хорошо известны.
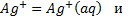
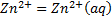 Между соответствующими ионами в фазах металла и раствора устанавливается равновесие. Каждая из двух систем, включающих металл и раствор соответствующего иона, называется полуэлементом. Каждый полуэлемент включает в себя две фазы, одна из которых характеризуется электронной, а другая - ионной проводимостью.
На границе раздела фаз полуэлемента происходит электродная реакция - процесс с участием компонентов обеих фаз, в результате которого осуществляется перенос ионов или электронов через границу раздела и, вследствие этого, протекание электрического тока.
Между соответствующими ионами в фазах металла и раствора устанавливается равновесие. Каждая из двух систем, включающих металл и раствор соответствующего иона, называется полуэлементом. Каждый полуэлемент включает в себя две фазы, одна из которых характеризуется электронной, а другая - ионной проводимостью.
На границе раздела фаз полуэлемента происходит электродная реакция - процесс с участием компонентов обеих фаз, в результате которого осуществляется перенос ионов или электронов через границу раздела и, вследствие этого, протекание электрического тока.