На практике в качестве электродов сравнения обычно используют другие электроды – например, каломельный или хлорсеребряный электроды. Их электродные потенциалы Е(В)постоянны и точно известны. Поэтому при необходимости из величины потенциала ЕВ, измеренной относительно электрода сравнения, можно всегда рассчитать соответствующую величину потенциала (Е) относительно стандартного водородного электрода как E = EB + E ( B ).
Электроды, на которых протекают окислительно-восстановительные процессы, называют металлическими. В зависимости от природы частиц – переносчиков заряда они подразделяются на инертные и активные. Активные электроды делятся на электроды 1-ого и 2-ого рода.
Инертные электроды
Инертным называется электрод, роль которого сводится к переносу электронов между частицами, находящимися в растворе. Таким электродом может служить платиновая проволока, погруженная в раствор соответствующего состава, например, содержащего ионы Fe+, Fe3+. В этом случае суммарная электродная реакция состоит из процессов переноса электронов из металла в раствор и последующего переноса электрона в растворе. Подобный электрод в принципе возможно себе представить применительно и к другим окислительно-восстановительным системам: Sn4+/Sn2+, Pb4+/Pb2+, 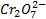 /Cr3+, MnO2, H+/Mn2+ (две последние системы являются
/Cr3+, MnO2, H+/Mn2+ (две последние системы являются 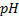 -зависимми).
-зависимми).
Активные электроды
Роль активных электродов – перенос через границу раздела фаз. Такие электроды, состоящие из металла, погруженного в раствор собственных ионов, называются электродами первого рода.
Электроды второго рода – это системы, в которых происходит перенос не собственных катионов материала электрода, а анионов, образующих с ионами металла малорастворимые или устойчивые комплексы. К электродам второго рода, в основе действия которых лежит образование малорастворимого соединения, относятся хлорсеребряный и каломельный электроды. Они имеют большое практическое значение, поскольку повсеместно используются в качестве электродов сравнения.
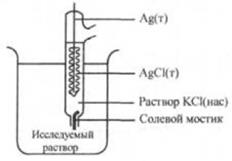
В общем виде схему этого типа электродов можно представить следующим образом M|MX|Xn-, где МХ – малорастворимая соль. Для электрода серебро-хлорид серебра (хлорсеребряного) Ag|AgCl(тв.) |Cl- .. Вертикальной линией обозначают границу раздела двух разных твердых фаз или твердой фазы раствора. Для соответствующей полуреакции

AgCl+e-⇄+Ag+ Cl- потенциал описывается уравнением
E= 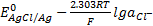 . (*)
. (*)
Этот электрод пригоден для измерения активности хлорид-ионов в растворе. С увеличением активности хлорид-ионов потенциал уменьшается. Это справедливо для любого электрода, пригодного для определения анионов. Серебряная проволока покрыта осадком AgCl (его получают, например, при электролитическом окислении серебра в растворе, содержащем хлорид-ионы, в соответствии с уравнением обратимой реакции AgCl+e-⇄+Ag+ Cl-). Но т. к серебряная проволока при погружении в раствор, содержащий хлорид-ионы, моментально покрывается тонким слоем AgCl, предварительной подготовки электрода обычно не требуется.
Электрод обычно применяют для измерения 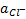 , но он пригоден и для измерения
, но он пригоден и для измерения 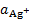 , которая определяется растворимостью малорастворимой соли. Т. к.
, которая определяется растворимостью малорастворимой соли. Т. к. 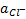 =
= 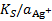 , уравнение (*) можно преобразовать следующим образом:
, уравнение (*) можно преобразовать следующим образом:
E= 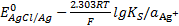 ,
,
E= 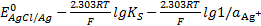 .
.
Сравнив полученное выражение с уравнением E = 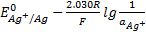 , видим, что
, видим, что
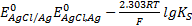 .(*)
.(*)
Фактически здесь под 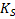 . Следует понимать термодинамическое произведение растворимости
. Следует понимать термодинамическое произведение растворимости 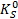 , поскольку при выводе уравнения использованы активности. Если в этом уравнении заменить
, поскольку при выводе уравнения использованы активности. Если в этом уравнении заменить 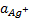 на
на 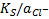 , можно получить другую форму уравнения (**).
, можно получить другую форму уравнения (**).
В растворе, содержащем смесь 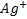 и
и 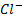 , например при титровании
, например при титровании 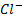 с помощью
с помощью 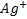 , их концентрации при равновесии таковы, что потенциал серебряного электрода, погруженного в этот раствор, можно, можно рассчитать по уравнению (*) и по уравнению (**). Это полностью согласуется с утверждением, что при равновесии потенциалы обеих полуреакцй равны. В данном случае полуреакции представлены Ag++e-⇄Ag и AgCl+e-⇄+Ag+ Cl-, и результатом вычитания одной из них из другой будет суммарная химическая реакция: Ag++ Cl-⇄ AgCl.
, их концентрации при равновесии таковы, что потенциал серебряного электрода, погруженного в этот раствор, можно, можно рассчитать по уравнению (*) и по уравнению (**). Это полностью согласуется с утверждением, что при равновесии потенциалы обеих полуреакцй равны. В данном случае полуреакции представлены Ag++e-⇄Ag и AgCl+e-⇄+Ag+ Cl-, и результатом вычитания одной из них из другой будет суммарная химическая реакция: Ag++ Cl-⇄ AgCl.
При титровании 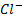 раствором
раствором 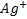 концентрация хлорид-ионов уменьшается, а ионов серебра – увеличивается. Из уравнения (*) видно, что потенциал увеличивается по мере уменьшения концентрации
концентрация хлорид-ионов уменьшается, а ионов серебра – увеличивается. Из уравнения (*) видно, что потенциал увеличивается по мере уменьшения концентрации 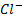 , п из уравнения E =
, п из уравнения E = 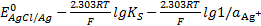 следует, что потенциал увеличивается с повышением концентрации
следует, что потенциал увеличивается с повышением концентрации 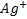 .
.
Серебряный электрод можно использовать для определения и других анионов, образующих с ионами 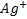 малорастворимые соединения, например,
малорастворимые соединения, например, 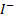 ,
, 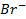 и
и 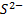 . Величина Е0 вкаждом конкретном случае определяется полуреакцией Ag Х+e-⇄+Ag+
. Величина Е0 вкаждом конкретном случае определяется полуреакцией Ag Х+e-⇄+Ag+ 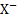 .
.

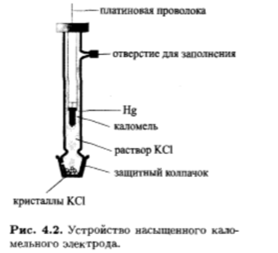
Для вывода уравнения, описывающего равновесный потенциал каломельного электрода, необходимо принять во внимание как собственно потенциалопределяющую стадию, так и равновесие осадок-раствор с участием Hg2Cl2.
Поскольку в потенциалопределяющей стадии участвуют ионы 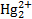 , то
, то
E=E0( 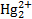 / Hg)+
/ Hg)+ 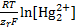 (1.1)
(1.1)
Для равновесия осадок-раствор Hg2Cl2⇄2 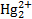 +2
+2 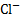 , произведение растворимости равно
, произведение растворимости равно
KL =[ 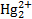 ][ Cl - ]2=10-17.96=1.10*10-18.
][ Cl - ]2=10-17.96=1.10*10-18.
Выразив концентрацию из последнего уравнения и подставив ее в уравнение (1.1), получим уравнение Нерста в виде E=E0( 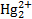 / Hg)+
/ Hg)+ 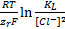 .
.
Таим образом, потенциал каломельного электрода зависит от концентрации хлорид-ионов.
4.Изобразите схематично ячейку, состоящую из насыщенного каломельного электрода (катод) и водородного электрода (анод), позволяющую измерять pH раствора.
Едва ли не самое известное применение прямой потенциометрии состоит в измерении рН при помощи стеклянного электрода. Стеклянный электрод состоит из корпуса, в который налит буферный раствор. В этот раствор погружен внутренний электрод сравнения- чаще всего хлоридсеребряный .
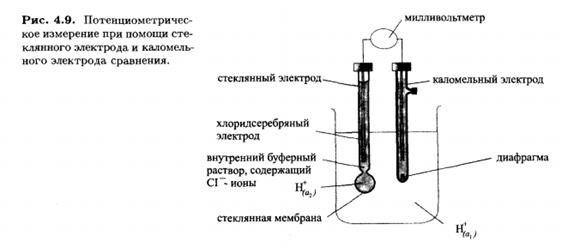
Нижняя шарообразная часть корпуса сделана из очень тонкого стекла и обычно называется стеклянной мембраной. Однако это не мембрана в обычном смысле слова, поскольку она непроницаема для компонентов раствора.
При контакте с раствором приповерхностный слой стекла выступает в роли ионообменника, обменивая катионы, находящиеся в пустотах силикатного каркаса, на ионы 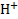 .Для того, чтобы мембрана электрода приобрела способность к такому обмену, ее следует предварительно вымочить в кислом растворе. Равновесное значение потенциала стеклянного электрода зависит от активностей ионов
.Для того, чтобы мембрана электрода приобрела способность к такому обмену, ее следует предварительно вымочить в кислом растворе. Равновесное значение потенциала стеклянного электрода зависит от активностей ионов 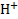 в анализируемом растворе (
в анализируемом растворе ( 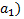 и внутреннем растворе электрода (
и внутреннем растворе электрода ( 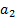 ). В первом приближении эта зависимость имеет вид
). В первом приближении эта зависимость имеет вид
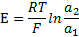
Поскольку активность ионов 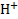 во внутреннем растворе (
во внутреннем растворе ( 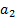 ) постоянна, то
) постоянна, то
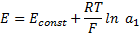
 Величина Econst зависит от значения рН внутреннего раствора, а также от потенциала асимметрии стеклянной мембраны. На практике угол наклона градуиравочной зависимости может отличаться от теоретического значения. В этих случаях в уравнение вводят эмпирическую поправку k-коэффициент крутизны.
Величина Econst зависит от значения рН внутреннего раствора, а также от потенциала асимметрии стеклянной мембраны. На практике угол наклона градуиравочной зависимости может отличаться от теоретического значения. В этих случаях в уравнение вводят эмпирическую поправку k-коэффициент крутизны.
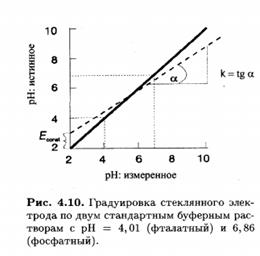
Стеклянные электроды позволяют с высокой точностью измерять значения рН от 1 до 10. На краях этого диапазона рН наклон градуировочной зависимости несколько ниже теоретического. При рН< 1 возникает кислотная погрешность, величина которой зависит от сорта стекла, использованного для изготовления мембраны. При рН > 10 электрод становится чувствительным к ионам щелочных металлов, вследствие чего возникает щелочная погрешность . Существуют сорта стекла (в частности, на основе Li2 0-Ba0-La20 3-Si02 ), для которых рабочий диапазон рН более широкий как в кислой, так и в щелочной области. С другой стороны, чувствительность стеклянной мембраны к ионам натрия и калия можно использовать для создания специальных сортов стекол и разработке на их основе электродов для определения этих ионов.
(Допп инфа .)
(Поскольку 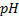 =- lg
=- lg 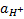 , а уравнение (1) можно представить в виде
, а уравнение (1) можно представить в виде
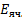 =k-
=k- 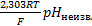 (3),
(3),
или
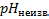 =
= 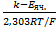 ( 4).
( 4).
Видно, что отклик стеклянного электрода при измерении 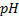 на 1 единицу (или на 10-кратное изменение
на 1 единицу (или на 10-кратное изменение 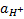 ) составляет
) составляет 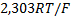 .величину
.величину 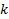 можно оценить при градуировке электрода по стандартным буферным смесям с известным
можно оценить при градуировке электрода по стандартным буферным смесям с известным 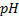 .
.
k= 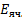 +
+ 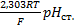 (5)
(5)
При подстановке уравнения (5) и (3) получаем
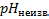 =
= 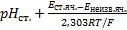
При вычислении 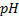 подобные вычисления не производят, поскольку шкалу -метра калибруют в единицах
подобные вычисления не производят, поскольку шкалу -метра калибруют в единицах 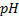 . Поскольку для измерения
. Поскольку для измерения 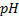 применяют мембранный электрод с очень высоким сопротивлением (1-100МОм), очень важно свести к минимуму падение напряжения i / R Для этого используют
применяют мембранный электрод с очень высоким сопротивлением (1-100МОм), очень важно свести к минимуму падение напряжения i / R Для этого используют 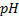 -метр, способный работать при протекании очень слабых токов.
-метр, способный работать при протекании очень слабых токов.
Дата: 2019-11-01, просмотров: 998.