Основы биологической химии
Курс лекций
для
иностранных студентов направления
«Педагогическое образование»
Профилей «Химия», «Биология», «Естествознание»
Воронеж
ВГПУ
2019
УДК 577.1 (076.5)
ББК 28.072 я 7
М54
С о с т а в и т е л ь:
канд. техн. наук, доц. каф. химии Н.И.Кочергина
Р е ц е н з е н т ы:
канд. биол. наук, доц. каф. биохимии и биотехнологии Г.П.Шуваева (ВГУИТ)
докт. биол. наук, проф. каф. биологии растений и животных И.Д.Свистова (ВГПУ)
Основы биологической химии: курс лекций для иностранных студентов направления Педагогическое образование профилей «Химия», «Биология», «Естествознание» - Воронеж: ВГПУ, 2019 -151 с.
Пособие включает краткое содержание тем учебной программы по биологической химии
УДК 577.1 (076.5)
ББК 28.072 я 7
Учебное издание
Основы биологической химии
курс лекций для иностранных студентов направления Педагогическое образование профилей «Химия», «Биология», «Естествознание»
С о с т а в и т е л ь: канд. техн. наук, доц. каф. химии Н.И.Кочергина
…
Природа неисчерпаема: первейший ее
принцип – это организация.
Соединяя два объекта, природа всегда
образует нечто новое, с новыми свойствами,
которые нельзя выразить через
свойства компонентов.
Альберт Сент-Дьёрдьи
ПРЕДИСЛОВИЕ
Изучение курса биологической химии способствует более глубокому усвоению студентами естественно-географического факультета специальных биологических дисциплин.
Программа по данному предмету предусматривает изучение основных классов биомолекул, их взаимосвязи, а также закономерности протекания обменных процессов. Динамическая биохимия включает вопросы биоэнергетики и биокатализа, анаболизма и катаболизма углеводов, нуклеиновых кислот, белков, жиров и сопряженные с ними биоэнергетические процессы. В анаболизме нуклеиновых кислот и белков особое внимание обращено на вопросы, связанные с важнейшей проблемой молекулярной биологии – переносом генетической информации. При освещении вопросов биоэнергетики рассматриваются строение, функции и свойства макроэргических соединений, особенно АТФ.
Учебное пособие содержит краткое содержание темы, задачи и тесты.
Предлагаемые задания по изучаемым темам преследуют цель выявить умения студентов работать с учебной литературой, самостоятельно отбирать, анализировать и обобщать материал, грамотно отвечать на поставленные вопросы, владеть химической символикой.
Основной целью издания является развитие у студентов умения использовать знания, полученные при изучении курса биоорганической химии, изучение метаболических процессов, происходящих в живых организмах, рассмотрение взаимосвязей этих процессов.
Настоящее методическое пособие поможет студентам в самостоятельной подготовке к семинарским занятиям. Работа с тестами будет способствовать укреплению знаний по биохимии, концентрации внимания студентов на основных моментах изучаемого материала.
Данное учебно-методическое пособие поможет студентам освоить необходимые компетенции и результатом изучения дисциплины биологическая химия станут следующие знания, умения, навыки:
знания
- компонентов современной естественнонаучной картины мира,
- основных этапов развития естествознания, специфики живого;
- биохимическихоснов единства органического мира, молекулярныхоснов наследственности и изменчивости;
- механизмов регуляции метаболических процессов в процессе жизнедеятельности организма;
- методов теоретического и эмпирического исследований в естественных науках;
биохимическихвопросов и объема материала, который входит в содержание школьных курсов химии и биологии;
умения:
- использовать методы теоретического и эмпирического исследований при проектировании учебного процесса в естественнонаучном образовании;
- показывать взаимосвязь биохимических процессов, протекающих в живых системах; роль мультиэнзимных систем в биохимических процессах;
- объяснять процессы метаболизма биомолекул в живых организмах; пути передачи наследственной информации, регуляции обменных процессов в живых системах;
- связать усвоение биохимического содержания с усвоением методов, форм и средств его преподавания в школе;
навыки:
- самостоятельно выбирать цель исследования, формулировать проблему и гипотезу исследования;
- проведения простейшего химического эксперимента при изучении химических свойств биомолекул.
Тема «АМИНОКИСЛОТЫ. БЕЛКИ»
Белки – высокомолекулярные азотистые органические соединения, состоящие на 99% и более из химических элементов – углерода, кислорода, азота и водорода.
Впервые белок был выделен Я.Беккари из пшеничной муки в 1728 г. К настоящему времени из природных источников выделены и изучены сотни различных белков.
Белки – важнейшие незаменимые компоненты живого. Белковые тела играют решающую роль и в построении живой материи, и в осуществлении всех процессов жизнедеятельности. «Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким – либо белковым телом, и повсюду, где мы встречаем какое – либо белковое тело, которое не находится в процессе разложения, мы без исключения встречаем и явления жизни» (Энгельс Ф. Анти-Дюринг)
На долю белков приходится основная масса сухого вещества (55 – 85%) активно растущей клетки. В самой маленькой и просто устроенной бактериальной клетке обнаружено более 2000 различных белков, выполняющих самые разнообразные функции.
Структурными единицами (блоками) служат аминокислоты. В состав белков входят 20 типов аминокислот, носящих название белковых аминокислот (протеиногенных)
Аминокислоты – амфотерные электролиты, каждая из них имеет характерную изоэлектрическую точку. На электрохимических свойствах аминокислот основано их разделение методами электрофореза, ионообменной хроматографии, электрофокусирования. В результате наличия в аминокислотах a-аминогруппы они обладают высокой реакционной способностью. Специфические реакции аминокислот нашли широкое применение в методах количественного определения.
Определенная последовательность аминокислот в белках обуславливает их физико-химические свойства и биологическую функцию. 20 аминокислот при их разнообразном сочетании и повторяемости в полипептидной цепи дают практически неограниченные возможности для синтеза самых различных белков.
По значению для животных и человека аминокислоты разделяют на заменимые и незаменимые (табл. 1).
Таблица 1
Значение аминокислот для животных и человека
| Незаменимые аминокислоты | Частично заменимые | Заменимые аминокислоты |
| валин | аргинин | аспарагиновая кислота |
| гистидин | глицин | глутаминовая кислота |
| изолейцин | цистин | аланин |
| лейцин | тирозин | серин |
| лизин | пролин | |
| метионин | оксипролин | |
| треонин | цистеин | |
| триптофан | ||
| фенилаланин |
Определенная последовательность аминокислот в белках обусловливает их физико-химические свойства и биологическую функцию. 20 типов белковых аминокислот при их разнообразном сочетании и повторяемости в полипептидной цепи дают практически неограниченные возможности для синтеза самых различных белков.
Аминокислоты, входящие в состав белка, придают ему специфические электрохимические свойства, которые обусловливают их гидрофильность, растворимость и осаждаемость из растворов.
Белки – высокомолекулярные азотистые органические соединения, состоящие на 99% и более из химических элементов – углерода, кислорода, азота и водорода. Эти элементы способны к образованию ковалентных связей, обуславливают прочность белковых структур, а углерод с его способностью к созданию конъюгированных соединений является основой возникновения в белке каталитических функций, играющих важную роль в обмене веществ живой клетки.
Классификация белков
В связи с огромным разнообразием белков, различием их физических, химических свойств и биологических функций вопрос о классификации и номенклатуре белков разработан далеко не полностью, т.е. строго научная классификация пока отсутствует.
По степени сложности белки делят на две группы: простые – протеины и сложные – протеиды.
Протеины. К простым белкам относятся альбумины, глобулины, проламины, глютелины, гистоны, протамины, протеноиды. В основу классификации положены растворимость в специфических растворителях и некоторые химические свойства (основность, кислотность). По своим функциям они разнообразны. Протеины – важнейшие компоненты пищевых продуктов.
Сложные белки. В зависимости от природы небелковой части (простетической группы) они делятся на гликопротеины, липопротеины, хромопротеины, фосфопротеины, металлопротеины, нуклеопротеины. Фактически многие из этих белков представляют комплексы смешанных макромолекул. Отрыв простетической группы приводит к понижению стабильности белкового компонента, а часто к его денатурации.
По форме молекулы белки делят на волокнистые (фибриллярные) и корпускулярные (глобулярные). Подавляющее число природных белков являются корпускулярными.
По выполняемым функциям белки делят на следующие группы: каталитически активные, белки – гормоны, регуляторные, токсические, транспортные, структурные, защитные, сократительные, рецепторные, белки – ингибиторы ферментов, белки вирусных оболочек, белки с иными функциями.
Задания для самостоятельного изучения
1. Методы определения последовательности аминокислот в пептидах (метод Сенгера, метод Эдмана, метод Акабори, метод хроматографии).
2. Методы определения аминокислотного состава белка:
а) метод высаливания;
б) распределительная (бумажная) хроматография;
в) ионно-обменная хроматография;
г) афинная хроматография;
д) метод гель-фильтрации;
е) метод электрофореза.
3. Классификация белков:
Cложные белки:
а) флавопротеины;
б) нуклеопротеины;
в) липопротеины;
г) фосфопротеины;
д) гликопротеины;
е) металлопротеины.
Простые белки:
а) протамины;
б) гистоны;
в) альбумины;
г) глобулины;
д) проламины;
е) протеноиды.
Тема «НУКЛЕИНОВЫЕ КИСЛОТЫ»
Нуклеиновые кислоты - это высокомолекулярные соединения, характеризующиеся определенным элементарным составом и распадающиеся при гидролизе на азотистые основания, пентозу и фосфорную кислоту.
Нуклеиновые кислоты были открыты в 1868 г. швейцарским врачом Ф. Мишером, который получил из лейкоцитов и спермы рыб вещество небелковой природы с высоким содержанием фосфора и назвал его нуклеином (лат. nucleus – ядро).
Нуклеиновые кислоты выполняют в организме ряд важнейших функций. Они обеспечивают хранение и передачу генетической информации, и они же участвуют в тех механизмах, при помощи которых эта информация реализуется в процессе синтеза всех клеточных белков.
Структурными блоками гигантских молекул нуклеиновых кислот являются нуклеотиды. Каждый нуклеотид содержит три различных компонента: азотистое (пуриновое или пиримидиновое) основание, моносахарид пентозу (рибозу или дезоксирибозу), остаток фосфорной кислоты. Эти компоненты соединены друг с другом в такой последовательности: азотистое основание – пентоза – фосфат. Соседние нуклеотиды соединены друг с другом посредством эфирной связи между моносахаридом и фосфатом другого нуклеотида.
Гидролиз нуклеиновых кислот, выделенных из ядер клеток, показал, что они состоят из пуриновых (аденин, гуанин) и пиримидиновых оснований (цитозин, тимин), дезоксирибозы и фосфорной кислоты. Эта кислота была названа дезоксирибонуклеиновой (ДНК). Из дрожжей была получена другая нуклеиновая кислота, содержащая вместо дезоксирибозы рибозу. Ее назвали рибонуклеиновой кислотой (РНК). В нее входят основания – аденин, урацил, цитозин и гуанин.
Жирорастворимые витамины
Витамин А представляет собой группу витамеров – ретинол, ретиналь, ретиноевую кислоту. Это витамин роста детей. Первым признаком его недостатка является ночная (куриная) слепота, поражение кожи. Содержится в животной пище; в растениях широко распространены провитамины А – каротины.
Витамин D включает в себя группу витаминов – кальциферолов, обладающих антирахитическим действием. Содержится лишь в животных продуктах. Особенно много его в жире, выделенном из печени морских животных и рыб. В растениях и особенно в дрожжах встречается эргостерол, который под действием УФ-лучей превращается в витамин D2. В подкожном жире человека и животных содержится 7–дегидрохолестерол, который под действием УФ-лучей превращается в витамин D3.
Витамин Е – антиоксидант; представляет собой группу витамеров – токоферолов. Недостаток токоферолов ведет к нарушению функционирования клеточных мембран в результате нарушения их структуры под действием реактивно активных форм кислорода. В большом количестве витамин Е содержится в масле из пшеничных зародышей; из пищевых продуктов им богаты растительные масла.
Витамин К принимает участие в свертывании крови; в него входят два витамера К1 и К2. Витамер К1 встречается преимущественно в зеленых частях растений; витамер К2 синтезируется микроорганизмами.
Водорастворимые витамины
К водорастворимым витаминам группы В относятся витамины В1,В2, РР, В6, пантотеновая кислота (В3), Вс, В12. Биологические функции витаминов группы В на молекулярном уровне хорошо известны. За исключением витамина В12, эти витамины имеют один общий признак – они содержатся в достаточно больших количествах в пшеничных, рисовых отрубях и дрожжах. Водорастворимые витамины играют важную роль в регуляции белкового углеводного, жирового обменов веществ в организме; являются факторами роста детей, молодых животных, птиц, микроорганизмов. Они входят в состав ферментов, играющих ключевую роль в метаболизме веществ клетки.
В обмене веществ важна роль витамина С, его недостаток ведет к тяжелому заболеванию – цинге. В водных растворах аскорбиновая кислота неустойчива, быстро окисляется до дегидроаскорбиновой кислоты, которая обладает такой же витаминной активностью, как и аскорбиновая. Биологические функции витамина С разнообразны. Витамин С содержится в овощах, фруктах, ягодах. Особенно им богаты плоды шиповника, черная смородина, черноплодная рябина, перец, петрушка, белокочанная капуста. При сушке и консервировании овощей и плодов витамин С легко разрушается.
Биотин (витамин Н) необходим для функционирования ферментов.
Близкими к витаминам являются витаминоподобные вещества (п-аминобензойная кислота, инозит, оротовая и липоевая кислоты) Эти соединения похожи на витамины, хотя их функционирование в качестве витаминов не доказано. Требуются они человеку в гораздо больших количествах, чем витамины.
С целью повышения биологической ценности пищевых продуктов их обогащают витаминами. В пищевой продукт чаще всего вносят витамины С и В, которые в большинстве случаев являются дефицитом в питании человека.
Таблица 3
Таблица 4
Таблица 5
Свойства ферментов
Будучи белками, ферменты обладают всеми их свойствами. В то же время ферменты обладают рядом специфических качеств, вытекающих из их белковой природы. Эти качества отличают ферменты от обычных катализаторов. К ним относятся: термолабильность, зависимость от рН-среды, специфичность и подверженность влиянию активаторов и ингибиторов.
1. Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя ее к денатурации при высоких температурах, а с другой стороны, оказывает влияние на скорость образования фермент-субстратного комплекса и все последующие процессы, приводящие к увеличению скорости реакции. Температура, при которой каталитическая активность фермента максимальная, называют его температурным оптимумом. Как правило, для ферментов животного происхождения температурный оптимум лежит в интервале 40– 50о С, а растительного – 50– 60 о С.
2. Для каждого фермента существует оптимальное значение рН среды – рН – оптимум, при котором фермент проявляет максимальную активность. Большинство ферментов максимально активны в нейтральной среде. В сильнокислой или сильнощелочной среде хорошо работают лишь некоторые ферменты. Влияние концентрации ионов Н+ на каталитическую активность ферментов состоит в воздействии их на активный центр. При разных значениях рН активный центр может быть в большей или меньшей степени ионизирован, экранирован соседними фрагментами полипептидной цепи белковой части фермента. Кроме того показатель рН влияет на степень ионизации субстрата, фермент – субстратного комплекса и продуктов реакции.
3. Специфичность – одно из наиболее важных свойств ферментов – избирательно действовать на субстрат и определять путь его превращения.
Специфичность ферментов объясняется динамическим соответствием пространственных конфигураций субстрата и субстратного центра фермента в процессе их взаимодействия.
Для ферментов характерна абсолютная (ускоряют только одну реакцию), относительная (групповая) (осуществляют катализ реакций определенноготипа независимо от индивидуальной природы реагирующих веществ) и стереохимическая (фермент действует только на один пространственный изомер) специфичность.
4. На активность фермента большое влияние оказывают активаторы – химические соединения, повышающие действие ферментов, и ингибиторы – специфические химические соединения, подавляющие их активность.
К числу активаторов, повышающих активность ферментов, относятся ионы многих металлов (Mg2+, Mn2+, Zn2+,K+) и некоторые анионы (Cl-).
Процесс ингибирования может быть обратимым и необратимым. Механизмы ингибирующего действия могут быть различны, но в большинстве случаев сводятся к двум видам конкурентному, неконкурентному. При конкурентном ингибировании, ингибитор, обладающий структурным сходством с субстратом, соединяется с ферментом, подменяя субстрат, конкурируя с ним. Поскольку часть фермента расходуется на образования комплекса фермент – ингибитор, количество образующегося фермент – субстратного комплекса снижается. Примером конкурентного ингибирования является ингибирование действия фермента сукцинатдегидрогеназы избытком щавелевоуксусной кислоты в цикле Кребса.
При неконкурентном ингибировании ингибитор не похож на субстрат и взаимодействует с ферментным белком или простетической группой, в результате чего фермент теряет активность.
Классификация ферментов осуществлена по типам реакций, которые они катализируют. Согласно этому принципу все ферменты делят на шесть классов:
· оксидоредуктазы, катализирующие окислительно-восстановительные реакции;
· трансферазы, переносящие различные химические группы от одного соединения к другому;
· гидролазы, расщепляющие субстраты с участием воды;
· лиазы – ферменты, осуществляющие реакции присоединения групп по двойным связям и обратные реакции;
· изомеразы – переводящие соединение в его изомер;
· лигазы – ферменты синтеза.
БИОЭНЕРГЕТИКА КЛЕТКИ»
Обмен веществ или метаболизм – это сложная цепь биохимических реакций, заключающаяся в усвоении веществ из окружающей среды, сложных превращений в организме и выделении в окружающую среду продуктов расщепления этих веществ. Все реакции обмена веществ – это ферментативные реакции. Обмен веществ является источником энергии всех жизненных процессов. Обмен веществ обеспечивает процессы роста и развития, самообновление всех клеточных структур, энергообеспечение функций, постоянство внутренней среды. Поэтому при прекращении обмена веществ нарушается или прекращается жизнедеятельность организма.
Основу обмена веществ в клетке составляют:
· Химические превращения веществ, поступающих в организм;
· Изменение их энергетических свойств;
· Информационное взаимодействие отдельных элементов биологической системы.
Химические превращения веществ в организме объединяют два неразрывно связанных между собой и противоположных по направленности процесса – анаболизм и катаболизм
Анаболизм (ассимиляция, биосинтез) – это фаза, в которой из простых веществ синтезируются новые, необходимые клетке биомолекулы. Процесс требует затрат энергии.
Катаболизм (диссимиляция) – это фаза, в которой происходит расщепление сложных органических молекул до простых. Углеводы, белки, жиры, поступающие в клетку, распадаются до углекислого газа, аммиака, воды, молочной кислоты. При распаде этих веществ выделяется энергия, которую называют свободной.
Свободная энергия является частью внутренней энергии (энтальпии), которая может быть превращена в полезную работу. Высокий уровень свободной энергии присущ потенциально неустойчивым системам, которые могут переходить на более низкий уровень этой энергии; изменение свободной энергии (ее убыль) будет отрицательным, а реакция называется экзергонической. Напротив, биохимические реакции, требующие затраты энергии, характеризуются переходом веществ из устойчивого состояния с низкой свободной энергией к менее устойчивому состоянию с большой свободной энергией. Изменение свободной энергии (ее приход) будет положительным. Такие реакции называются эндергоническими.
Для большинства биохимических реакций энтальпия близка к свободной энергии. Этим определяется калорийность пищи как приближенной меры работы, совершаемой в результате усвоения пищи организмом.
Важную роль в передаче химической энергии внутри клетки играют вещества, известные под названием высокоэнергетических (макроэргических) соединений, при превращении их освобождается большое количество энергии, расходуемое на различные процессы жизнедеятельности. К числу таких соединений относится обширный класс фосфоорганических соединений. Центральное место среди них занимает АТФ (аденозинтрифосфат). АТФ занимает промежуточное положение между высокоэнергетическими и низкоэнергетическими веществами и выполняет роль посредника в передаче энергии от высокоэнергетического к низкоэнергетическому соединению, что имеет большое значение в синтезе белков, нуклеиновых кислот, углеводов.
АТФ был впервые получен К.Лиманом в 1929 году из мышц лягушки. Это сильная четырехосновная кислота, хорошо растворимая в воде, содержит два высокоэнергетических остатка фосфорной кислоты.
При гидролизе АТФ образуются АДФ и АМФ с выделением большого количества химической энергии:
АТФ ↔АДФ↔АМФ
АТФ вместе с АДФ и АМФ образуют адениловую систему. Энергия, накопленная в виде АТФ, используется в огромном числе различных эндергонических процессов клетки, к числу которых относятся биосинтез белков, нуклеиновых кислот, углеводов, жиров, транспорт веществ через мембраны, различные формы движения.
АТФ образуется в ходе эндергонической реакции, называемой реакцией фосфорилирования:
АДФ + H 3 PO 4 →АТФ
В этой реакции используется либо энергия, извлекаемая при окислении фрагментов питательных веществ, связанном с субстратным фосфорилированием, либо энергия, выделяющаяся при переносе электронов по дыхательной цепи, сопряженном с окислительным фосфорилированием, либо энергия, получаемая за счет фотосинтетического фосфорилирования.
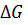 гидролиза АТФ достаточно велика и составляет – 30,5 кДж·моль-1; близкая величина найдена для гидролиза АТФ с образованием АМФ и пирофосфата. В то же время величина
гидролиза АТФ достаточно велика и составляет – 30,5 кДж·моль-1; близкая величина найдена для гидролиза АТФ с образованием АМФ и пирофосфата. В то же время величина 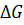 гидролиза АМФ на аденозин и фосфорную кислоту составляет – 12,6 кДж·моль-1, т.е. почти в 2,5 раза ниже энергии макроэргической связи. В живой клетке с учетом реальных концентраций реагентов, изменение
гидролиза АМФ на аденозин и фосфорную кислоту составляет – 12,6 кДж·моль-1, т.е. почти в 2,5 раза ниже энергии макроэргической связи. В живой клетке с учетом реальных концентраций реагентов, изменение 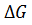 может составлять – 50 кДж·моль-1 и выше.
может составлять – 50 кДж·моль-1 и выше.
К группе высокоэнергетических соединений относятся также тиоэфиры – промежуточные продукты обмена жирных кислот. В природе основным тиоэфирным соединением является кофермент А (соединение аденозин – 3',5' – дифосфорной кислоты с фосфопантотениламиноэтантиолом) – Н S - СоА.
Кофермент А взаимодействует с АТФ с образованием тиоэфира (Р  Р
Р 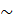 S – СоА)
S – СоА)
Н S – СоА + АТФ ↔ Р 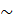 Р
Р 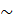 S – СоА + АМФ
S – СоА + АМФ
Данное высокоэнергетическое соединение легко вступает в реакцию ацилирования с жирной кислотой:
R-CH2-COOH + Р 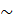 Р
Р  S – СоА ↔ R-CH2-CO- S – СоА + РР
S – СоА ↔ R-CH2-CO- S – СоА + РР
В результате этой реакции существенно возрастает реакционная способность атома углерода тиоэфирной связи. При участии кофермента А протекает ряд промежуточных реакций клеточного дыхания, биосинтеза и окисления высших жирных кислот.
К числу высокоэнергетических соединений также относятся 1,3- дифосфоглицериновая кислота (дФГК) и фосфоенолпируват (ФЕП). Эти вещества являются промежуточными продуктами гликолиза и с их превращениями сопряжен процесс субстратного фосфорилирования 1,3 – дифосфоглицериновая кислота передает одну фосфатную группу на АДФ, в результате чего образуется АТФ и 3 – фосфоглицериновая кислота:
1,3 – дФГК + АДФ→ 3 – ФГК + АТФ
Фосфоенолпируват также легко передает свою фосфатную группу молекуле АДФ:
ФЕП +АДФ → ПВК + АТФ
Фосфоенолпируват и 1,3 – дифосфоглицериновая кислота не только играют роль доноров химической энергии, но и являются важными интермедиатами гликолиза.
Два других высокоэнергетических фосфорилированных соединения – креатинфосфат и аргининфосфат – важны как «аккумуляторы» химической энергии.
При обмене веществ в организме человека протекают окислительно – восстановительные реакции. Процесс окисления любого вещества связан с отдачей электронов окисляемым веществом, а процесс восстановления – присоединения электронов к какому–то веществу (акцептору электронов). В живых организмах выделение энергии происходит постепенно, порциями. Выделяемая энергия может рассеиваться в виде теплоты или улавливаться в процессе синтеза высокоэнергетических соединений. Поэтому выделяют свободное и сопряженное окисление.
Свободное окисление не связано с переходом энергии биологического окисления в энергию макроэргических соединений. Выделяющаяся энергия рассеивается в виде теплоты. Этот вид энергообразования в клетках важен для теплорегуляции и детоксикации вредных продуктов обмена веществ.
Сопряженное окисление связано с переходом свободной энергии, выделяющейся в процессе биологического окисления, в доступную для использования форму энергии – макроэргические связи АТФ или другие виды энергии, например, ионный градиент. Различают такие виды сопряженного окисления, как окислительное фосфорилирование на уровне субстрата и окислительное фосфорилирование на уровне дыхательной цепи ферментов. В первом случае синтез АТФ идет за счет переноса высокоэнергетического фосфата от окисляемого субстрата к АДФ. Такое фосфорилирование, в основном, происходит в мышцах в процессе гликолиза.
Во втором случае синтез идет за счет энергии, которая выделяется при переносе электронов по дыхательной цепи ферментов, локализованных в митохондриях, от окисляемых веществ к атомарному кислороду в процессе дыхания. Этот процесс не связан непосредственно с синтезом АТФ и вначале используется для образования протонного потенциала на мембране, который в дальнейшем приводит к синтезу АТФ. Энергия протонного потенциала может затрачиваться и на другие виды работы, поэтому образование АТФ не является единственным и обязательным следствием окисления.
Задания для самостоятельного изучения
1. Клеточный метаболизм, его биологическая роль.
2. Пути передачи энергии от катаболических процессов к анаболическим
4. Регуляция метаболических путей.
5. Строение и свойства АТФ, ее особенности.
6. Роль АТФ в передаче энергии. АТФ – цикл в клетке.
7. Высоко– и низкоэнергетические соединения, их биологическая роль.
Тема: «ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ»
Репликация
( биосинтез ДНК на ДНК матрице)
В большинстве случаев синтез ДНК представляет собой репликацию – удвоение количества молекул ДНК. В итоге из одной биспиральной материнской молекулы ДНК образуются две биспиральные дочерние молекулы ДНК идентичные друг другу и материнской ДНК. Такую репликацию называют гомологической репликацией.
В этом сложном процессе выделяют несколько этапов. Вначале особые ферменты хеликазы обеспечивают расхождение двух цепей биспиральной молекулы ДНК. В результате возникает структура, называемая репликативной вилкой. Ее протяженность составляет около 1000 нуклеотидов.
В роли матрицы выступают обе разъединенные цепочки нуклеотидов, вдоль которых осуществляется синтез «дочерних» ДНК. Этот синтез возможен только в направлении 5' → 3', а так как цепи материнской ДНК являются антипараллельными, то и синтез называется антипараллельным.
1. Инициация репликации заключается в переносе первых нуклеотидов с соответствующих нуклеозидтрифосфатов на предварительно синтезированный праймер – затравку, состоящую из 10–60 рибонуклеотидов. Синтез затравки обеспечивает специальный фермент праймаза. Впоследствие затравка удаляется из дочерней молекулы ДНК при ее созревании.
2. Элонгация выражается в наращивании цепочки нуклеотидов благодаря их последовательному переносу с молекул нуклеозидтрифосфатов на растущую полинуклеотидную цепь. Этот процесс обслуживается комплексом ферментов, среди которых ведущую роль выполняет ДНК – полимераза III.
Благодаря принципу комплементарности нуклеотидов обеспечивается точное воспроизведение дочерними молекулами ДНК структуры материнской ДНК. По мере продвижения репликативной вилки по молекуле материнской ДНК синтезируются фрагменты дочерних ДНК, которые впоследствии объединяются в единую цепь. Такой синтез получил название прерывистого синтеза. Объединение дочерних фрагментов осуществляется с помощью ферментов ДНК – лигаз.
3.Терминация (прекращение) репликации программируется особой последовательностью нуклеотидов, располагающихся на конце материнской ДНК.
В результате такого синтеза в составе биспиральной молекулы ДНК оказывается одна цепь – материнская, а другая – вновь синтезированная –дочерняя. Поэтому репликация ДНК носит полуконсервативный характер.
Таким образом, репликация ДНК является гомологической, антипараллельной, прерывистой и полуконсервативной.
Биосинтез ДНК исследуется более четырех десятилетий. Уже многое известно о ферментных системах, обеспечивающих протекание этого сложного процесса, тем не менее расшифровка целого ряда его деталей требует кропотливого труда. Это особенно относится к ДНК – синтезирующему аппарату высших организмов. Решение этой задачи будет иметь важное значение для контроля роста опухолей, процесса старения организма, борьбы с вирусной инфекцией.
Транскрипция
(биосинтез РНК на ДНК матрице)
Следующий этап в передаче генетической информации – транскрипция. В этом процессе с помощью ферментной системы происходит синтез цепи РНК на одной из нитей матричной ДНК. В результате транскрипции образуется РНК – точная копия нити ДНК по последовательности азотистых оснований в полинуклеотидной цепи. Транскрипция осуществляется избирательно лишь на отдельном участке молекулы ДНК – гене (или группе генов). Участок ДНК, подлежащий переписыванию, называют транскриптоном.
Синтезу РНК предшествует соединение фермента РНК – полимеразы с особым участком молекулы ДНК, называемым промотором. РНК - полимераза распознает место своей посадки на особой последовательности нуклеотидов в молекуле ДНК (ТАТААТ – в клетках бактерий, ТАТА – в клетках эукариот). Процесс транскрипции включает несколько этапов.
1. Инициации синтеза предшествует расхождение цепей ДНК на ограниченном участке под воздействием РНК – полимеразы. В результате возникает структура, называемая транскрипционной вилкой. Линейная цепь ДНК транскрипционной вилки используется в качестве матрицы для синтеза РНК. Вдоль этой цепи выстраиваются нуклеозидтрифосфаты – предшественники будущей РНК. Соединение между собой двух первых нуклеотидов является началом синтеза РНК – инициацией.
2.Элонгация, или рост цепи РНК, осуществляется благодаря реакции переноса фрагментов нуклеотидов с молекул АТФ, ГТФ, ЦТФ, УТФ на растущую полинуклеотидную цепь. Эту реакцию катализирует фермент РНК – полимераза. Синтез идет с использованием энергии гидролиза высокоэнергетических связей нуклеозидтрифосфатов. Специфическая последовательность матричной ДНК задает структуру молекулы РНК благодаря принципу комплементарности.
3.Терминация синтеза наступает в тот момент, когда движущаяся по транскриптону РНК– полимераза встречается с терминирующим кодоном. Появление терминатора служит сигналом для разъединения синтезированной РНК с ДНК – матрицей и прекращения транскрипции. В результате синтезированная РНК переходит к самостоятельному существованию.
На матрице ДНК с помощью фермента РНК – полимеразы синтезируются предшественники всех типов молекул РНК – информационных, рибосомальных, транспортных, которые подвергаются дальнейшим модификациям (биогенез) и созревшие молекулы могут выполнять свои биологические функции.
Задания для самостоятельного изучения
1. Синтез предшественника пуриновых нуклеотидов – ИМФ.
2. Синтез АМФ из ИМФ, ферменты, катализирующие процесс.
3. Синтез ГМФ из ИМФ, ферменты, катализирующие процесс.
4. Синтез дифосфо- и трифосфонуклеозидов, ферменты, катализирующие эти процессы.
5. Пути регенерации пуриновых нуклеотидов.
6. Регуляция синтеза пуриновых нуклеотидов.
7. Механизм биосинтеза УМФ.
8. Биосинтез цитидиновых нуклеозидов.
9. Биосинтез тимидиновых нуклеозидов.
10. Синтез дифосфо- и трифосфонуклеозидов, ферменты, катализирующие эти процессы.
11. Пути регенерации пиримидиновых нуклеотидов.
12. Регуляция синтеза пиримидиновых нуклеотидов
13. Молекулярный механизм биосинтеза ДНК.
14. Механизм биосинтеза РНК на ДНК-матрице.
15. Биогенез т-РНК, р-РНК, м-РНК.
.
Тема: «ОБМЕН БЕЛКОВ»
Белки являются основными функциональными молекулами всех видов живых организмов. Белки, попадающие в организм с пищей, никогда не включаются в состав органов и тканей без предварительного расщепления. Распад белковых веществ на более простые происходит путем гидролиза в присутствии гидролаз. Гидролиз белков может быть либо частичным (до пептидов), либо полным (до аминокислот). Процесс неполного гидролиза белков ускоряется специфическими ферментами – протеиназами (пептидилпептидогидролазами), важнейшими из которых являются трипсин, пепсин, химотрипсин.
Пептиды, образовавшиеся в результате действия на белки протеиназ, подвергаются дальнейшему расщеплению до аминокислот в присутствии пептидаз: карбоксипептидаз (отщепляют аминокислоты с С – конца пептида), аминопептидаз (отщепляют аминокислоты с N – конца пептида) и дипептидгидролаз (расщепляют дипептиды). В результате совместного действия протеолитических ферментов (протеиназ и пептидаз) белки пищи расщепляются до аминокислот. Свободные аминокислоты претерпевают в организме человека и животных различные превращения: часть их используется для синтеза белков органов и тканей, часть на синтез гормонов, витаминов и т.п.; часть же, подвергаясь полному распаду, используется в качестве энергетического материала.
В организме осуществляется три типа превращений аминокислот: по α- аминогруппе, по α- карбоксильной группе и по радикалу.
Реакции по α- аминогруппе – это, в основном, реакции дезаминирования и переаминирования. Дезаминирование может быть: окислительным, восстановительным, гидролитическим, внутримолекулярным. В результате дезаминирования образуется аммиак, который для большинства живых организмов является ядом, поэтому происходит его обезвреживание. Одним из путей обезвреживания является связывание его с аминокислотами глутаминовой и аспарагиновой, которые превращаются в глутамин и аспарагин в любом месте, где бы аммиак не выделился. Этот процесс характерен для растений. У животных основной транспортной формой NH3 в организме служит глутамин крови, доставляющий его в почки или печень, где осуществляется синтез мочевины с участием углекислого газа. Этот механизм связывания аммиака называется орнитиновый цикл Кребса. Заключительной реакцией в цикле биосинтеза мочевины является гидролиз аргинина на орнитин и мочевину. Суть функционирования орнитинового цикла заключается в том, что из каждых двух молекул аммиака и одной молекулы углекислого газа получается одна молекула мочевины.
Реакции переаминирования лежат в основе синтеза новых аминокислот из кетокислот.
Реакции по карбоксильным группам аминокислот сводятся в основном к двум процессам: декарбоксилированию и образованию аминоациладенилатов.
Декарбоксилирование аминокислот ведет к образованию физиологически активных аминов – предшественников еще более физиологически активных соединений – алкалоидов.
Важное значение имеет превращение аминокислот по радикалам. Так, например, пролин легко превращается в оксипролин, фенилаланин – в тирозин, аргинин – в орнитин.
Новообразование аминокислот
Пути биосинтеза заменимых аминокислот хотя и разнообразны, но достаточно просты. Первичный синтез аминокислот в природе осуществляется, главным образом, путем восстановительного аминирования кетокислот и прямого аминирования непредельных кислот.
Прямое аминирование непредельных кислот – реакция, характерная для растений и бактерий.
Восстановительное аминирование, представляющее собой обращение окислительного дезаминирования аминокислот, является одним из главных путей синтеза аминокислот.
Важную роль в этом синтезе играют глутаминовая кислота и глутамин – доноры NH2 – групп. Глутаминовая кислота образуется в реакции восстановительного аминирования 2 – оксоглутарата; он является предшественником глутамина, пролина и карбамоилфосфата – важного звена цикла мочевины. В реакциях переаминирования образуются аланин из пировиноградной кислоты и аспарагиновая кислота из оксалоацетата. Предшественником серина является 3 – фосфоглицерат, а сам серин – предшественник глицина и цистеина. Пути биосинтеза незаменимых аминокислот у растений и бактерий гораздо длиннее и сложнее, чем заменимых. Они образуются из некоторых заменимых аминокислот, а также из других метаболитов. Синтез как заменимых, так и незаменимых аминокислот регулируется по механизму обратной связи, в котором решающая реакция ингибируется конечными продуктами – аминокислотами.
Растительные и животные организмы отличаются друг от друга по уровню и способности синтезировать аминокислоты. В растениях осуществляется биосинтез более 100 различных аминокислот, входящих в природные белки, а также редких аминокислот, свойственных определенным видам.
Животные организмы синтезируют только заменимые аминокислоты, остальные (незаменимые) должны поступать с пищей. Недостаток каждой из незаменимых аминокислот приводит к нарушению обмена веществ, замедлению роста и развития организма. Пищевая ценность белка определяется содержанием незаменимых аминокислот и степенью усвоения. Чем выше показатели, тем лучше качество белка.
Биосинтез белка
Проблема биосинтеза белка – важнейшего биополимера – одна из центральных в современной биологии.
Основная теория, объясняющая синтез белков – это матричная теория. Она включает следующие этапы:
1. Перенос информации из ядра (от ДНК) в цитоплазму к рибосомам в виде нуклеотидной последовательности матричной (информационной) м– РНК в процессе транскрипции;
2. Активацию аминокислот и перенос активированных аминокислот на рибосомы (полисомы) с помощью транспортных РНК;
3. Синтез пептидных связей – трансляцию.
Процесс переноса информации из ядра заключается в том, что синтезированная в процессе транскрипции цепь м–РНК точно копирует нуклеотидную последовательность одной из двух цепей ДНК на основе принципа комплементарности. «Переписывание сочетания» нуклеотидов в цепи м–РНК в виде кодонов – троек нуклеотидов. Или триплетов, непосредственно определяют расстановку соответствующих, кодируемых ими аминокислот в цепи белковой молекулы.
Таким образом, в м–РНК содержится код белкового синтеза в виде сочетаний уникальных для каждой аминокислоты триплетов нуклеотидов. ДНК в этом процессе не расходуется и не изменяется, сохраняясь в прежнем виде и будучи готовой для «переписывания» с нее неограниченного количества молекул м–РНК. Расшифровка биологического кода явилась одним из наиболее крупных достижений молекулярной биологии. В настоящее время имеется полная таблица, содержащая 64 возможных триплета нуклеотидов, из которых 61 – «смысловые» кодоны, т.е. кодирующие какую либо аминокислоту. Триплеты УАГ, УАА и УГА оказались «бессмысленными», т.е. не кодируют ни одну из белковых аминокислот. Генетический код обладает следующими свойствами: триплетный (каждая аминокислота кодируется последовательностью трех нуклеотидов в кодоне м–РНК); непрерывный (код считывается непрерывно); универсальный (одинаковый для всех живых организмов); неперекрывающийся; вырожденный (положение одной аминокислоты в полипептидной цепи определяется несколькими кодонами).
Мономерами белковых молекул служат аминокислоты. Их последовательность определяет первичную структуру белка и все многообразие этих важнейших биологических полимеров. Поэтому важнейшим условием синтеза белка является наличие в клетке всех необходимых аминокислот, входящих в его состав. В клетках всех организмов «фабриками» белка служат рибосомы.
Доставку аминокислот к месту синтеза белка осуществляют т–РНК. Кроме того, т–РНК при участии АТФ обеспечивают энергией синтез полипептидной цепочки.
Информацию о структуре белковой молекулы в рибосому переносит информационная РНК. Она служит матрицей, на которой в рибосомах осуществляется синтез белковой молекулы.
Синтез белка – это ключевой и весьма сложный биохимический процесс, требующий согласованной работы множества ферментов.
Подготовительный этап белкового синтеза активирование аминокислот и их взаимодействие с транспортными РНК.
Активирование происходит в цитоплазме клетки за счет энергии АТФ. Этот процесс обеспечивают ферменты аминоацил-т-РНК-синтетазы, которые ускоряют реакцию фосфорилирования аминокислот:
Аминокислота + АТФ → [аминокислота-АМФ] +пирофосфат
Образуется аминоациладенилат (ААА), который взаимодействует с соответствующей т-РНК благодаря энергии АТФ.
[аминокислота-АМФ] + т-РНК → [аминокислота-т-РНК] + АМФ
В результате этих превращений комплекс [аминокислота–т–РНК] обогащается энергией, которая позднее будет использоваться для синтеза полипептидной цепочки из аминокислот.
Трансляция, т.е. преобразование информации, содержащейся в и–РНК, в специфическую для каждого белка последовательность аминокислот, осуществляется в рибосомах клетки. По своей химической природе рибосомы – это нуклеопротеины, состоящие из белков и РНК. Каждая рибосома состоит из двух субчастиц – большой и малой, причем, эти частицы до начала синтеза белка находятся в цитоплазме раздельно. Их соединение в единую рибосому – необходимое условие синтеза белка.
1.Инициация белкового синтеза начинается с присоединения к малой субчастице рибосомы информационной РНК и первой т–РНК, несущей остаток аминокислоты метионина (т–РНКмет). Образовавшийся биохимический комплекс притягивает к себе вторую большую субчастицу рибосомы; в результате рибосома становится активной. В таком состоянии рибосомы называются транслирующими рибосомами.
2.Элонгация синтеза происходит в транслирующей рибосоме. Она заключается в последовательном взаимодействии т–РНК, несущих аминокислоты в рибосому, с уже находящейся в ней информационной РНК.
Это взаимодействие двух нуклеиновых кислот осуществляется благодаря принципу комплементарности нуклеотидов: антикодон т–РНК распознает комплементарный кодон и–РНК и химически связывается с ним посредством водородных связей. В результате такого взаимодействия доставленная в рибосому аминокислота покидает т–РНК и присоединяется к растущей полипептидной цепочке.
В результате, на этапе элонгации последовательность кодонов и-РНК преобразуется в последовательность аминокислот в синтезируемой молекуле белка. Основой такого преобразования служит генетический код. Благодаря генетическому коду информация, первоначально закодированная в молекуле ДНК посредством и–РНК, переносится в рибосому, а здесь она с помощью т-РНК преобразуется в информацию об аминокислотном составе белковой молекулы. Так возникает уникальная, специфичная для каждого белка последовательность аминокислот, т.е. первичная структура белковой молекулы.
В рибосоме имеются два важных центра: пептидильный и аминоацильный. т–РНК мет попадает сразу в пептидильный центр, все остальные аминокислоты с помощью т–РНК доставляются в аминоациальный центр, из которого аминокислота попадает в пептидильный центр, где из аминокислот синтезируется полипептидная цепочка.
3.Терминация (прекращение) синтеза белковой молекулы происходит в тот момент, когда в рибосоме появляются кодоны и–РНК, сигнализирующие о прекращении синтеза белка. Такие триплеты нуклеотидов (УАГ, УАА, УГА) называются терминирующими кодонами.
Терминация трансляции приводит к разрыву связей между рибосомой,
т–РНК, и–РНК. Рибосома при этом распадается на две субчастицы – большую и малую, которые пополняют фонд свободных рибосомальных частиц, готовых к новым циклам биосинтеза белка. Распад рибосомы сопровождается переходом синтезированной полипептидной цепочки в цитоплазму, где она подвергается разнообразным превращениям. Эти превращения называются посттрансляционной модификацией. Они придают белковой молекуле специфическую конформацию – вторичную, третичную, а иногда и четвертичную.
Скорость синтеза белка существенно зависит от уровня организации клетки. Наибольшей скоростью сборки полипептидной цепи отличаются бактерии, имеющие простое строение. В рибосомах этих микроорганизмов за 1 секунду объединяются 15– 20 аминокислот. В клетках дрожжей не более 7–10 аминокислот, а в клетках млекопитающих – лишь 3–5 аминокислот в секунду.
Одну и ту же цепь м–РНК могут транслировать одновременно множество рибосом. Рибосомы, расположенные на одной молекуле м–РНК, образуют полирибосому или полисому. Полисомы, активно синтезирующие белки, либо находятся в цитоплазме, либо могут быть прикреплены к мембранам эндоплазматического ретикулума.
Транспорт белков к месту их назначения осуществляется благодаря наличию на их концах сигнальных последовательностей, специфически узнаваемых Синтез белка подвержен тонкой регуляции на этапах транскрипции и трансляции.
Регуляция синтеза белков находится под контролем генетической системы клетки и осуществляется с помощью механизмов, известных под названием индукции и репрессии. Эти механизмы регулируются на уровне транскрипции и трансляции. Стимуляция синтеза либо одного белка, либо группы белков, вызываемая прибавлением к среде специфического вещества, получила название индукции, а вещество, стимулирующее синтез белка – индуктором. Помимо индуцируемых белков, в клетке синтезируются и другие белки без внесения в питательную среду индуктора; они получили название конструктивных (конститутивных). Конструктивные белки присутствуют в бактериальных клетках в постоянных количествах, независимо от потребности в них (например, ферменты катаболизма - гликолиза).
Классические работы Жакоба и Моно с Е. coli позволили разработать механизм регуляции на уровне транскрипции, в основу которого положено функционирование структурной единицы – оперона. В состав оперона входят промоторный участок, являющийся местом связывания ДНК с РНК-полимеразой, оператор и структурные гены. Функция оператора заключается в выключении структурных генов из процесса синтеза мРНК. Это выключение осуществляется репрессором, блокирующим оператор. Белок– репрессор кодируется геном– регулятором, существующим автономно от оперона. Оперон включается в работу в том случае, когда репрессор блокирован специфическим веществом– индуктором.
Задания для самостоятельного изучения
1. Орнитиновый цикл Кребса.
2. Основные биосинтетические семейства, их характеристика.
3. Биосинтез незаменимых аминокислот.
4. Регуляция биосинтеза аминокислот.
5. Синтез незаменимых аминокислот и белков для практических целей.
6. . Строение т-РНК, ее роль в активации аминокислот.
7. Генетический код, его особенности, биологическая роль.
8. Преобразование вновь синтезированных белков, их перенос через мембрану.
9. Индукция репрессии синтеза белков. Конструктивные и индуцируемые ферменты.
10. Гипотеза Жакоба и Моно.
11. Мультиэнзимный механизм синтеза пептидов, его биологическая роль.
12. Энергетические затраты биосинтеза белка.
Тема: «ОБМЕН УГЛЕВОДОВ»
Распад углеводов обеспечивает организм энергией, заключенной в этих соединениях. В этом проявляется энергетическая функция углеводов в организме. Энергия, которая высвобождается, запасается в форме АТФ. Позднее она расходуется для осуществления синтетических и других процессов жизнедеятельности организма.
Наряду с энергетической функцией важна и метаболическая функция; их распад сопровождается появлением большого числа веществ, необходимых для синтеза липидов, белков, нуклеиновых кислот. Углеводы служат источником этих важнейших биоорганических соединений.
Биосинтез углеводов
Простые углеводы возникают, главным образом, при первичном биосинтезе органического вещества, осуществляемом растениями, а также хемосинтезирующими водорослями путем восстановления углекислого газа атмосферы с одновременным формированием органических молекул, содержащих цепи углеродных атомов.
Гетеротрофные организмы способностью к первичному биосинтезу простых углеводов не обладают, но могут образовывать их за счет перестройки органических соединений пищи.
В организме животных глюкоза непрерывно синтезируется в строго регулируемых реакциях из простых предшественников. Предшественниками глюкозы являются ПВК, молочная кислота, глицерол, большинство аминокислот, промежуточные продукты цикла трикарбоновых кислот. Биосинтез глюкозы из неуглеродных предшественников носит название глюконеогенез, что означает образование «нового» сахара (процесс обратен гликолизу).
Биосинтез олигосахаридов осуществляется за счет реакции трансгликозидирования. Перенос гликозильного остатка на моносахарид осуществляется от фосфорного эфира другого моносахарида и ускоряется специфической гликозилтрансферазой. Наряду с фосфорными эфирами моносахаридов роль доноров гликозильных остатков могут выполнять сами олигосахариды или нуклеозиддифосфатсахара (глюкозо–УДФ).
Таким образом, биосинтез олигосахаридов осуществляется путем переноса гликозильных остатков (трансгликозидирования) от разнообразных субстратов к моносахаридам или их фосфорным эфирам при участии специфических гликозилтрансфераз.
Синтез полисахаридов (глюканов) также осуществляется путем трансгликозидирования гликозильных остатков на невосстанавливающий конец растущей цепи полисахарида от субстратов: фосфорных эфиров моносахаридов,
Уридиндифосфатсахаров и олигосахаридов. Реакция трансгликозидирования может многократно повторяться, что обеспечивает ступенчатый синтез молекул полисахаридов. Для осуществления реакций такого типа необходима «затравка», т.е. наличие в реакционной среде небольшого количества молекул полисахарида.
Задания для самостоятельного изучения
1Гидролиз природных полисахаридов
2. Распад дисахаридов.
3. Окислительное декарбоксилирование ПВК.
4. Цикл Кребса, его значение.
5. Синтез моносахаридов, ферменты, катализирующие процесс.
10. Синтез дисахаридов
Тема: «ПУТИ ОБМЕНА ЛИПИДОВ»
К липидам относятся множество разнообразных органических соединений: жиры, фосфотиды, вещества стероидной природы (половые гормоны. Холестерин и др.) простаглиндины, пигменты и т.д. Липиды, как правило не растворимы в воде, хорошо растворимы в органических растволрителях, таких как эфиры, хлороформ, бензол. Жиры – основной источник энергии в организме. Жиры значительно превосходят по энергетической ценности углеводы и в значительных количествах могут запасаться в качестве «резервного топлива».
Характерным структурным компонентом большинства липидов являются высшие жирные кислоты. В состав жиров чаще всего входят кислоты с 16 – 18 атомами углерода, среди них имеются насыщенные и ненасыщенные высшие жирные кислоты.
Ацилглицеролы (триглицериды) организме человека и животных являются запасными веществами и служат источником энергии. Сложные липиды (фосфолипиды, сфинголипиды, гликолипиды), входящие в состав биологических мембран, подвергаются процессам обмена менее интенсивно, чем триацилглицеролы.
Катаболизм триацилглицеролов включает три стадии:
1) гидролиз под действием липаз на свободные жирные кислоты и глицерин;
2) катаболизм глицерина;
3) катаболизм жирных кислот.
Скорость гидролиза четко сбалансирована со скоростью катаболизма. Образовавшийся при гидролизе ацилглицеролов глицерин в цитоплазме вовлекается в процесс гликолиза.
Полный гидролиз триглицеридов идет ступенчато: сначала быстро гидролизуются α – связи, а потом уже идет медленный гидролиз β – моноглицерида. β – Моноглицериды всасываются стенкой кишечника и либо направляются на ресинтез триглицеридов, либо распадаются далее под действием специфических эстераз.
Глицерин независимо от того, поступит ли он на ресинтез жиров или будет претерпевать дальнейший распад, прежде всего фосфорилируется. Донором остатка фосфорной кислоты в этой реакции служит АТФ. Процесс ускоряется соответствующей фосфотрансферазой.
Глицерин + АТФ → 1 – фосфоглицерин + АДФ
1–Фосфоглицерин расходуется на синтез новых молекул триглицеридов, но часть его окисляется с образованием фосфодиоксиацетона (ФДА). Фосфодиоксиацетон изомеризуется в фосфоглицериновый альдегид (ФГА), который вовлекается в углеводный обмен.
Основным путем извлечения химической энергии из жирных кислот является их β-окисление. Этот путь связан с присоединением кислорода к углеродному атому жирной кислоты, находящемуся в β–положении.В результате ряда химических реакций молекула высшей жирной кислоты укорачивается на два углеродных атома и образуются пальмитиновая и уксусная кислота в виде производных коэнзима – А (пальмитил – коэнзим А; ацетил – коэнзим А). Этот процесс многократно повторяется. Окончательным продуктом распада является ацетил – коэнзим А.
Ацетил–СоА включается в цикл трикарбоновых кислот.
Молекула жирной кислоты с четным числом углеродных атомов полностью превращается в ацетил–СоА. Продуктом окисления жирных кислот с нечетным числом углеродных атомов наряду с ацетил–СоА служит пропионил–СоА, который превращается в сукцинил–СоА, который вовлекается в цикл трикарбоновых кислот.
β-Окисление протекает в митохондриях, в липопротеидной мембране которых расположены комплексы ферментов, обеспечивающих процесс. В митохондриях также расположены ферменты дыхательного цикла, ведущие передачу атомов водорода и электронов на кислород. Процесс сопровождается синтезом АТФ (окислительное фосфорилирование). Например, в процессе распада пальмитиновой кислоты происходит 7 циклов
β–окисления, в каждом из которых образуются 5 молекул АТФ. Таким образом, при окислении пальмитата до ацетил –КоА образуются 35 молекул АТФ. Восемь молекул ацетил –КоА дают в результате полного сгорания в цикле Кребса 8х 12 =96 молекул АТФ. Одна молекула АТФ затрачивается на активирование пальмитиновой кислоты. Следовательно, энергетический эффект составляет 130 молекул АТФ.
Если бы ацетил – Ко А накапливался в организме, то запасы НS – КоА быстро бы исчерпались, и окисление высших жирных кислот остановилось. Этого не происходит, так как НS – КоА быстро освобождается из состава ацетил – Ко А в результате следующих процессов:
1. Ацетил – КоА включается в цикл ди – и трикарбоновых кислот, где окисляется до углекислого газа и воды;
2. Ацетил – КоА используется для синтеза полициклических спиртов (стеролов) и соединений, содержащих изопреноидные перегруппировки.
В принципе, биосинтез жирных кислот происходит в направлении, противоположном β–окислению. Однако имеются и специфические особенности, различающие эти два процесса; по сути, это различные ферментативные процессы. Синтез жирных кислот происходит в основном в цитоплазме, расщепление их – в митохондриях. Хотя интермедиаты в обоих процессах идентичны, однако промежуточные продукты синтеза жирных кислот ковалентно связаны с ацилпереносящим белком (АПБ), а продукты расщепления жирных кислот – с коферментом А. Роль восстановителя в синтезе жирных кислот выполняет НАДФН2.
Суммарное уравнение реакции образования пальмитиновой кислоты при участии синтазы имеет следующий вид:
Ацетил – КоА + 7малонил – КоА + 14НАДФН2 →
СН3(СН2)14СООН + 7СО2 + 8Н S – КоА + 14НАДФ + 6Н2О
Малонил–КоА - непосредственный предшественник 14 и 16 атомов углерода молекулы пальмитиновой кислоты – образуется из ацетил – КоА и СО2 под действием отдельной ферментативной системы – ацетил – КоА – карбоксилазы, не входящей в состав синтазы высших жирных кислот.
Ацетил – КоА + СО2 + АТФ → малонил – КоА + АДФ + Н3РО4
Процесс биосинтеза высших жирных кислот включает ряд стадий в результате которых удлиняется углеродная цепочка кислоты. На заключительной стадии остаток синтезированной кислоты переносится от АПБ к НS – КоА при участии фермента тиоэстеразы.
Скорость биосинтеза жирных кислот определяется содержанием сахаров в клетке. Она достигает максимального уровня при избытке сахаров и низком содержании жирных кислот.
Биосинтез триглицеридов
В биосинтезе ацилглицеролов принимают участие два предшественника: ацил–СоА и глицерол–3–фосфат. Ацильные остатки ацил-СоА переносятся ацилтрансферазами на спиртовые группы глицерол–3–фосфата, в результате чего образуется фосфатидная кислота. От последней отщепляется фосфорная кислота с образованием 1,2–диацил–глицерола, к которому присоединяется третий остаток ацила от ацил–СоА.
Обмен фосфолипидов
Обмен фосфолипидов еще недостаточно хорошо изучен. Однако установлено, что на первых этапах работают липазы. Липазы делятся на 4 вида: А; В; С; Д.
Липаза А отщепляет RCOOH (α- положение)
Липаза В – RCOOH (α, β – положение)
Липаза С – азотистое основание + H3PO4
Липаза Д – азотистое основание
Порядок действия липаз не установлен.
В результате установленного действия всех липаз образуются высшие карбоновые кислоты, фосфорная кислота и азотистые основания. Высшие жирные кислоты подвергаются β-окислению. Глицерин вовлекается в процесс ресинтеза, либо в углеводный обмен, фосфорная кислота вовлекается в общий метаболический процесс. Этаноламин, холин взаимодействуют с ЦТФ с образованием ЦДФ – производных и вовлекаются в процесс биосинтеза фосфолипидов.
Часть освободившегося холина взаимодействует с ацетил- СоА с образованием ацетилхолина. Ацетилхолин – вещество, участвующее в передаче нервных импульсов. Часть холина превращается в бетаин – вещество, которое является донором метильных групп.
Обмен стеридов
Распад стеридов
Осуществляется на первых этапах гидролитическим путем, в результате гидролиза образуются стеролы и высшие жирные кислоты. Высшие жирные кислоты подвергаются β – окислению. Часть стеролов используется на ресинтез стеридов, а другая часть подвергается изменению. Прежде всего, стеролы восстанавливаются по кратным связям, затем происходит окисление по боковым радикалам. В результате этих процессов образуются холевые (желчные) кислоты, именно они являются конечными продуктами распада большинства стеролов. Соли желчных кислот резко уменьшают поверхность натяжения раздела фаз (вода, жир), в результате чего наблюдается эмульгирование жиров.
Синтез стеролов и стеридов
В 40-60-е годы ХХ в. Бах с сотрудниками установили, что все атомы углерода в стеролах происходят из ацетатов. В дальнейшем благодаря работам Климова, Попьяка были выяснены детали синтеза, как оказалось синтез протекает в 35 ферментативных реакций, которые можно объединить в три основных этапа:
1. Образование мевалоновой кислоты из ацетил – СоА
2. Синтез сквалена
3. Циклизация сквалена с образованием стеролов
Мевалоновая кислота преобразуется в предельный углеводород сквален, состоящий из шести изопреноидных группировок. Молекула сквалена легко принимает пространственную конфигурацию близкую конфигурации стеролов. Образовавшиеся стеролы претерпевают изменения, в результате которых образуются специфические стеролы.
Биосинтез стеридов осуществляется в результате переноса ацила высших жирных карбоновых кислот на гидроксильную группу стеролов.
Источником ацильной группы чаще всего служит фосфотидилхолин. В организме человека первое место среди стероидов занимает ненасыщенный спирт холестерол. Он играет роль ключевого промежуточного продукта в синтезе других стероидов, среди которых важное физиологическое значение имеют желчные кислоты, кортикостероиды, андрогены и эстргены.
Биосинтез холестерола происходит главным образом в печени (50%), кишечнике (15%) и коже.
Задания для самостоятельного изучения
1. Пути распада триглицеридов и глицерина.
2. β-окисление высших жирных кислот.
3. Энергетический выход β – окисления.
4. Биосинтез высших жирных кислот.
5. Образование ненасыщенных кислот.
6. Биосинтез триглицеридов.
7. Распад фосфолипидов.
8. Синтез фосфолипидов.
9. Обмен стероидов.
Тема: «БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ»
Биологическое окисление – это совокупность реакций окисления органических веществ (субстратов), протекающих во всех живых клетках. Основная функция биологического окисления - обеспечение организма энергией в доступной для использования форме АТФ. Окисление субстратов в биохимических системах сопровождается отщеплением электронов от субстратов (донор электронов), которые при участии промежуточных переносчиков передаются на кислород – конечный (терминальный) акцептор электронов у аэробных организмов. Транспорт высокоэнергетических электронов восстановленных субстратов происходит в сложной системе, состоящей из окислительно – восстановительных ферментов и коферментов, локализованных во внутренней мембране митохондрии. В переносе электронов от субстратов к молекулярному кислороду принимают участие:
– пиридинзависимые дегидрогеназы, для которых коферментами служат НАД или НАДФ.
– флавинзависимые дегидрогеназы, у которых роль простетической группы играют ФАД или ФМН;
– цитохромы, относящиеся к гемопротеинам.
Среди компонентов дыхательной цепи обнаружены также убихинон (коэнзим Q) и белки, содержащие негемовое железо, так называемые железосерные белки.
Существует 2 типа биологического окисления.
1) Свободное окисление. Оно не сопряжено с фосфорилированием АТФ. Высвобождающаяся энергия распада химических связей переходит в тепловую энергию и рассеивается.
2) Окисление, сопряженное с фосфорилированием АТФ. Осуществляется двумя способами:
а) при субстратном фосфорилировании макроэргическая связь возникает в момент непосредственного окисления субстрата, а затем передается на фосфатный остаток, который используется для фосфорилирования АДФ. Примерами сопряжения окисления с фосфорилированием на уровне субстрата могут служить реакции окисления: 3 – фосфоглицеринового альдегида в 1,3 – дифосфоглицериновую кислоту; 2 – фосфоглицериновой кислоты – в 2 – фосфоенолпировиноградную кислоту; α- кетоглутаровой кислоты – в янтарную кислоту.
При субстратном фосфорилировании образуется сравнительно небольшое количество АТФ.
б) окислительным фосфорилированием называют сопряжение двух клеточных процессов: окисления восстановленных молекул и реакции фосфорилирования АДФ. Этот процесс протекает в митохондриях клетки.
Молекулы НАДН и ФАДН2, образуемые в реакциях окисления углеводов, жирных кислот, спиртов и аминокислот, далее поступают в митохондрии, где ферментами дыхательной цепи осуществляется процесс окислительного фосфорилирования.
Окислительное фосфорилирование – это многоэтапный процесс, происходящий во внутренней мембране митохондрий и заключающийся в окислении восстановленных эквивалентов (НАДН и ФАДН2) ферментами дыхательной цепи и сопровождающийся синтезом АТФ.
Впервые механизм окислительного фосфорилирования был предложен Питером Митчеллом. Согласно этой гипотезе перенос электронов, происходящий на внутренней митохондриальной мембране, вызывает выкачивание ионов Н+ из матрикса митохондрий в межмембранное пространство. Это создает градиент концентрации ионов Н+ между цитозолем и замкнутым внутримитохондриальным пространством. Ионы водорода в норме способны возвращаться в матрикс митохондрий только одним способом – через специальный фермент, образующий АТФ – АТФ-синтазу. АТФ- синтаза пронизывает внутреннюю мембрану митохондрий в тех местах дыхательной цепи, где происходит значительное изменение свободной энергии, и аккумулирует энергию путем синтеза АТФ. АТФ – синтаза в зависимости от условий может как синтезировать АТФ, так и гидролизовать ее. При недостаточном количестве АТФ в клетке АТФ – синтаза синтезирует АТФ за счет энергии протонного градиента. Если внезапно падает протонный градиент, то она будет гидролизовать АТФ и усиливать движение протонов через мембрану митохондрий.
При переносе пары электронов окисляемого субстрата к атому поглощенного кислорода воздуха в митохондриях образуются три молекулы АТФ. Такое соотношение получило название коэффициента окислительного фосфорилирования (Р/О)
По современным представлениям внутренняя митохондриальная мембрана содержит ряд мультиферментных комплексов, включающих множество ферментов. Эти ферменты называют дыхательными ферментами, а последовательность их расположения в мембране – дыхательной цепью (англ. electron transport chain ).
Обмен воды
Все превращения в живых организмах в процессе обмена протекают в водной среде. Высокая полярность воды обеспечивает быстрое растворение многих веществ и диссоциацию молекул электролитов на ионы. Это увеличивает скорость химических превращений. Вода участник многих химических процессов. Её реакционная способность очень высока. Она принимает участие в реакциях гидролиза, дегидратации и гидратации. Многие реакции биосинтеза осуществляются с поглощением или выделением воды. Вода обладает низкой вязкостью и хорошей растворяющей способностью, поэтому выполняет транспортную функцию. Она является одним из основных строительных материалов в формировании клеточных структур.
Многие ткани и органы тела животных сильно обводнены, но имеют, несмотря на это, достаточную плотность. Это объясняется тем, что часть воды находится в связанном состоянии. По степени связанности вода может быть полностью связанной (гидратационной), полусвязанной (иммобильной) и свободной (мобильной). Различные состояния воды в организме связаны друг с другом и способны к взаимопревращениям.
1. Гидратационная вода составляет 13–15% всей воды организма. Она входит в состав гидратных оболочек минеральных ионов, полисахаридов, белков, нуклеотидов. Содержится во внутренних зонах молекул биополимеров, участвует в создании их пространственной конфигурации.
2. Иммобильная вода находится между молекулами волокнистых веществ; в порах, пронизанных рибосомами; в ядре; митохондриях, ЭПС и т.д. Она играет большую роль в переносе веществ через мембраны, участвует в поддержании осмотического давления.
3. Мобильная вода. Она является основой крови, лимфы, слюны, желудочного и кишечного соков и т.д. При участии свободной воды происходит обмен между клетками тела и внешней средой.
Некоторые катионы специфически влияют на задержку и отдачу воды клетками и тканями. Так Na+ вызывает накопление воды в клетках и тканях, тогда как K+ и Са2+ оказывают прямо противоположное действие.
В организме животных мощное влияние на баланс воды оказывают гормоны: диуретический гормон, выделяемый передней долей гипофиза, способствует усиленному выделению воды из организма с мочой (диурез); а антидиуретический гормон повышает обратное всасывание воды в почечных канальцах.
На долю воды в организме человека приходится 60–69% веса тела человека. Суточная потребность в воде 40 г на 1 кг веса. Потребность в воде может меняться от температуры, характера деятельности, состава пищи, возраста. Потеря 20% воды опасна для жизни.
Обмен минеральных веществ
Химический состав живых организмов, как было показано в трудах академика В.И.Вернадского, находится в тесной взаимосвязи с химическим составом земной коры и океанов. Академик А.П.Виноградов установил, что количественное содержание химических элементов в организме обратно пропорционально их порядковым номерам, поскольку основу организма составляют элементы трех первых периодов периодической системы Д. И. Менделеева.
Решающее значение в использовании живыми организмами тех или иных химических элементов принадлежит соотношению различных их свойств, их доступности для организмов в окружающей среде, также способности организмов поглощать и концентрировать их.
Благодаря естественному отбору основу живых организмов составляют только шесть элементов: углерод, водород, кислород, азот, фосфор, сера – получивших название органогены. Общая массовая доля этих элементов в организме человека составляет 97,3%. Из них: C – 21,0; H – 9,7; O – 62,4; N – 3,1; P – 0,95; S – 0,16%.
Для органогенов характерно исключительное разнообразие образуемых ими связей, что определяет многообразие биомолекул в живых организмах. Органогены образуют в основном водорастворимые соединения, что способствует их концентрированию в живых организмах, содержащих более 60% воды.
Наряду с органогенами непосредственное и активное участие в ходе жизненных процессов принимают следующие 10 элементов: K , Ca, Na, Mg, Mn, Fe, Co, Cu, Zn, Mo – металлы жизни; на их долю приходится 2,4%.
Все металлы жизни находятся в организме в виде свободных катионов, или являются ионами-комплексообразователями, связанными и биолигандами. В виде свободных катионов находятся только К и Na, катионы кальция и магния находятся как в свободном, так и в связанном состоянии. Катионы остальных металлов входят в состав биокомплексов организма, устойчивость которых варьирует в широких пределах.
Кроме названных элементов в состав живых организмов входят многие другие. Все эти элементы называют биогенными. Перечислить все биогенные элементы в настоящее время невозможно из–за трудности определения очень низких концентраций элементов и установления их биологических функций. Однако биогенность следующих неметаллов: F , Cl , Br , I , Si , Se , As и металлов: Li , Ba , Sr , Sn , Ti , V , Cr практически не вызывает сомнений.
Элементы, содержание которых в организме больше 10-3%, называют макроэлементами. Главная функция их состоит в построении тканей и поддержании осмотического, водно–электролитного, кислотно-–основного, окислительно-восстановительного и металло–лигандного гомеостаза.
Элементы, содержание которых в организме находится в пределах 10-6 – 10-3%, называют микроэлементами. Они входят в состав ферментов, гормонов, витаминов и других биологически активных соединений или активаторов обмена веществ.
Количественное содержание микроэлементов в организме человека подвержено значительным колебаниям и зависит от ряда условий: возраста, пола, времени года и суток, условий труда, вида трудовой деятельности, а также различных физиологических и патологических состояний.
Натрий и калий
В организме взрослого человека содержится около 100г катионов натрия, при этом в сутки поступает Na+ 8-12 г, K+ 2-6 г.
Ионы натрия и калия имеют устойчивую электронную структуру, низкую плотность, положительный заряд, поэтому они не проявляют склонность к комплексообразованию.
Они обладают различной способностью к гидратации (плотность положительного заряда у Na+ выше, поэтому он сильнее удерживается водой). Именно поэтому К+ и Na+ в организме являются антагонистами, К+ находится во внутриклеточных жидкостях, а Na+ в межклеточных.
Концентрация ионов калия внутри клетки в 35 раз выше, чем вне ее, а концентрация ионов натрия во внеклеточной жидкости в 15 раз больше, чем внутри клетки. Для осуществления многих биологических процессов необходимо постоянно поддерживать такое неравномерное распределение этих ионов, на что требуется затрата энергии. Это реализуется с помощью К– Na насоса, который за счет энергии гидролиза 1 моль АТФ выводит 3 иона натрия из клетки, а 2 иона калия посылает внутрь клетки. В результате внутренняя поверхность мембраны заряжена отрицательно, а внешняя - положительно.
Na+ входит в состав плазмы крови, лимфы, спинномозговой жидкости и межтканевой жидкости. Основная роль – поддержание осмотического давления, удержание воды тканями. Вместе с K+, Ca2+, Mg2+, Cl- ионы Na+ участвуют в процессе передачи нервных импульсов. Высокая концентрация К+ обеспечивает осмотическое давление внутри клетки, активирует ферменты синтеза белка на рибосоме, окисление глюкозы (гликолиз).
Na+ и К+ активируют АТФ – азу (аденозинтрифосфотаза) клеточных мембран, оказывают существенное влияние на деятельность ЦНС. Избыток Na+ в коре головного мозга вызывает депрессию. Избыток К+ в этих же клетках возбуждает ЦНС.
Кальций
Ионы кальция сосредоточены в межклеточных жидкостях. Обмен кальция контролируется гормонами паращитовидных желез, а также витамином D. Поступление кальция из пищи осложняется плохим его всасыванием из-за образования в желудочно-кишечном тракте нерастворимых кальциевых солей жирных кислот.
Основным компонентом костной ткани является гидроксоапатит. Костная ткань обеспечивает поддержания Са2+ на определенном уровне. В заметных количествах в костную ткань включаются и все элементы 2 группы, из которых Be2+, Sr2+, Ba2+ приводят к патологическим изменениям.
Ионы кальция участвуют в передаче нервного импульса, сокращении мышц, регуляции сердечного ритма, в процессе свертывания крови.
Ионы кальция участвуют в передаче нервного импульса, сокращении мышц, регуляции сердечного ритма, в процессе свертывания крови.
Ионы кальция понижают возбудимость ЦНС, поэтому уменьшение их содержания в организме проявляется в судорогах. Ионы Са2+ влияют на кислотно-щелочной баланс организма, действие эндокринных желез, обладают противовоспалительным и антиаллергическим действием.
Общая концентрация ионов кальция в плазме крови составляет 2,5·10-3 м, из них 40% связаны в комплексы с белками, 14% - в комплексы с лактатами и цитратами и 46% в ионизированной форме.
Если концентрация в плазме превысит 3,75·10-3 м, немедленно вводят внутривенно фосфаты натрия и калия, чтобы не произошла остановка сердца. Для связывания Са также используются соли лимонной кислоты, которые предотвращают свертывание крови. В народной медицине лимоны применяются для уменьшения отложения солей.
Марганец
В организме человека около 12 г марганца. Из них 43% –в костях, остальной в мягких тканях.
В биологических системах марганец присутствует в виде Mn2+ или комплексов в аминокислотами, белками, нуклеиновыми кислотами. Эти комплексы активируют большое число разных ферментов, относящихся к классам трансфераз, гидролаз, изомераз. Mn2+ стабилизирует конформацию нуклеиновых кислот, участвует в процессах репликации ДНК, синтезе РНК и белка, таким образом, биогенная функция марганца очень широка. Ионы марганца оказывают влияние на кроветворение, образование костей, минеральный обмен, рост, размножение и другие функции организма.
Важной особенность. Mn2+ является универсализм. Он может выполнять каталитическую функцию подобно Cu2+, Fe2+, Zn2+, но в тоже время действовать подобно Мg2+ и Са2+.
Железо и кобальт
В организме человека содержится около 5 г Fe и 1,2 мг Со. Большая часть железа (70%) содержится в гемоглобине крови, 14% – в костях, 43% – в мышцах, остальное – в мягких тканях. Ежедневное потребление Fe 10-20 мг, Со – 0,3 мг.
К наиболее важным железосодержащим соединениям относятся гемоглобин и содержащие его производные. Существует большая группа (50) Fe – содержащих ферментов – цитохромов, осуществляющих перенос электронов в данной цепи за счет изменения степени окисления:
Fe 3+ ↔ Fe 2+
Fe – содержащими ферментами также являются каталаза и пероксидаза, активные центры которых содержат Fe3+. Каталаза ускоряет реакцию разложения перекиси водорода (с 1 мол. за 1 сек. до 44000 мол. Н2О2), пероксидаза ускоряет реакцию окислительного дегидрирования субстратов RH пероксидом водорода:
2 H 2 O 2 → 2 H 2 O + O
RH + H 2 O 2 → 2 H 2 O + R
Таким образом, эти ферменты защищают клетку от перекиси водорода – продукта свободно-радикального окисления.
В процессе эволюции природа создает замкнутый цикл использования железа. Все субстраты, содержащие гемовое железо, после использования раслагаются до Fe3+, которое в виде молекул FeOOH и FeO · H 3 PO 4 с помощью белка ферритина, депонируются. От ферритина железо переносится через клеточную мембрану и доставляется в костный мозг, где образуется гемоглобин в новых эритроцитах.
Важную роль в организме играют комплексы ферредоксин, рубредоксин и другие железопротеины общей формулы [ FexSxProt], где х принимает значения от 1 до 8. Атомы серы могут быть двух типов из цистеина и «лабильная сера», природа которой не выяснена. Железопротеины являются компонентами различных электронно– транспортных цепей.
При недостатке железа в организме развивается железодефицитная анемия. Для пополнения запасов железа ежедневная доза – 1 мг. При слабости и истощении организма применяют аскорбинат Fe(II), лактат Fe(II), «ферроплекс» (FeSO4 + аскорбиновая кислота).
Со, в основном, содержится в витамине В12. Этот витамин необходим для созревания эритроцитов. Накапливается в печени. Его недостаток вызывает злокачественную анемию.
Задания для самостоятельного изучения:
1. Работа Na – K насоса
2. Биологическая роль селена
Тема « ВЗАИМОСВЯЗЬ ОБМЕНА ВЕЩЕСТВ В ОРГАНИЗМЕ»
Обмен веществ представляет собой стройный ансамбль согласованных химических процессов, которые взаимосвязаны, взаимообусловлены, соподчинены друг другу. Изменение в обмене какой-то группы влечет изменения в обмене других веществ. Так, например, усиленный биосинтез белков, требующий значительных количеств энергии, сопровождается усиленным окислением углеводов и жирных кислот. Взаимосвязь между обменами объясняется общностью многих промежуточных продуктов их расщепления. Взаимопереходы между различными классами органических соединений являются необходимым условием существования живых организмов.
Взаимосвязь обмена нуклеиновых кислот и белков. Биосинтез нуклеиновых кислот зависит от аминокислотного и белкового обмена. Это выражается в том, что образование нуклеозиддифосфатов, нуклеозидтрифосфатов и самих нуклеиновых кислот зависит от наличия в клеточном содержимом соответствующего набора белков–ферментов (ДНК–, РНК–полимераз, а также фермнетов, обеспечивающих синтез пуринового и пиримидинового циклов). Кроме того, именно аминокислоты (асп – в случае пиримидиновых нуклеотидов; гли, асп, глн – в случае пуриновых нуклеотидов) служат основными исходными соединениями для построения пиримидинового и пуринового колец.
Взаимосвязь обмена нуклеиновых кислот и углеводов. В процессе апотомического распада углеводов образуется рибулозо – 5–фосфат – незаменимое соединение для биосинтеза пуриновых и пиримидиновых оснований.
Второй этап взаимосвязи обмена нуклеиновых кислот осуществляется на уровне нуклеозиддифосфатов и нуклеозидтрифосфатов – исходных соединений для синтеза нуклеиновых кислот. АТФ, необходимая для перехода углеводов в нуклеиновые кислоты, образуется в процессе окислительного фосфорилирования на уровне электронно – транспортной (дыхательной) цепи ферментов, что сопряжено с распадом углеводов. Следовательно, от интенсивности дыхания в организме зависит интенсивность биосинтеза нуклеиновых кислот.
Распад нуклеиновых кислот может служить источником соединений, служащих для биосинтеза углеводов, так как высвобождающаяся при гидролизе пуриновых и пиримидиновых нуклеотидов рибоза может переходить в рибозо–5фосфат, из которого в процессе апотомического распада строится глюкозо– 6–фосфат – центральный метаболит в распаде и синтезе углеводов.
Биосинтез углеводов в значительно мере зависит от нуклеинового обмена, так как часть уридинтрифосфата (УТФ) используется для синтеза глюкозо–уридиндифосфата (глюкозо – УДФ) – важнейшего промежуточного продукта в биосинтезе олиго– и полисахаридов.
Взаимосвязь обмена нуклеиновых кислот и липидов. Прямая “субстратная” форма связи не характерна для обмена нуклеиновыхкислот и липидов.
Косвенная взаимосвязь проявляется в том, что b–окисление высших жирных кислот – составных частей большинства липидов служит энергетическим источником для поддержания на достаточном уровне синтеза нуклеозиддифосфатов и нуклеозидтрифосфатов.
Взаимосвязь обмена углеводов и белков. Центральным связующим звеном на пути превращения углеводов в белки является пировиноградная кислота (ПВК), которая образуется при дихотомическом распаде углеводов. ПВК путем переаминирования или восстановительного аминирования превращается в аланин. При карбоксилировании ПВК возникает щавелевоуксусная кислота (ЩУК), из которой образуется аспарагиновая кислота. Вступая в цикл Кребса, ПВК служит источником биосинтеза –a-кетоглутаровой кислоты, из которой путем восстановительного аминирования и переаминирования с аминокислотами образуется глутаминовая кислота. Другими путями из пировиноградной кислоты образуются валин и лейцин, из щавелевоуксусной – треонин, метионин, изолейцин, лизин; из a–кетоглутаровой – пролин, аргинин. Из продуктов апотомического распада глюкозы образуются фенилаланин, тирозин, гистидин. Таким образом, из промежуточных соединений, образующихся при распаде углеводов, в организме могут быть синтезированы все протеиногенные аминокислоты, а из них – белки.
Другие формы взаимосвязи обмена белков и углеводов заключаются в том, что многочисленные белки – ферменты необходимы для процессов распада и синтеза углеводов. В свою очередь, распад углеводов сопровождается синтезом АТФ, что обеспечивает энергетически биосинтез аминокислот и белков.
Взаимосвязь обмена белков и липидов. Распад липидов, как и распад углеводов, обеспечивает, с одной стороны, исходные соединения для биосинтеза аминокислот (а из них белков) и, с другой стороны, поддерживает образование белков энергетически, так как при окислении жиров много энергии запасается в форме АТФ.
Одним из основных продуктов распада липидов является ацетил-СоА. Включаясь в цикл трикарбоновых и дикарбоновых кислот, он обеспечивает синтез a–кетоглутаровой и щавелевоуксусной кислот, а из последней путем декарбоксилирования – пировиноградной кислоты. Из названных кетокислот синтезируются аминокислоты. Обмен глицерина, высвобождаемого при гидролизе триглицеридов, через углеводы ведет к таким аминокислотам, как гистидин, фенилаланин, тирозин, триптофан. Следовательно, все постоянно встречающиеся в белках аминокислоты могут синтезироваться за счет распадающихся липидов.
Возможен также синтез липидов за счет распадающихся белков. Так, при распаде аминокислот образуется пировиноградная кислота. При её окислительном декарбоксилировании возникает ацетил-СоА – исходное соединение для синтеза высших жирных кислот и других составных частей липидов.
Взаимосвязь обмена углеводов и липидов. Связующим звеном при переходе от углеводов к липидам является пировиноградная кислота и ацетил–СоА. Пировиноградная кислота путем окислительного декарбоксилирования превращается в ацетил–СоА, который служит исходным соединением для синтеза в организме высших жирных кислот, триглицеридов и других липидов.
3–Фосфоглицериновый альдегид, возникающий при дихотомическом распаде углеводов, изомеризуясь, превращается в фосфодиоксиацетон, при восстановлении которого образуется фосфоглицерин, необходимый для синтеза простых и сложных липидов. Ацетил–СоА и глицерин – главные продукты распада липидов – служат исходными соединениями для синтеза углеводов. Ацетил-СоА превращается в пировиноградную кислоту, а из неё – в углеводы путем обращения дихотомического пути распада последних. Превращение глицерина в углеводы идет через 3-фосфоглицериновый альдегид, а затем описанным выше способом.
Таким образом, общий ход биохимических процессов в организме представляет собою единое целое, а организм – самонастраивающуюся, саморегулируемую систему, поддерживающую свое существование путем обмена веществ.
ЛИТЕРАТУРА
1. Филиппович Ю. В. Биологическая химия: учеб. пособие для студ. высш. учеб. заведений / [Ю. В. Филиппович, Н. И. Ковалевская, Г. А. Севастьянова и др.]; под ред. Н. И. Ковалевской. 3-е изд., испр. – М.: Издательский центр «Академия», 2009. –256 с.
2. Березов Т. Т. Биологическая химия: Учебник.– 3-е изд., перераб. и доп. / Т. Т. Березов, Б. Ф. Коровин.– М.: Медицина, 1998.– 704 с.
3. Ленинджер А. Основы биохимии / А. Ленинджер. – М.: Мир, 1985, –1055 с.
4. Страйер А. Основы биохимии / А. Страйер. – М.: Мир, 1984. –Т. 1. 230 с., Т. II. –307 с, Т. III. – 397 с.
5. Марр Р. Биохимия человека / Р. Марр [и др.]. – М.: Мир, 1993.
6. Жеребцов Н. А. Биохимия : учебник / Н. А. Жеребцов [и др.]. –Воронеж: Издательство Воронежского государственного университета, 2002. –696 с.
7. Комов В. П. Биохимия : учебник для вузов / В. П. Комов, В. Н. Шведова. – М.: Дрофа, 2004. – 640 с.
8. Слесарев В. И. Основы биохимии живого : учебник для вузов / В. И. Слесарев. – СПб: Химиздат, 2000. –768 с.
9. Красильникова Л. А. Биохимия растений / Л. А. Красильникова, [и др.]. - Ростов н/Д: Феникс, 2004. – 224 с.
10. Пустовалова Л. М. Основы биохимии / Л. М. Пустовалова. – Ростов н/Д: Феникс, 2003. – 448 с.
Примерные темы курсовых работ:
1. Кислотно-основные свойства аминокислот и пептидов
2. Биологическая роль природных пептидов
3. Болезни, связанные с нарушением фолдинга белков
4. Защитные белки
5. Ферменты и здоровье
6. Устранение повреждений в процессе репликации ДНК
7. Стрессовые белки
8. Гликопротеины, строение биологическая роль в организме
9. Генная инженерия, ее задачи и возможности
10. Функциональная роль витаминов и коферментов
11. Повреждения первичной структуры ДНК и их причины
12. Старение организма – особая биологическая функция
Примерные темы рефератов
1. Оперонный уровень регуляции обмена веществ.
2. Механизм действия инсулина.
3. Механизм действия фитогормонов.
4. Биогенные амины и их общебиологическое значение.
5. Гормоны щитовидной железы: структура, биосинтез и механизм действия.
6. Молекулярная эволюция и возникновение жизни.
7. Биоактивные соединения, их место и роль в живой природе.
8. Нуклеиновая кислота – нить жизни.
9. Биохимики – лауреаты Нобелевской премии.
10. Задачи биохимии в решении продовольственной программы.
11. Основные этапы развития биологической химии.
12. Строение и функции протонной АТФазы.
Приложение 1
Протеиногенные аминокислоты
| Аминокислота | Формула кислоты | Сокращенное обозначение |
| Глицин | NH2-CH2-COOH | гли |
| Аланин | NH2-CH-COOH | CH3 | ала |
| Валин | NH2-CH-COOH | CH-(CH3)2 | вал |
| Лейцин | NH2-CH-COOH | CH2- CH -(CH3)2 | лей |
| Изолейцин | NH2-CH-COOH | (CH3)2-CH- CH3 | илей |
| Аспарагиновая кислота | NH2-CH-COOH | CH2-COOH | асп |
| Глутаминовая кислота | NH2-CH-COOH | ( CH2)2-COOH | глу |
| Серин | NH2-CH-COOH | CH2-OH | сер |
| Треонин | NH2-CH-COOH | CH3-CH-OH | тре |
| Цистеин | NH2-CH-COOH | CH2-SH | цис |
| Метионин | NH2-CH-COOH | (CH2)2-SCH3 | мет |
| Аргинин | NH2-CH-COOH | ( CH2)3-NH-C=NH | NH2 | арг |
| Лизин | NH2-CH-COOH | ( CH2)4-NH2 | лиз |
| Гистидин | NH2-CH-COOH | CH2-C–N || || HC CH \ / NH | гис |
| Пролин | - H2 C– CH2 | | H2C CH-COOH \ / NH | про |
| Фенилаланин | NH2-CH-COOH | CH2-C6H5 | фен |
| Тирозин | NH2-CH-COOH | CH2-C6H4-OH | тир |
| Триптофан | NH2-CH-COOH | CH2-C _ / \\ || || | \ / \ // NH | три |
| Аспарагин | NH2-CH-COOH | CH2-CONH | асн |
| Глутамин | NH2-CH-COOH | (CH2)2-CONH | глн |
| Оксипролин | - HO- HC– CH2 | | H2C CH-COOH \ / NH | окс |
| Орнитин | NH2-CH-COOH | ( CH2)3-NH2 | орн |
Приложение 3
ГЕНЕТИЧЕСКИЙ КОД РНК
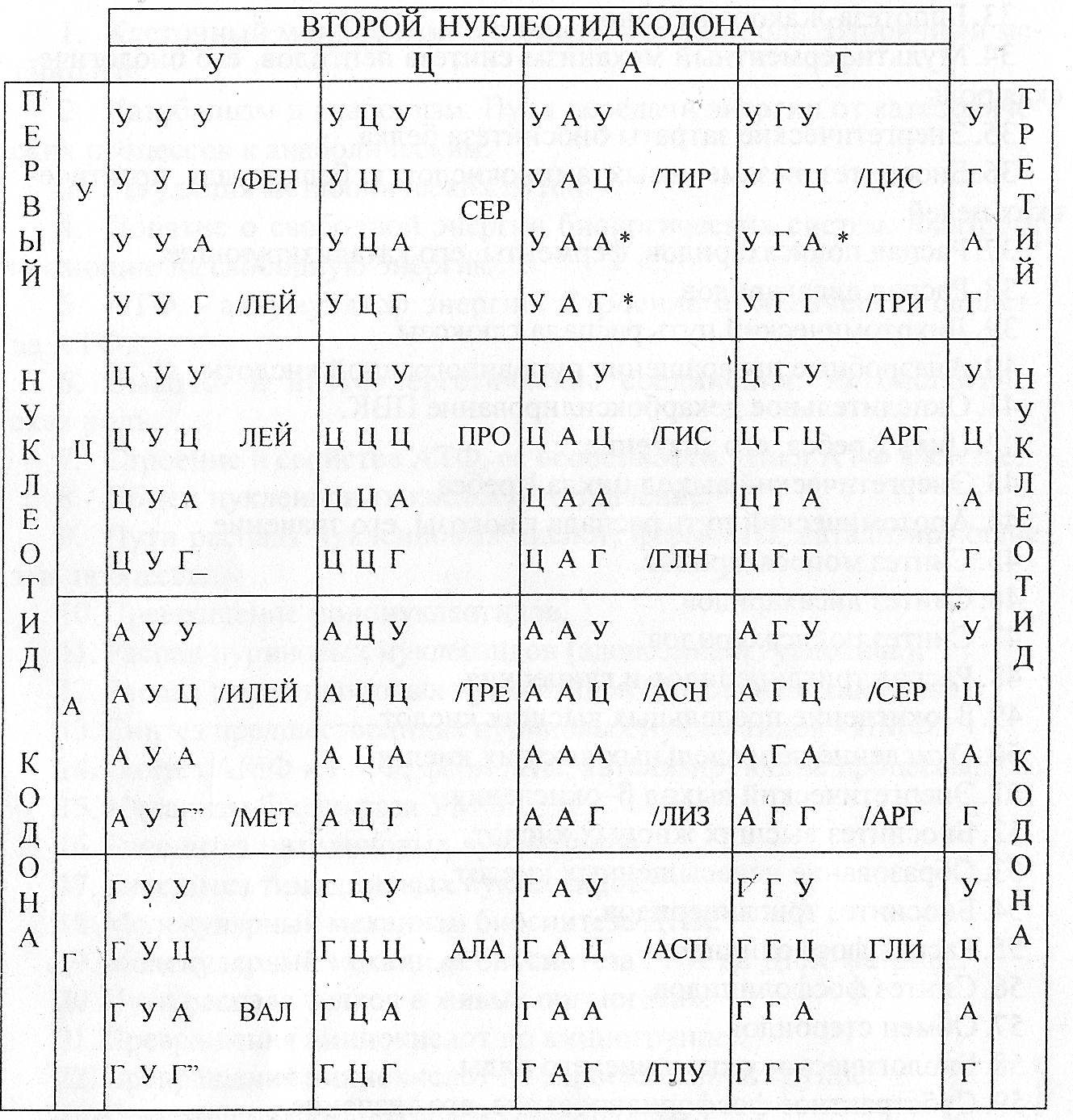
*терминационные кодоны
“ инициирующие кодоны (если находятся в начале считываемого участка и РНК)
СОДЕРЖАНИЕ
Предисловие…………………………………………………..3
Белки…………………………………………………………..5
Нуклеиновые кислоты………………………………………16
Витамины……………………………………………………26
Ферменты……………………………………………………36
Гормоны……………………………………………………..44
Обмен веществ и энергии…………………………………..51
Обмен нуклеиновых кислот………………………………..58
Обмен белков………………………………………………..71
Обмен углеводов…………………………………………….84
Пути обмена липидов……………………………………….96
Биологическое окисление…………………………………108
Обмен воды. Минеральный обмен………………………..115
Взаимосвязь обменов веществ…………………………….125
Словарь терминов…………………………………………..134
Литература………………………………………………….140
Примерные темы рефератов………………………………141
Примерные темы курсовых работ…………………………141
Вопросы к итоговому контролю…………………………..142
Приложения…………………………………………………147
Основы биологической химии
Курс лекций
для
иностранных студентов направления
«Педагогическое образование»
профилей «Химия», «Биология», «Естествознание»
Воронеж
ВГПУ
2019
УДК 577.1 (076.5)
ББК 28.072 я 7
М54
С о с т а в и т е л ь:
канд. техн. наук, доц. каф. химии Н.И.Кочергина
Р е ц е н з е н т ы:
канд. биол. наук, доц. каф. биохимии и биотехнологии Г.П.Шуваева (ВГУИТ)
докт. биол. наук, проф. каф. биологии растений и животных И.Д.Свистова (ВГПУ)
Основы биологической химии: курс лекций для иностранных студентов направления Педагогическое образование профилей «Химия», «Биология», «Естествознание» - Воронеж: ВГПУ, 2019 -151 с.
Пособие включает краткое содержание тем учебной программы по биологической химии
УДК 577.1 (076.5)
ББК 28.072 я 7
Учебное издание
Основы биологической химии
курс лекций для иностранных студентов направления Педагогическое образование профилей «Химия», «Биология», «Естествознание»
С о с т а в и т е л ь: канд. техн. наук, доц. каф. химии Н.И.Кочергина
…
Природа неисчерпаема: первейший ее
принцип – это организация.
Соединяя два объекта, природа всегда
образует нечто новое, с новыми свойствами,
которые нельзя выразить через
свойства компонентов.
Альберт Сент-Дьёрдьи
ПРЕДИСЛОВИЕ
Изучение курса биологической химии способствует более глубокому усвоению студентами естественно-географического факультета специальных биологических дисциплин.
Программа по данному предмету предусматривает изучение основных классов биомолекул, их взаимосвязи, а также закономерности протекания обменных процессов. Динамическая биохимия включает вопросы биоэнергетики и биокатализа, анаболизма и катаболизма углеводов, нуклеиновых кислот, белков, жиров и сопряженные с ними биоэнергетические процессы. В анаболизме нуклеиновых кислот и белков особое внимание обращено на вопросы, связанные с важнейшей проблемой молекулярной биологии – переносом генетической информации. При освещении вопросов биоэнергетики рассматриваются строение, функции и свойства макроэргических соединений, особенно АТФ.
Учебное пособие содержит краткое содержание темы, задачи и тесты.
Предлагаемые задания по изучаемым темам преследуют цель выявить умения студентов работать с учебной литературой, самостоятельно отбирать, анализировать и обобщать материал, грамотно отвечать на поставленные вопросы, владеть химической символикой.
Основной целью издания является развитие у студентов умения использовать знания, полученные при изучении курса биоорганической химии, изучение метаболических процессов, происходящих в живых организмах, рассмотрение взаимосвязей этих процессов.
Настоящее методическое пособие поможет студентам в самостоятельной подготовке к семинарским занятиям. Работа с тестами будет способствовать укреплению знаний по биохимии, концентрации внимания студентов на основных моментах изучаемого материала.
Данное учебно-методическое пособие поможет студентам освоить необходимые компетенции и результатом изучения дисциплины биологическая химия станут следующие знания, умения, навыки:
знания
- компонентов современной естественнонаучной картины мира,
- основных этапов развития естествознания, специфики живого;
- биохимическихоснов единства органического мира, молекулярныхоснов наследственности и изменчивости;
- механизмов регуляции метаболических процессов в процессе жизнедеятельности организма;
- методов теоретического и эмпирического исследований в естественных науках;
биохимическихвопросов и объема материала, который входит в содержание школьных курсов химии и биологии;
умения:
- использовать методы теоретического и эмпирического исследований при проектировании учебного процесса в естественнонаучном образовании;
- показывать взаимосвязь биохимических процессов, протекающих в живых системах; роль мультиэнзимных систем в биохимических процессах;
- объяснять процессы метаболизма биомолекул в живых организмах; пути передачи наследственной информации, регуляции обменных процессов в живых системах;
- связать усвоение биохимического содержания с усвоением методов, форм и средств его преподавания в школе;
навыки:
- самостоятельно выбирать цель исследования, формулировать проблему и гипотезу исследования;
- проведения простейшего химического эксперимента при изучении химических свойств биомолекул.
Тема «АМИНОКИСЛОТЫ. БЕЛКИ»
Белки – высокомолекулярные азотистые органические соединения, состоящие на 99% и более из химических элементов – углерода, кислорода, азота и водорода.
Впервые белок был выделен Я.Беккари из пшеничной муки в 1728 г. К настоящему времени из природных источников выделены и изучены сотни различных белков.
Белки – важнейшие незаменимые компоненты живого. Белковые тела играют решающую роль и в построении живой материи, и в осуществлении всех процессов жизнедеятельности. «Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким – либо белковым телом, и повсюду, где мы встречаем какое – либо белковое тело, которое не находится в процессе разложения, мы без исключения встречаем и явления жизни» (Энгельс Ф. Анти-Дюринг)
На долю белков приходится основная масса сухого вещества (55 – 85%) активно растущей клетки. В самой маленькой и просто устроенной бактериальной клетке обнаружено более 2000 различных белков, выполняющих самые разнообразные функции.
Структурными единицами (блоками) служат аминокислоты. В состав белков входят 20 типов аминокислот, носящих название белковых аминокислот (протеиногенных)
Аминокислоты – амфотерные электролиты, каждая из них имеет характерную изоэлектрическую точку. На электрохимических свойствах аминокислот основано их разделение методами электрофореза, ионообменной хроматографии, электрофокусирования. В результате наличия в аминокислотах a-аминогруппы они обладают высокой реакционной способностью. Специфические реакции аминокислот нашли широкое применение в методах количественного определения.
Определенная последовательность аминокислот в белках обуславливает их физико-химические свойства и биологическую функцию. 20 аминокислот при их разнообразном сочетании и повторяемости в полипептидной цепи дают практически неограниченные возможности для синтеза самых различных белков.
По значению для животных и человека аминокислоты разделяют на заменимые и незаменимые (табл. 1).
Таблица 1
Значение аминокислот для животных и человека
| Незаменимые аминокислоты | Частично заменимые | Заменимые аминокислоты |
| валин | аргинин | аспарагиновая кислота |
| гистидин | глицин | глутаминовая кислота |
| изолейцин | цистин | аланин |
| лейцин | тирозин | серин |
| лизин | пролин | |
| метионин | оксипролин | |
| треонин | цистеин | |
| триптофан | ||
| фенилаланин |
Определенная последовательность аминокислот в белках обусловливает их физико-химические свойства и биологическую функцию. 20 типов белковых аминокислот при их разнообразном сочетании и повторяемости в полипептидной цепи дают практически неограниченные возможности для синтеза самых различных белков.
Аминокислоты, входящие в состав белка, придают ему специфические электрохимические свойства, которые обусловливают их гидрофильность, растворимость и осаждаемость из растворов.
Белки – высокомолекулярные азотистые органические соединения, состоящие на 99% и более из химических элементов – углерода, кислорода, азота и водорода. Эти элементы способны к образованию ковалентных связей, обуславливают прочность белковых структур, а углерод с его способностью к созданию конъюгированных соединений является основой возникновения в белке каталитических функций, играющих важную роль в обмене веществ живой клетки.
Дата: 2019-07-30, просмотров: 352.