Потенциометрия
Измерение ЭДС гальванических элементов в целях физико-химического анализа. Данный подход обозначается как потенциометрия. Возможные его применения весьма многообразны.
а) Например, найдя для OB-реакции ΔΨрц (при нескольких температурах), можно рассчи-тать термодинамические параметры этой реакции — ΔGрц, ΔG0рц, Kp, ΔН0рц и ΔS0рц.
б) С помощью потенциометрии определяют также характеристики растворенного вещества:
- коэффициент активности сильного электролита (активность рассчитывают по формуле Нернста и сравнивают с реальной концентрацией),
- рН раствора и
- константу кислотности слабого электролита (в эквимолярной буферной смеси, составленной с участием этого электролита, рН совпадает с pKa), и т.д.
2. Подробней остановимся на потенциометрическом титровании.
а) Это метод, используемый для определения концентрации какого-либо вещества (электролита). – Составляют гальванический элемент; в полуэлемент с исследуемым раствором последовательно добавляют титрант и измеряют каждый раз ЭДС элемента.
б) В критической точке титрования происходит резкое изменение ЭДС.
3. Пример: титрование раствора FeCl3 раствором SnCl2.
а) Пусть требуется определить в растворе концентрацию соли FeCl3. Составим гальванический эле-мент (рис. 15.6): один электрод водородный, другой — редокс-электрод с изучаемым раствором FeCl3.
б) В принципе, некоторое количество ионов Fe3+ могло бы восстанавливаться за счет окисления H2. Но из-за высокого сопротивления во внешней цепи этот процесс совершенно незначителен. Поэтому до титрования в левом полуэлементе ОВ-пары ещѐ нет, так как имеется только один ее компонент — ионы Fe3+.
в) Начнем добавлять к раствору FeCl3 в данном полуэлементе раствор соли SnCl2 .
Будет происходить реакция:
Поскольку появятся ионы Fe2+, то образуется пара Fe3+/Fe2+, и измеряемая ЭДС будет определяться соотношением еѐ компонентов:
ΔΨ = Ψ (Fe3+/Fe2+) = Ψ0Fe3+/Fe2+) + 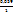 ∙ lg
∙ lg 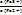 . (15.26,а-б)
. (15.26,а-б)
г) А. По мере добавления SnCl2 отношение c(Fe3+)/c(Fe2+) и, следовательно, ЭДС будет снижаться (ветвь I на рис. 15.7).
Б. В критической точке титрования (КТТ) будет оттитровано всѐ количество Fe3+, так что в растворе останутся только про-дукты реак-ции – ионы Fe2+ и Sn4+, т.е. ОВ-пары в растворе вновь больше нет. Но определить прохождение системой КТТ можно лишь после дальнейшего титрования.
д) А. Действительно, при добавлении очередных порций раствора SnCl2 в системе возник-нет новая ОВ пара – Sn4+/Sn2+, и теперь ЭДС определяется ею (ветвь II на рис. 15.7):
ΔΨ = Ψ (Sn4+/Sn2+) = Ψ0 (Sn4+/Sn2+) + 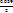 ∙ lg
∙ lg 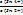 . (15.27,а-б)
. (15.27,а-б)
Б. По мере добавления SnCl2 соотношение c(Fe3+)/c(Fe2+) тоже падает, так что ΔΨ про-должает снижаться.
е) Но теперь критический объѐм титрования (VКТТ) легко определить по точке перегиба кривой – от ветви I к ветви II. Тогда, зная количество соли в этом объѐме, можно найти и количе-ство исчезнувшей соли FeCl3 (оно в 2 раза больше), а значит и концентрацию FeCl3 в исходном растворе.
ж) Кроме того, можно оценить и стандартные редокс-потенциалы обеих ОВ пар, если они неизвестны. Действительно,
при V1 = 0,5 VКТТ ΔΨ = Ψ0 (Fe3+/Fe2+), (15.28, а-б)
а при V1 = 2 VКТТ ΔΨ = Ψ0 (Sn4+/Sn2+) (15.29, а-б)
Заметим, что самомỳ критическому объѐму (VКТТ ) соответствует такое ΔΨ, которое равно среднему арифметическому значению Ψ0 (Fe3+/Fe2+) и Ψ0 (Sn4+/Sn2+).
Дата: 2019-07-30, просмотров: 316.