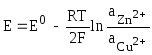 .
.
Схематическое изображение гальванического элемента Даниэля-Якоби
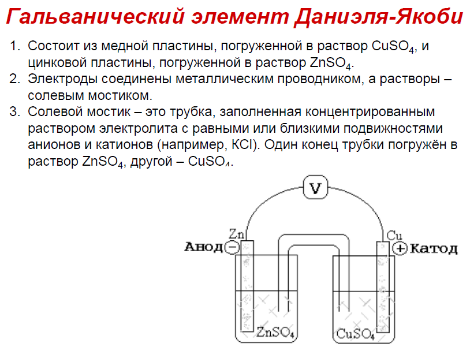
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
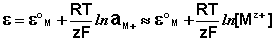 (III.40)
(III.40)
В уравнении Нернста ε° – стандартный электродный потенциал, равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться.
Рассмотрим расчёт ЭДС элемента Даниэля-Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
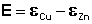 (III.41)
(III.41)
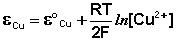 (III.42)
(III.42)
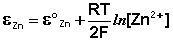 (III.43)
(III.43)
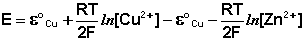 (III.44)
(III.44)
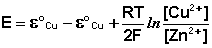 (III.45)
(III.45)
Как видно из уравнения (III.45), ЭДС элемента Даниэля-Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
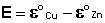 (III.46)
(III.46)
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается.
18. Кондуктометрические методы анализа. Кондуктометрический метод определения степени и константы диссоциации слабого электролита в водных растворах. Кондуктометрическое титрование сильных и слабых электролитов.
После рассмотрения основ электропроводности растворов кратко остановимся на использовании этого явления в целях физико-химического анализа.
а) Измерение электропроводности раствора электролита называется кондуктометрией (от англ. «to conduct» — проводить).
б) Для подобных измерений созданы специальные приборы — кондуктометры.
В основе их — схема из четырех сопротивлений — мост Уитстона (рис. 13.6). Исследуемый раствор помещают в кондуктометрическую ячейку, после чего этот раствор служит одним из сопротивлений схемы, а именно, сопротивлением Rχ.
Еще одно сопротивление является переменнным (Rупр). Изменяя его, добиваются того, чтобы разность потенциалов между точками А и В обратилась в нуль.
в) Тогда выполняются соотношения:
откуда измеряемое сопротивление равно
(13.55)
г) Зная его и параметры ячейки (l, S), по формулам (13.28—13.30) нетрудно найти удельную и эквивалентную электропроводность:
Из многих применений кондуктометрии отметим лишь два.
1. Определение степени и константы диссоциации слабого электролита.
Вариант I. Для ионов, на которые диссоциирует электролит, известны предельные эквивалентные подвижности — λ 01и λ 02.
а) Исходя из формулы (13.50), получаем:
б) Следовательно, определив экспериментально λ, можно оценить степень диссоциации слабого электролита при данной его концентрации.
в) А зная α — с помощью закона разведения Оствальда рассчитать и константу диссоциации:
Вариант II.
Величины λ 01и λ 02 неизвестны. Как в этом случае найти α и Ka?
а) Соотношение (13.56, а) можно записать и так:
где λ0— предельная эквивалентная проводимость раствора. Подставляем его в (11.25):
б) Последнее уравнение преобразуем к виду:
что после деления на λ дает:
В итоге получается линейная зависимость χ (удельной электропроводности) от 1/λ (рис. 13.7).
в) Следовательно, если по экспериментальным данным построить график такой зависимости, то по точке его пересечения с осью абсцисс можно найти 1/λº, затем для какой-либо концентрации — α (по формуле (13.56,6)) и, наконец, Ka (11.25).
г) Что касается Ka, то можно воспользоваться и указанным графиком:
2. Кондуктометрическое титрование.
а) А этот метод применяется для определения концентрации веществ. Принцип основан на том, что в т.н. критических точках титрования (КТТ) резко меняется зависимость проводимости раствора от количества титранта. Три примера кривых титрования приведены на рис. 13.8.
б) Чтобы объяснить первую кривую, обратимся к реакции
I. При добавлении в ячейку NaOH подвижные ионы H+ связываются с гидроксил–ионами b заменяются на менее подвижные ионы Na+. Поэтому электропроводность ячейки снижается и в критической точке титрования (VKTT) она минимальна.
II. Но затем, по мере добавления избыточных количеств ионов Na+ и OH-, которые уже ни с чем не связываются и ничего не замещают, а просто накапливаются в ячейке, электропроводность, очевидно, опять повышается.
в) При титровании слабого электролита (рис. 13.8,б) небольшой подъем χ наблюдается за-долго до VKTT — из-за того, что увеличивается степень диссоциации электролита. Но после VKTT проводимость начинает возрастать гораздо быстрей.
Дата: 2019-07-30, просмотров: 351.