Теория растворов сильных электролитов Дебая – Хюккеля.
В 1923 г Дебай и Хюккель вывели формулу для расчета коэффициента активности разбавленных водных растворов с ионной силой I >0,01:
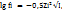
где fi – коэффициент активности i – катиона (аниона);
zi - заряд i – катиона (аниона). Активность ионов зависит от концентрации электролита, природы ионов и температуры.
Приближенные коэффициенты активности некоторых ионов при различной ионной силе раствора сведены в таблицы.
Теория Дебая-Хюккеля оказалась очень полезной для объяснения свойств электролитов. Она представляет собой предельный закон для малых концентраций. Уравнение превосходно согласуется с экспериментом при значениях ионной силы, меньших 0,01. При более высоких значениях ионной силы можно воспользоваться уточненными законами уравнения Дебая-Хюккеля.
Активность ионов и коэффициент активности. Расчет коэффициентов активности.
Под активностью электролита понимают эффективную концентрацию, в соответствии с которой он участвует в различных процессах. Активность связана с истинной концентрацией растворенного вещества соотношением: а(Х) = f(X)*c(X),
где а(X) – активность электролита Х, моль/л;
f(Х) - коэффициент активности;
с(Х) – молярная концентрация электролита, моль/л.
Коэффициент активности f характеризует влияние электростатических сил на способность ионов к химическому взаимодействию. В очень разбавленных растворах f = 1, т.е. ионы ведут себя согласно истинной концентрации. В не очень разбавленных растворах сильных электролитов межионные взаимодействия определяются зарядами ионов и их концентрацией.
Активность ионов зависит от концентрации электролита, природы ионов и температуры. С уменьшением концентрации раствора (уменьшением ионной силы) коэффициенты активности возрастают и при предельном разбавлении стремятся к единице. В растворах, содержащих многозарядные ионы, наиболее сильно проявляются межионные взаимодействия и активность ионов уменьшается. При увеличении температуры усиливается тепловое движение, которое способствует разрушению “ионной оболочки” и следовательно активность ионов возрастает.
Ионная сила раствора. Правило ионной силы Льюиса.
Количественной характеристикой межионных электростатических взаимодействий является ионная сила раствора I
Ионная сила раствора I- это величина, измеряемая полусуммой произведений концентраций всех находящихся в растворе ионов на квадрат их заряда: 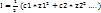
Правило ионной силы: “Коэффициент активности сильного электролита в растворе определяется только ионной силой, но не химической природой электролита.”
Уравнение Нернста.
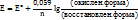
Е- стандартный электродный потенциал
n – число электронов, присоединяемых или теряемых одной частицей вещества
уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Электроды I рода. Водородный газовый электрод. Устройство водородного газового электрода. Электродная реакция, протекающая при работе этого электрода. Схематическая запись и формула Нернста для потенциала водородного газового электрода.
Электродами первого рода называют электроды с активной твёрдой или газообразной формой, обратимые либо относительно катионов, либо только относительно анионов.
К ним относятся: металлические электроды, обратимые относительно катионов, металлоидные электроды, обратимые относительно анионов, и газовые электроды, обратимые или по отношению к анионам, или к катионам.
(обратимость относительно тех или иных ионов означает зависимость его потенциала от концентрации данных ионов)
Газовые электроды, обратимые относительно анионов, обычно образуются при опускании инертного металла, насыщенного газом, в раствор хорошо растворимого электролита, анионом которого является восстановленная форма газа.
Примером таких электродов являются: (Pt)Cl2| HCl; (Pt)O2 | NaOH.
На их поверхности протекает реакция газ+ ze= анион. Например, в кислородном электроде: O2 + 2H2O +4e = 4OH-; в хлорном Сl2 +2e = 2Cl-. Их потенциал описывается выражением: φ=φ0+𝑅𝑇𝑧𝐹𝑅𝑇𝑙𝑛(𝑎ГАЗ𝑎АНИОН)=φ0−𝑅𝑇𝑧𝐹𝑅𝑇𝑙𝑛(𝑎АНИОН)
Газовые электроды могут быть обратимыми и относительно катиона. Типичным примером такого электрода является водородный электрод, характеризующийся реакцией: H2 -2e = 2H+
Ионнообменные электроды. Стеклянный электрод. Схема записи электрода. Электродный процесс на стеклянном электроде. Уравнение Нернста для стеклянного электрода. Применение стеклянного электрода в лабораторной практике: преимущества и недостатки.
Особенность данных электродов состоит в том, что они включают такую (обычно твердую) фазу, которая избирательно высвобождает в раствор или сорбирует из него те или иные ионы. Это приводит к созданию разности потенциалов
Наиболее известным и важным является стеклянный электрод, используемый в рН-метрах. Он представляет собой хлорсеребряный электрод, заключенный в стеклянную оболочку из специального токопроводящего стекла, заканчивающуюся тонкостенным шариком. Ag| AgCl| HCl
Принцип действия основан на том,что стеклянный электрод долго находится в воде. При этом в поверхностном слое стекла происходит гидролиз силиката Na:
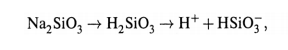
Ионы водорода частично переходят в раствор, что создает разность потенциалов (∆Ψ) между поверхностью и жидкой средой. Ясно, что величина ∆Ψ зависит от концентрации ионов H + в растворе.
Причем, в данном случае у нас — две поверхности: - внутренняя, где скачок потенциала (∆Ψin) постоянен и определяется раствором НСl внутри стеклянного электрода; - внешняя, где скачок потенциала (∆Ψex) зависит от рН исследуемого раствора. Следовательно, зависит от рН и разность потенциалов, измеряемая в элементе между внутренней и внешней средами.
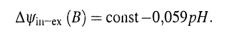
Для измерения pH широко применяется стеклянный электрод. Применение стеклянного электрода основано на том, что стекло содержит катионы, которые могут обмениваться с катионами, находящимися в растворе.
Стеклянный электрод имеет высокое сопротивление, отсюда требование к измерительному рН-метру. Другой недостаток – ограничение диапазонов рН. При высоких рН происходит нарушение соотношения 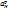 > >
> > 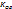
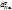 (К – константа обмена, а – равновесные активности катионов натрия и водорода в растворе) и электрод становится обратимым относительно катионов натрия. Также потенциал изменяется во времени, правильные результаты при работе можно получить только при регулярной градуировке электрода. Главный «+» - индифферентность (безразличие) электрода к окислителям и восстановителям.
(К – константа обмена, а – равновесные активности катионов натрия и водорода в растворе) и электрод становится обратимым относительно катионов натрия. Также потенциал изменяется во времени, правильные результаты при работе можно получить только при регулярной градуировке электрода. Главный «+» - индифферентность (безразличие) электрода к окислителям и восстановителям.
Окислительно-восстановительные электроды. Хингидронный электрод. Устройство и схема записи электрода. Реакция, протекающая на хингидронном электроде. Уравнение Нернста для этого электрода. Применение хингидронного электрода в лабораторной практике.
а) В принципе, каждый электрод является окислительно-восстановительным. Но под термином «редокс-электроды» понимают такие полуэлементы, где все компоненты полуреакции (Ох и Red) находятся в растворе; металлические же электроды, погруженные в раствор, в реакции не участвуют, а служат лишь переносчиками электронов.
б) Компонентами ОВ-пары при этом могут быть неорганические вещества
Однако для органических веществ редокс-электроды особенно важны, т.к. являются единственным способом образовать полуэлемент
Наиболее известный пример — хингидронный электрод: (Pt) | 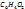 ,
, 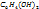 ,
, 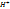
Здесь платиновая пластинка погружена в насыщенный раствор хингидрона в присутствии твердого хингидрона. Растворенный хингидрон диссоциирует на эквивалентные количества хинона (Ох) и гидрохинона (Rd), связанные реакцией восстановления
В данной полуреакции фигурируют протоны; поэтому потенциал электрода зависит от рН
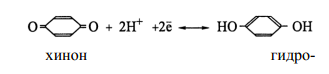
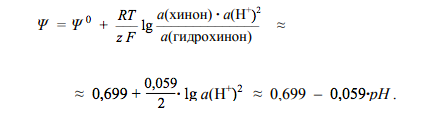
Зависимость потенциала от рН позволяет использовать хингидронный электрод для измерения рН. Правда, в этих целях он применим в области значений рН, не больших 8. Дело в том, что в щелочной среде гидрохинон ведет себя как слабая кислота, т.е. теряет протоны, отчего они перестают фигурировать в уравнении полуреакции.
ХЭ применяют в ряде случаев при потенциометрических измерениях для определения рН раствора.
Потенциометрия
Измерение ЭДС гальванических элементов в целях физико-химического анализа. Данный подход обозначается как потенциометрия. Возможные его применения весьма многообразны.
а) Например, найдя для OB-реакции ΔΨрц (при нескольких температурах), можно рассчи-тать термодинамические параметры этой реакции — ΔGрц, ΔG0рц, Kp, ΔН0рц и ΔS0рц.
б) С помощью потенциометрии определяют также характеристики растворенного вещества:
- коэффициент активности сильного электролита (активность рассчитывают по формуле Нернста и сравнивают с реальной концентрацией),
- рН раствора и
- константу кислотности слабого электролита (в эквимолярной буферной смеси, составленной с участием этого электролита, рН совпадает с pKa), и т.д.
2. Подробней остановимся на потенциометрическом титровании.
а) Это метод, используемый для определения концентрации какого-либо вещества (электролита). – Составляют гальванический элемент; в полуэлемент с исследуемым раствором последовательно добавляют титрант и измеряют каждый раз ЭДС элемента.
б) В критической точке титрования происходит резкое изменение ЭДС.
3. Пример: титрование раствора FeCl3 раствором SnCl2.
а) Пусть требуется определить в растворе концентрацию соли FeCl3. Составим гальванический эле-мент (рис. 15.6): один электрод водородный, другой — редокс-электрод с изучаемым раствором FeCl3.
б) В принципе, некоторое количество ионов Fe3+ могло бы восстанавливаться за счет окисления H2. Но из-за высокого сопротивления во внешней цепи этот процесс совершенно незначителен. Поэтому до титрования в левом полуэлементе ОВ-пары ещѐ нет, так как имеется только один ее компонент — ионы Fe3+.
в) Начнем добавлять к раствору FeCl3 в данном полуэлементе раствор соли SnCl2 .
Будет происходить реакция:
Поскольку появятся ионы Fe2+, то образуется пара Fe3+/Fe2+, и измеряемая ЭДС будет определяться соотношением еѐ компонентов:
ΔΨ = Ψ (Fe3+/Fe2+) = Ψ0Fe3+/Fe2+) + 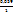 ∙ lg
∙ lg 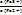 . (15.26,а-б)
. (15.26,а-б)
г) А. По мере добавления SnCl2 отношение c(Fe3+)/c(Fe2+) и, следовательно, ЭДС будет снижаться (ветвь I на рис. 15.7).
Б. В критической точке титрования (КТТ) будет оттитровано всѐ количество Fe3+, так что в растворе останутся только про-дукты реак-ции – ионы Fe2+ и Sn4+, т.е. ОВ-пары в растворе вновь больше нет. Но определить прохождение системой КТТ можно лишь после дальнейшего титрования.
д) А. Действительно, при добавлении очередных порций раствора SnCl2 в системе возник-нет новая ОВ пара – Sn4+/Sn2+, и теперь ЭДС определяется ею (ветвь II на рис. 15.7):
ΔΨ = Ψ (Sn4+/Sn2+) = Ψ0 (Sn4+/Sn2+) + 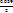 ∙ lg
∙ lg 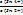 . (15.27,а-б)
. (15.27,а-б)
Б. По мере добавления SnCl2 соотношение c(Fe3+)/c(Fe2+) тоже падает, так что ΔΨ про-должает снижаться.
е) Но теперь критический объѐм титрования (VКТТ) легко определить по точке перегиба кривой – от ветви I к ветви II. Тогда, зная количество соли в этом объѐме, можно найти и количе-ство исчезнувшей соли FeCl3 (оно в 2 раза больше), а значит и концентрацию FeCl3 в исходном растворе.
ж) Кроме того, можно оценить и стандартные редокс-потенциалы обеих ОВ пар, если они неизвестны. Действительно,
при V1 = 0,5 VКТТ ΔΨ = Ψ0 (Fe3+/Fe2+), (15.28, а-б)
а при V1 = 2 VКТТ ΔΨ = Ψ0 (Sn4+/Sn2+) (15.29, а-б)
Заметим, что самомỳ критическому объѐму (VКТТ ) соответствует такое ΔΨ, которое равно среднему арифметическому значению Ψ0 (Fe3+/Fe2+) и Ψ0 (Sn4+/Sn2+).
Ионнообменные электроды. Стеклянный электрод. Схема записи электрода. Электродный процесс на стеклянном электроде. Уравнение Нернста для стеклянного электрода. Применение стеклянного электрода в лабораторной практике: преимущества и недостатки.
Особенность данных электродов состоит в том, что они включают такую (обычно твердую) фазу, которая избирательно высвобождает в раствор или сорбирует из него те или иные ионы. Это приводит к созданию разности потенциалов
Наиболее известным и важным является стеклянный электрод, используемый в рН-метрах. Он представляет собой хлорсеребряный электрод, заключенный в стеклянную оболочку из специального токопроводящего стекла, заканчивающуюся тонкостенным шариком. Ag| AgCl| HCl
Принцип действия основан на том,что стеклянный электрод долго находится в воде. При этом в поверхностном слое стекла происходит гидролиз силиката Na:
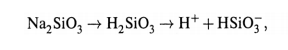
Ионы водорода частично переходят в раствор, что создает разность потенциалов (∆Ψ) между поверхностью и жидкой средой. величина ∆Ψ зависит от концентрации ионов H + в растворе.
Причем, в данном случае у нас — две поверхности: - внутренняя, где скачок потенциала (∆Ψin) постоянен и определяется раствором НСl внутри стеклянного электрода; - внешняя, где скачок потенциала (∆Ψex) зависит от рН исследуемого раствора. Следовательно, зависит от рН и разность потенциалов, измеряемая в элементе между внутренней и внешней средами.

Билет 2
Релакс. и фор.эффекты
Классификация,схема записи и описание хлорсеребрянного проводника.
Билет 3
Молярная электропроводность и факторы, влияющие на неё
Классификация шкал, водородный потенциал
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора Смолярная электропроводность связана следующим соотношением:
λ = 1000к/С ,Ом-1см2моль-1
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λo, называемого молярной электропроводностью при бесконечном разведении
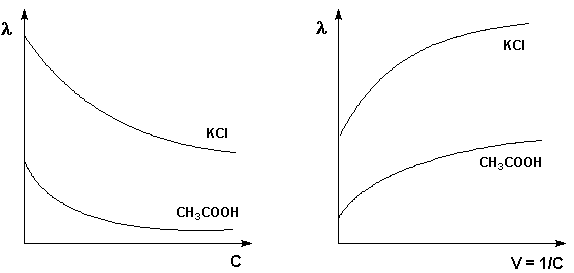
Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса:
λ = α F ( U + + U - )
λ = α (λК + λА) [ λ ] = [см*м2/моль]
2.
Электродами первого рода называют электроды с активной твёрдой или газообразной формой, обратимые либо относительно катионов, либо только относительно анионов.
К ним относятся: металлические электроды, обратимые относительно катионов, металлоидные электроды, обратимые относительно анионов, и газовые электроды, обратимые или по отношению к анионам, или к катионам.
Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах.
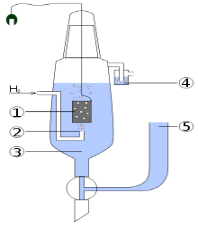 1. Платиновый электрод.
1. Платиновый электрод.
2. Подводимый газообразный водород.
3. Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.
4. Водяной затвор, препятствующий попаданию кислорода воздуха.
5. Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
Дописать.
Билет 4
1. Подвижность и гидротация. Скорость движения ионов. Закон Кольрауша.
2. Электроды 1ого рода. Схема записи, реакция, уравнение Нернста
9. Закон Кóльрауша. Скорость движения и подвижность ионов. Подвижность и гидратация ионов.
Закон Кольрауша:
В бесконечно разбавленном растворе ионы движутся независимо один от другого.
Скорость направленного движения иона, т. е. путь, пройденный ионом в растворе под действием электрического поля в направлении к электроду за единицу времени, зависит от действующей на ион силы, т. е. от напряженности электрического поля:
V = иЕ
где V — скорость движения иона, м/с;
Е - напряженность поля, В/м;
и - коэффициент пропорциональности, называемый электрической подвижностью иона или просто подвижностью иона, м2/(В • с).
ПОДВИЖНОСТЬ ИОНА характеризует его способность преодолевать сопротивление среды при направленном движении в электрическом поле.
Заряд и радиус иона, т. е. его природа: чем больше заряд и чем меньше радиус иона, тем сильнее гидратируется ион, тем ниже подвижность иона в растворе.
Природа растворителя, его диэлектрическая проницаемость и вязкость. Чем полярнее растворитель, тем больше размеры гидратированного иона и меньше его подвижность. Вязкость растворителя обуславливает сопротивление среды движущемуся иону: чем больше вязкость, тем меньше подвижность иона.
Температура раствора. При повышении температуры уменьшаются вязкость растворителя и толщина сольватных оболочек ионов, а также снижается межионное взаимодействие. Все это приводит к увеличению подвижности ионов.
Ионная сила раствора. Чем больше ионная сила раствора, тем сильнее межионное электростатическое взаимодействие и создаваемые им тормозящие эффекты.
Концентрация ионов. Чем больше концентрация ионов в растворе, тем сильнее электростатическое взаимодействие ионов, снижающее их подвижность. Концентрация ионов зависит от силы электролита и его количества в растворе. При разбавлении растворов сильных электролитов подвижность соответствующих ионов растет, поскольку уменьшается их концентрация, а следовательно, снижается межионное взаимодействие в растворе. В растворах слабых электролитов (обычно а < 0,03) подвижность ионов практически не зависит от разбавления, так как концентрация ионов в этих растворах всегда невелика.
Сольватация (гидратация) иона увеличивает его размер и снижает его подвижность.Чем выше диэлектрическая проницаемость (полярность) растворителя, тем сильнее сольватируется ион; при этом увеличиваются его размеры и понижается подвижность.
Предельная подвижность ионов зависит его природы, от природы растворителя и температуры, но не зависит от природы другого иона в данном электролите.
2.------------------
Электродами первого рода называют электроды с активной твёрдой или газообразной формой, обратимые либо относительно катионов, либо только относительно анионов.
К ним относятся: металлические электроды, обратимые относительно катионов, металлоидные электроды, обратимые относительно анионов, и газовые электроды, обратимые или по отношению к анионам, или к катионам.
(обратимость относительно тех или иных ионов означает зависимость его потенциала от концентрации данных ионов)
( переписать стандартный водородный электрод)
Билет 5
1.Кондуктометрия.Кондуктометрическое титрование
2.Электроды.Электроды 2 рода.Схема записи,процесс происходящий на электроде.Формула Нернста.
Кондуктометрия - это метод анализа, основанный на измерении электропроводности анализируемого раствора.
Для подобных измерений созданы специальные приборы — кондуктометры.
В основе их — схема из четырех сопротивлений — мост Уитстона (рис. 13.6).
Кондуктометрическое титрование .
а) А этот метод применяется для определения концентрации веществ. Принцип основан на том, что в т.н. критических точках титрования (КТТ) резко меняется зависимость проводимости раствора от количества титранта. Три примера кривых титрования приведены на рис. 13.8.
б) Чтобы объяснить первую кривую, обратимся к реакции
I. При добавлении в ячейку NaOH подвижные ионы H+ связываются с гидроксил–ионами b заменяются на менее подвижные ионы Na+. Поэтому электропроводность ячейки снижается и в критической точке титрования (VKTT) она минимальна.
II. Но затем, по мере добавления избыточных количеств ионов Na+ и OH-, которые уже ни с чем не связываются и ничего не замещают, а просто накапливаются в ячейке, электропроводность, очевидно, опять повышается.
в) При титровании слабого электролита (рис. 13.8,б) небольшой подъем χ наблюдается за-долго до VKTT — из-за того, что увеличивается степень диссоциации электролита. Но после VKTT проводимость начинает возрастать гораздо быстрей.
2.
Электродом, называют электронопроводящую фазу (металлы или полупроводники), контактирующую с ионным проводником (электролитом).
Электродами второго рода называют сложные многофазные электроды, формально обратимые как относительно катионов, так и относительно анионов.
Состоят из металла, труднорастворимой соли этого металла и второго соединения, хорошо растворимого и содержащего тот же анион, что и труднорастворимая соль.
Хлорсеребрянный электрод имеет обозначение Ag | AgCl | KCl. Он представляет собой серебряную проволоку, покрытую слоем AgCl, опущенную в насыщенный раствор KCl.
ОВ процессом на этом электроде является реакция:
Ag+ +e = Ag0
Ей соответствует электродный потенциал:
EAgCl/Ag = E°Ag+/Ag + RT/nF·ln aAg+ = E°Ag+/Ag + RT/nF·ln ПР(AgCl)/aCl- = E°AgCl/Ag - RT/nF·ln aCl-
Серебряная проволока в электроде контактирует с пастой, представляющей собой перетёртую смесь малорастворимого соединения AgCl c жидким KCl.В пасте хлорид серебра диссоциирует на ионы и образует насыщенный раствор:
AgCl= Ag+ + Cl-
6 билет
1. Потенциометрия. Потенциометрическое титрование.
2. Подвижность ионов и гидратация. Скорость движения ионов. Закон Кольрауша.
Измерение ЭДС гальванических элементов в целях физико-химического анализа. Данный подход обозначается как потенциометрия.
Подробней остановимся на потенциометрическом титровании.
а) Это метод, используемый для определения концентрации какого-либо вещества (электролита). – Составляют гальванический элемент; в полуэлемент с исследуемым раствором последовательно добавляют титрант и измеряют каждый раз ЭДС элемента.
б) В критической точке титрования происходит резкое изменение ЭДС.
3. Пример: титрование раствора FeCl3 раствором SnCl2.
определить в растворе концентрацию соли FeCl3. Составим гальванический эле-мент -один электрод водородный, другой — редокс-электрод с изучаемым раствором FeCl3.
до титрования в левом полуэлементе ОВ-пары ещѐ нет, так как имеется только один ее компонент — ионы Fe3+.
в) Начнем добавлять к раствору FeCl3 в данном полуэлементе раствор соли SnCl2 .
Будет происходить реакция:
Поскольку появятся ионы Fe2+, то образуется пара Fe3+/Fe2+, и измеряемая ЭДС будет определяться соотношением еѐ компонентов:
ΔΨ = Ψ (Fe3+/Fe2+) = Ψ0Fe3+/Fe2+) + 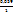 ∙ lg
∙ lg 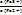 . (15.26,а-б)
. (15.26,а-б)
г) А. По мере добавления SnCl2 отношение c(Fe3+)/c(Fe2+) и, следовательно, ЭДС будет снижаться (ветвь I на рис. 15.7).
Б. В критической точке титрования (КТТ) будет оттитровано всѐ количество Fe3+, так что в растворе останутся только про-дукты реак-ции – ионы Fe2+ и Sn4+, т.е. ОВ-пары в растворе вновь больше нет. Но определить прохождение системой КТТ можно лишь после дальнейшего титрования.
д) А. Действительно, при добавлении очередных порций раствора SnCl2 в системе возник-нет новая ОВ пара – Sn4+/Sn2+, и теперь ЭДС определяется ею (ветвь II на рис. 15.7):
ΔΨ = Ψ (Sn4+/Sn2+) = Ψ0 (Sn4+/Sn2+) + 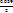 ∙ lg
∙ lg 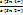 . (15.27,а-б)
. (15.27,а-б)
Б. По мере добавления SnCl2 соотношение c(Fe3+)/c(Fe2+) тоже падает, так что ΔΨ про-должает снижаться.
е) Но теперь критический объѐм титрования (VКТТ) легко определить по точке перегиба кривой – от ветви I к ветви II. Тогда, зная количество соли в этом объѐме, можно найти и количе-ство исчезнувшей соли FeCl3 (оно в 2 раза больше), а значит и концентрацию FeCl3 в исходном растворе.
Заметим, что самомỳ критическому объѐму (VКТТ ) соответствует такое ΔΨ, которое равно среднему арифметическому значению Ψ0 (Fe3+/Fe2+) и Ψ0 (Sn4+/Sn2+).
9. Закон Кóльрауша. Скорость движения и подвижность ионов. Подвижность и гидратация ионов.
Закон Кольрауша:
В бесконечно разбавленном растворе ионы движутся независимо один от другого.
Скорость направленного движения иона, т. е. путь, пройденный ионом в растворе под действием электрического поля в направлении к электроду за единицу времени, зависит от действующей на ион силы, т. е. от напряженности электрического поля:
V = иЕ
где V — скорость движения иона, м/с;
Е - напряженность поля, В/м;
и - коэффициент пропорциональности, называемый электрической подвижностью иона или просто подвижностью иона, м2/(В • с).
ПОДВИЖНОСТЬ ИОНА характеризует его способность преодолевать сопротивление среды при направленном движении в электрическом поле.
Заряд и радиус иона, т. е. его природа: чем больше заряд и чем меньше радиус иона, тем сильнее гидратируется ион, тем ниже подвижность иона в растворе.
Природа растворителя, его диэлектрическая проницаемость и вязкость. Чем полярнее растворитель, тем больше размеры гидратированного иона и меньше его подвижность. Вязкость растворителя обуславливает сопротивление среды движущемуся иону: чем больше вязкость, тем меньше подвижность иона.
Температура раствора. При повышении температуры уменьшаются вязкость растворителя и толщина сольватных оболочек ионов, а также снижается межионное взаимодействие. Все это приводит к увеличению подвижности ионов.
Ионная сила раствора. Чем больше ионная сила раствора, тем сильнее межионное электростатическое взаимодействие и создаваемые им тормозящие эффекты.
Концентрация ионов. Чем больше концентрация ионов в растворе, тем сильнее электростатическое взаимодействие ионов, снижающее их подвижность. Концентрация ионов зависит от силы электролита и его количества в растворе. При разбавлении растворов сильных электролитов подвижность соответствующих ионов растет, поскольку уменьшается их концентрация, а следовательно, снижается межионное взаимодействие в растворе. В растворах слабых электролитов (обычно а < 0,03) подвижность ионов практически не зависит от разбавления, так как концентрация ионов в этих растворах всегда невелика.
Сольватация (гидратация) иона увеличивает его размер и снижает его подвижность.Чем выше диэлектрическая проницаемость (полярность) растворителя, тем сильнее сольватируется ион; при этом увеличиваются его размеры и понижается подвижность.
Предельная подвижность ионов зависит его природы, от природы растворителя и температуры, но не зависит от природы другого иона в данном электролите.
Теория растворов сильных электролитов Дебая – Хюккеля.
В 1923 г Дебай и Хюккель вывели формулу для расчета коэффициента активности разбавленных водных растворов с ионной силой I >0,01:
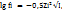
где fi – коэффициент активности i – катиона (аниона);
zi - заряд i – катиона (аниона). Активность ионов зависит от концентрации электролита, природы ионов и температуры.
Приближенные коэффициенты активности некоторых ионов при различной ионной силе раствора сведены в таблицы.
Теория Дебая-Хюккеля оказалась очень полезной для объяснения свойств электролитов. Она представляет собой предельный закон для малых концентраций. Уравнение превосходно согласуется с экспериментом при значениях ионной силы, меньших 0,01. При более высоких значениях ионной силы можно воспользоваться уточненными законами уравнения Дебая-Хюккеля.
Дата: 2019-07-30, просмотров: 646.