Электродом, называют электронопроводящую фазу (металлы или полупроводники), контактирующую с ионным проводником (электролитом).
Электродами второго рода называют сложные многофазные электроды, формально обратимые как относительно катионов, так и относительно анионов.
Состоят из металла, труднорастворимой соли этого металла и второго соединения, хорошо растворимого и содержащего тот же анион, что и труднорастворимая соль.
Хлорсеребрянный электрод имеет обозначение Ag | AgCl | KCl. Он представляет собой серебряную проволоку, покрытую слоем AgCl, опущенную в насыщенный раствор KCl.
ОВ процессом на этом электроде является реакция:
Ag+ +e = Ag0
Ей соответствует электродный потенциал:
EAgCl/Ag = E°Ag+/Ag + RT/nF·ln aAg+ = E°Ag+/Ag + RT/nF·ln ПР(AgCl)/aCl- = E°AgCl/Ag - RT/nF·ln aCl-
Серебряная проволока в электроде контактирует с пастой, представляющей собой перетёртую смесь малорастворимого соединения AgCl c жидким KCl.В пасте хлорид серебра диссоциирует на ионы и образует насыщенный раствор:
AgCl= Ag+ + Cl-
Ионнообменные электроды. Стеклянный электрод. Схема записи электрода. Электродный процесс на стеклянном электроде. Уравнение Нернста для стеклянного электрода. Применение стеклянного электрода в лабораторной практике: преимущества и недостатки.
Особенность данных электродов состоит в том, что они включают такую (обычно твердую) фазу, которая избирательно высвобождает в раствор или сорбирует из него те или иные ионы. Это приводит к созданию разности потенциалов
Наиболее известным и важным является стеклянный электрод, используемый в рН-метрах. Он представляет собой хлорсеребряный электрод, заключенный в стеклянную оболочку из специального токопроводящего стекла, заканчивающуюся тонкостенным шариком. Ag| AgCl| HCl
Принцип действия основан на том,что стеклянный электрод долго находится в воде. При этом в поверхностном слое стекла происходит гидролиз силиката Na:
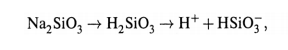
Ионы водорода частично переходят в раствор, что создает разность потенциалов (∆Ψ) между поверхностью и жидкой средой. Ясно, что величина ∆Ψ зависит от концентрации ионов H + в растворе.
Причем, в данном случае у нас — две поверхности: - внутренняя, где скачок потенциала (∆Ψin) постоянен и определяется раствором НСl внутри стеклянного электрода; - внешняя, где скачок потенциала (∆Ψex) зависит от рН исследуемого раствора. Следовательно, зависит от рН и разность потенциалов, измеряемая в элементе между внутренней и внешней средами.
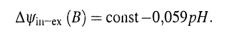
Для измерения pH широко применяется стеклянный электрод. Применение стеклянного электрода основано на том, что стекло содержит катионы, которые могут обмениваться с катионами, находящимися в растворе.
Стеклянный электрод имеет высокое сопротивление, отсюда требование к измерительному рН-метру. Другой недостаток – ограничение диапазонов рН. При высоких рН происходит нарушение соотношения 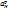 > >
> > 
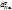 (К – константа обмена, а – равновесные активности катионов натрия и водорода в растворе) и электрод становится обратимым относительно катионов натрия. Также потенциал изменяется во времени, правильные результаты при работе можно получить только при регулярной градуировке электрода. Главный «+» - индифферентность (безразличие) электрода к окислителям и восстановителям.
(К – константа обмена, а – равновесные активности катионов натрия и водорода в растворе) и электрод становится обратимым относительно катионов натрия. Также потенциал изменяется во времени, правильные результаты при работе можно получить только при регулярной градуировке электрода. Главный «+» - индифферентность (безразличие) электрода к окислителям и восстановителям.
Окислительно-восстановительные электроды. Хингидронный электрод. Устройство и схема записи электрода. Реакция, протекающая на хингидронном электроде. Уравнение Нернста для этого электрода. Применение хингидронного электрода в лабораторной практике.
а) В принципе, каждый электрод является окислительно-восстановительным. Но под термином «редокс-электроды» понимают такие полуэлементы, где все компоненты полуреакции (Ох и Red) находятся в растворе; металлические же электроды, погруженные в раствор, в реакции не участвуют, а служат лишь переносчиками электронов.
б) Компонентами ОВ-пары при этом могут быть неорганические вещества
Однако для органических веществ редокс-электроды особенно важны, т.к. являются единственным способом образовать полуэлемент
Наиболее известный пример — хингидронный электрод: (Pt) | 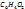 ,
, 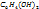 ,
, 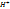
Здесь платиновая пластинка погружена в насыщенный раствор хингидрона в присутствии твердого хингидрона. Растворенный хингидрон диссоциирует на эквивалентные количества хинона (Ох) и гидрохинона (Rd), связанные реакцией восстановления
В данной полуреакции фигурируют протоны; поэтому потенциал электрода зависит от рН
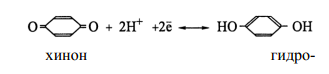
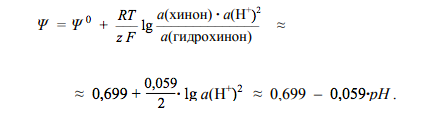
Зависимость потенциала от рН позволяет использовать хингидронный электрод для измерения рН. Правда, в этих целях он применим в области значений рН, не больших 8. Дело в том, что в щелочной среде гидрохинон ведет себя как слабая кислота, т.е. теряет протоны, отчего они перестают фигурировать в уравнении полуреакции.
ХЭ применяют в ряде случаев при потенциометрических измерениях для определения рН раствора.
Дата: 2019-07-30, просмотров: 402.