Спирты применяют в производстве синтетических полимеров, каучуков, пластификаторов, моющих средств, в качестве растворителей и экстрагентов и для других целей. Они являются массовой продукцией нефтехимического синтеза, поэтому большое значение для экономики производства спиртов имеют методы их получения и исходное сырьё. Одним из важнейших методов производства спиртов является гидратация олефинов. Этим методом получают этиловый, изопропиловый, втор- и трет-бутиловые спирты. Метиловый спирт получают на основе окиси углерода и водорода.
Наиболее крупнотоннажным продуктом является этиловый спирт. На основе этилового спирта в конце тридцатых годов С.В. Лебедевым был разработан метод получения бутадиена-1,3 и синтетического каучука на его основе. Этиловый спирт получают из пищевого сырья (ферментативный метод), из продуктов гидролиза древесины, из сульфитных щелоков и этилена.
Трудовые и сырьевые затраты при производстве этилового спирта из пищевых продуктов и древесных опилок очень велики, поэтому значительно выгоднее исходить из дешёвого углеводородного сырья и получать спирт гидратацией этилена. Для производства одной тонны этилового спирта на основе этилена необходимо переработать всего примерно 2,5 тонны газа или нефтяных дистиллятов, а для получения 1 тонны спирта из растительных материалов требуется 4 тонны зерна, 10 – 12 тонн картофеля или 8 тонн древесных опилок. Трудовые затраты в человеко-часах при производстве этанола из разных источников составляют: из картофеля 280, из зерна 160, из этилена 10.
Для получения синтетического этанола сырьём служит этилен, который подвергают сернокислотной гидратации или гидратации на твёрдых фосфорно-кислотных катализаторах (прямая гидратация):
С2Н4 + Н2SO4 → C2H5OSO3H + H2O → C2H5OH + Н2SO4;
С2Н4 + H2O (H3PO4) → C2H5OH.
Себестоимость синтетического этилового спирта значительно ниже, чем при других методах его получения. Относительная себестоимость (в %) этанола, получаемого разными способами, составляет: из этилена 100%, гидролизом древесины 174 – 290, из пищевого сырья 300 – 400. [2]
ПРОИЗВОДСТВО СПИРТОВ СЕРНОКИСЛОТНОЙ ГИДРАТАЦИЕЙ ОЛЕФИНОВ
Теоретические сведения
Реакция присоединения воды была открыта Фарадеем 1825 – 1828 гг. он нашёл, что при действии серной кислоты на этилен, содержащийся в светильном газе, наряду с диэтиловым эфиром и другими продуктами образуется этиловый спирт. Впоследствии было установлено, что первым продуктом присоединения серной кислоты к этилену является этилсерная кислота, которая при гидролизе превращается в этанол. В 1873 году А.М.Бутлеров и В.Горяинов детально изучили сернокислотную гидратацию этилена и предсказали техническое значение этого процесса. В начале тридцатых годов в Советском Союзе М.А.Далиным с сотр. были проведены исследования сернокислотной гидратации олефинов и в 1936 году в Баку была создана первая промышленная установка по получению этилового спирта из нефтяных газов.
Сернокислотная гидратация олефинов является обратимым процессом. Она протекает в две стадии:
CH2=CH2 + Н2SO4 ↔ CH2OSO2OHCH3 + H2O ↔ CH2OHCH3+ Н2SO4
Первая стадия – взаимодействие олефинов с серной кислотой – протекает через образование карбоний-иона, то есть как электрофильное замещение по правилу Марковникова. Поэтому сернокислотная гидратация олефинов выше С2 позволяет получать только вторичные и третичные спирты.
Серная кислота в этом процессе играет роль и катализатора и реагента. Сначала происходит отщепление протона от молекулы кислоты:
Н2SO4 ↔ Н+ + -OSO2OH
Под действием его из молекулы олефина образуется карбоний ион
CH2=CH2 + Н+ → CH2+CH3
который далее реагирует с серной кислотой с отщеплением от неё протона и образованием алкилсульфатов:
CH2+CH3 +Н2SO4 ↔ CH2OSO2OHCH3 + Н+
Если в системе присутствует вода, могут также образовываться ионы алкоксония, которые разлагаются с образов()анием спирта:
CH2+CH3 + H2O ↔ CH2(H2O) +CH3 → C2H5OH + Н+
Наряду с этим протекает ряд побочных реакций:
а)образование диалкил сульфатов:
CH2OSO2OHCH3 + CH2=CH2 → (CH3CH2)2SO4 + Н2SO4
б) образование простых эфиров из двух молекул спирта с отщеплением воды:
2C2H5OH +Н2SO4  (С2Н5)2О + H2O
(С2Н5)2О + H2O
Причём предполагается, что фактически сначала спирт реагирует с карбоний-ионом, а потом от продукта присоединения отщепляется протон:
C2H5OH + CH2 +CH3  (С2Н5)2О + H2
(С2Н5)2О + H2
в) образование карбонильных соединений (альдегидов) при дегидрировании спирта:
C2H5OH  C2H4O + H2
C2H4O + H2
г) полимеризация олефинов:
nCH2=CH2  (CH2–CH2)n
(CH2–CH2)n
Из-за этих побочных реакций при гидратации олефинов наряду со спиртами получаются небольшие количества эфиров, альдегидов и полимеров. Кроме того, образование нерасщепляющихся сульфопроизводных приводит к повышенному расходу серной кислоты.
Наиболее низкой реакционной способностью при взаимодействии с серной кислотой обладает этилен. Относительная скорость поглощения разных олефинов 80% серной кислотой меняется следующим образом: этилен (1), пропилен (500), бутилен-1(1 000), изобутилен (16 000).
Видно, что с увеличением молекулярного веса олефинов их реакционная способность возрастает. Олефины изостроения также обладают очень высокой реакционной способностью. Поскольку олефины в зависимости от молекулярного веса и строения реагируют с серной кислотой с разной скоростью, для каждого из них подбирают свои условия: концентрация кислоты, температуру, давление.

Абсорбцию олефинов серной кислотой осуществляют в реакторах колонного типа с колпачковыми тарелками, на которых расположены змеевики водяного охлаждения, поскольку реакция идёт с выделением тепла. Тепло выделяется не только за счёт собственной реакции, но также за счёт разбавления кислоты водой.
Вторая стадия – гидролиз алкилсульфатов водой, осуществляемый при нагревании острым паром; одновременно происходит отгонка спирта и разбавление серной кислоты до концентрации почти вдвое меньшей, чем исходная. Существенной особенностью процесса является расщепление при гидролизе на спирте кислоту, не только моноалкил-, но и диалкилсульфатов:
CH2OSO2OHCH3 + H2O ↔ C2H5OH + Н2SO4
(CH3CH2)2SO4 + 2H2O ↔ 2C2H5OH + Н2SO4
При избытке олефина количество диалкилсульфата возрастает, а расход кислоты снижается, что очень важно для экономики процесса. Обычно один моль серной кислоты поглощает до 1,2 – 1,3 моль олефина. Другой особенностью является возможность поглощения олефинов из соответствующих фракций (этан – этиленовые, пропан – пропиленовые и др.) без их концентрирования.
Селективность превращения олефина в спирт при сернокислотной гидратации составляет 85 – 95%, а общая степень конверсии олефина превышает 97%.
Олигомеризация этилена
При гидратации олефинов наряду с основной реакцией протекают олигомеризация олефина (получение низкомолекулярных полимеров) и образование простого эфира. Все они идут через промежуточную стадию карбокатиона, что можно изобразить схемой:
Н2О + R+; -H+(k1) ↔ ROH + R+; -H+(k2) ↔ ROR, R+ + олефин  олигомеры.
олигомеры.
Для состояния системы, далёкого от равновесия, из этой схемы вытекает следующее уравнение дифференциальной избирательности:
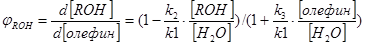
Из него ясно видно что избирательность растёт при наличии избытка воды по отношении к олефину и образующемуся спирту. Спирт более реакционноспособен, чем вода [ (k2/k1)>1], поэтому реакцию надо вести так чтобы сохранялся большой избыток воды по отношению к спирту (~ 15:1). Выход олигомеров зависит от способности олефинов к полимеризации (изобутен > пропилен > этилен). Образование олигомеров можно снизить, не только изменяя соотношение воды и олефина, но и уменьшая температуру, так как олигомеризация имеет более высокую энергию активации по сравнению с гидратацией. Следует отметить, что при приближении к равновесию скорость гидратации и избирательность падают, что делает невыгодным проведение реакции до степеней конверсии, близким к равновесным. При этом для каждого олефина и катализатора имеется некоторый оптимум соотношения реагентов, степени конверсии и температуры, зависящий от производительности и избирательности процесса.
Для дегидратации спиртов установлена схема превращения, по которой эфир способен к разложению на олефин и спирт:
этанол + H+; – Н2О ↔ R+ + H+ → олефин;
этанол + H+; – Н2О ↔ R+ + этанол ↔ ROR + H+ → ROH + олефин + H+. 
Внутримолекулярная дегидратация имеет более высокую энергию активации по сравнению с образованием простого эфира. По этой причине, а также из рассмотрения приведённой выше схемы следует, что дегидратацию с образованием ненасыщенной связи надо осуществлять при повышенной температуре и низком парциальном давлении или концентрации спирта. Дегидратацию с образованием простого эфира проводят при более низкой температуре, более высоких концентрации и парциальном давлении спирта (например, под некоторым давлением) и при неполной конверсии спирта в реакторе.
В результате рассматриваемых реакций нередко образуется ещё один побочный продукт – альдегид или кетон, получающийся за счёт дегидрирования спирта: С2Н5ОН → СН3СНО. Протонные кислоты не катализируют эту реакцию, но она становится возможной при использовании некоторых носителей или оксидных катализаторов. Из последних наиболее избирательны к дегидратации (по сравнению с дегидрированием) ThO2 и Al2O3, в то время как многие оксиды обладают смешанным, а другие – преимущественно дегидрирующим действием.
Термодинамика реакций
Рассмотрим равновесие основной реакции: гидратации – внутримолекулярной гидратации. Она протекает с выделением тепла, следовательно её равновесие смещается вправо при понижении температуры. Дегидратации, наоборот, способствует нагревание. Изменение энергии Гиббса при гидратации этилена, пропилена и изобутилена в зависимости от температуры представлено графически на (рис. 1.) Видно, что равновесие невыгодно для гидратации олефинов, так как при 150-300*С, когда катализаторы процесса достаточно активны, энергия Гиббса имеет большую положительную величину и равновесие смещается в сторону дегидратации. При этом для олефинов разного строения различия в термодинамике рассматриваемых реакций незначительны.
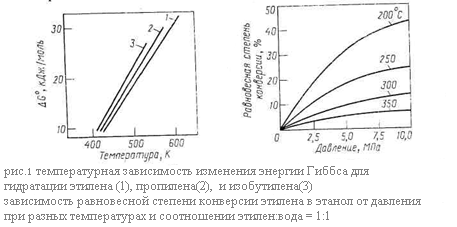
Как показывает стехиометрия реакций, на их равновесие можно влиять, изменяя давление. Внутримолекулярной дегидратации, идущей с увеличением числа молей веществ, способствует пониженное или обычное давление. Наоборот, гидратации олефинов благоприятствует высокое давление, увеличивающее равновесную степень конверсии олефина. Так последняя при 250 – 300 *С и атмосферном давлении составляет всего 0,1 – 0,2%, что совершенно неприемлемо для практических целей, но при 7 – 8 МПа и тех же температурах она возрастает до 12 – 20%. Зависимость равновесной степени конверсии этилена при его гидратации от давления и температуры изображена на рис.60, причём аналогичные кривые характерны и для других олефинов. Очевидно, что гидратации способствуют одновременное снижение температуры и повышение давления. Рассмотрим теперь равновесие в системе межмолекулярная дегидратация спиртов – гидролиз простых эфиров. Термодинамическим методом регулирования направления этих реакций является изменение давления: на образование простого эфира оно не влияет, но получению олефина его снижение благоприятствует.
Механизм и кинетика реакций
Все рассматриваемые реакции принадлежат к числу кислотно-каталитических процессов. Типичными катализаторами гидратации являются достаточно сильные протонные кислоты: фосфорная кислота на носителе, поливольфрамовая кислота, сульфокатиониты. Для дегидратации используют фосфорную кислоту на носителе, оксид алюминия, серную кислоту, фосфаты (например СаНРО4) и другие. Роль катализаторов при гидратации состоит в протонировании олефина через промежуточное образование π- и σ-комплексов, причём обратная реакция дегидратации идёт через те же стадии, но в противоположном направлении:
СН2=СН2 + Н+ = СН3=СН2+ + Н2О = СН3=СН2ОН + Н+
При межмолекулярной дегидратации карбокатион не отщепляет протон, а взаимодействует с другой молекулой спирта:
СН3=СН2+ + СН3=СН2ОН = [СН3=СН+2] 2 О+Н = [СН3=СН+2] 2 О + +Н
Электрофильный механизм дегидратации олефинов определяет уже отмеченные выше направления присоединения по правилу Марковникова, а также изменение реакционной способности олефинов, чем больше замещённость тем выше реакционная способность. В соответствии с этим этен самый нереакционноспособный. Для разных условий и катализаторов отношение реакционной способности олефинов меняется, составляя, например, для 80% серной кислоты 16 000: 1 000: 500: 1 и увеличиваясь для менее сильных кислот. Это очень существенно для выбора условий гидратации, особенно температуры: последняя может быть более низкой (и более благоприятной для равновесия) для изобутена по сравнению с пропиленом и особенно с этиленом.
Равновесие гидратации – дегидратации мало зависит от строения олефина и спирта, поэтому ряд реакционной способности олефинов к гидратации должен соответствовать аналогичному ряду спиртов по их способности к дегидратации:
Третичный > вторичный > первичный.
Эта способность особенно растёт у β-кето- и β-нитроспиртов, электроноакцепторные группы которых повышают кислотность атомов водорода, находящихся при соседнем с НО-группой углеродном атоме. Это нередко делает возможным некаталитическую, дегидратацию или даже катализ реакции основаниями:
–СОСН2–СНОН– + НО-; - Н2О = –СОСН-–СНОН– = –СОСН=СН– НО-
При гетерогенно-каталитической внутримолекулярной и межмолекулярной дегидратации в газовой фазе кинетика процесса описывается соответственно следующими уравнениями:
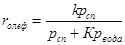 ,
,  .
.
Они учитывают практическую необратимость внутримолекулярной дегидратации и тормозящие влияние спирта и воды, лучше адсорбирующихся на активных центрах катализатора.
При гидратации олефинов вода всегда находится в избытке, поэтому тормозящим влиянием спирта можно пренебречь:
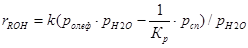
В ряде случаев роль воды более сложная. Так, фосфорная кислота, нанесённая на пористый носитель, образует на его поверхности жидкую плёнку, которая адсорбирует воду из газовой фазы. При каждых данных температуре и парциальном давлении водяных паров в газовой фазе устанавливается фазовое равновесие, и фосфорная кислота в плёнке имеет определённую концентрацию и соответствующую ей каталитическую активность. Последняя падает при снижении температуры и росте парциального давления воды, что ограничивает выбор этих параметров для каждого случая определёнными рамками.
При катализе реакций гидратации – дегидратации при помощи сульфокатионитов было найдено такое кинетическое уравнение:
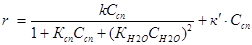
Первый его член соответствует катализу сульфогруппами катионита, а второй – специфическому катализу ионами гидроксония Н3О+. если количество воды в смеси мало, в уравнении преобладает первое слагаемое, сильно зависящее от концентрации воды; повышение этой величины ведёт к преобладанию второго слагаемого.
Дата: 2019-07-24, просмотров: 403.