УФИМСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ ЭКОНОМИКИ И СЕРВИСА
Уфимский государственный институт сервиса
Кафедра охраны окружающей среды
и рационального использования природных ресурсов
КУРСОВАЯ РАБОТА
По дисциплине «Промышленная экология»
На тему: Производство этанола методом гидратации этилена
Выполнил студент группы ОД-41 Давыдов Д.В. Проверил профессор Исмагилов Ф.Р.
Уфа 2006
СОДЕРЖАНИЕ
ВВЕДЕНИЕ...................................................................................................3
1. ЭКОЛОГИЗАЦИЯ ХИМИЧЕСКОЙ И НЕФТЕПЕРЕРАБАТЫВАЮЩЕЙ ПРОМЫШЛЕННОСТИ............4
1.1. Теоретические аспекты экологизации и экологизация производства..................................................................................................4
1.2 Очистка отходящих газов.......................................................................5
1.3. Очистка стоков нефтеперерабатывающей промышленности............6
1.4. Выбросы углеводородов........................................................................7
2. ПОДГОТОВКА СЫРЬЯ ДЛЯ ПРОЦЕССА ГИДРАТАЦИИ........8
2.1. Компримирование и осушка газа пиролиза........................................8
2.2. Фракционирование газа пиролиза......................................................10
2.3. Разделение пиролиза при высоком давлении....................................11
2.4. Очистка этилена...................................................................................15
2.5. Получение этилена диспропорционированием пропилена..............18
3. ОСНОВНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ СПИРТОВ......................20
4. ПРОИЗВОДСТВО СПИРТОВ СЕРНОКИСЛОТНОЙ ГИДРАТАЦИЕЙ ОЛЕФИНОВ..............................................................21
4.1. Теоретические сведения......................................................................21
4.2. Технология получения спиртов методом сернокислотной гидратации...................................................................................................28
5. ПРОИЗВОДСТВО СПИРТОВ ПРЯМОЙ ГИДРАТАЦИЕЙ ОЛЕФИНОВ...............................................................................................30
5.1. Теоретические сведения......................................................................30
5.2. Технологические особенности процесса...........................................35
5.3. Технологическая схема процесса.......................................................36
5.4. Характеристика основной аппаратуры..............................................40
5.5. Расчёт материального баланса гидратора..........................................41
6. ПРЯМАЯ ГИДРАТАЦИЯ ЭТИЛЕНА НА НЕЙТРАЛЬНЫХ КАТАЛИЗАТОРАХ..................................................................................46
ЗАКЛЮЧЕНИЕ.........................................................................................47
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ.............................48
ВВЕДЕНИЕ
В данной курсовой работе исследован процесс получения этанола из этилена путём гидратации последнего. А также рассмотрено получение сырья (этилен) путём фракционирования из газа пиролиза. И последующая его очистка от сероводорода, двуокиси и окиси углерода, ацетилена и кислорода.
Этанол принадлежит к числу многотоннажных и широко применяемых продуктов органического синтеза. Он является хорошим, хотя и огнеопасным растворителем; в больших количествах используется в пищевой и медицинской промышленности. Служит горючим в жидкостных ракетных двигателях, антифризом и т. д. Как промежуточный продукт органического синтеза этанол имеет важное значение для получения сложных эфиров: хлороформа, хлораля, диэтилового эфира, ацетальдегида и уксусной кислоты.
В России процесс производства синтетического этанола посредством гидратации этилена осуществляется двумя способами: сернокислотной и прямой гидратацией. Первый способ внедрен в промышленном масштабе с 1952г, второй получил широкое распространение в последние десятилетия.
На сегодняшний день любой технологический процесс должен рассматриваться не только с точки зрения экономических показателей, но и должно обязательно учитываться влияние этого процесса на окружающую среду.
Процесс получения этанола на всех этапах – от подготовки сырья до получения уже готового продукта – сопровождается использованием или образованием опасных для окружающей среды веществ. Таких как серная кислота, фосфорная кислота и др. Совершенно естественно, что выбор метода производства этанола должен учитывать вредное влияние продуктов производства на окружающую среду.
Но в то же самое время любой технологический процесс должен быть и экономически целесообразным.
Исследование вредного воздействия на окружающую среду с учётом экономической эффективности я и считаю целью данной курсовой работы.
ЭКОЛОГИЗАЦИЯ ХИМИЧЕСКОЙ И НЕФТЕПЕРЕРАБАТЫВАЮЩЕЙ ПРОМЫШЛЕННОСТИ
Очистка отходящих газов
При производстве этанола выделяются вредные вещества, которые могут загрязнять атмосферу. Такие как диэтилсульфат, этилсульфат, диэтиловый эфир, фосфорные эфиры и другие летучие вещества.
Поэтому требуется очистка отходящих газов. Для защиты воздушного бассейна от негативного антропогенного воздействия в виде загрязнения его вредными веществами используют следующие меры:
- экологизацию технологических процессов;
- очистку газовых выбросов от вредных примесей;
- рассеивание газовых выбросов в атмосфере;
- устройство санитарно-защитных зон, архитектурно-планировочные решения и др.
Наиболее радикальная мера охраны воздушного бассейна от загрязнения - экологизация технологических процессов и прежде всего создание замкнутых технологических циклов, безотходных и малоотходных технологий, исключающих попадание в атмосферу вредных загрязняющих веществ.
Экологизация технологических процессов предусматривает создание непрерывных технологических процессов производства, замену местных котельных установок на централизованное тепло, предварительное очищение топлива и сырья от вредных примесей, замену угля и мазута на природный газ, применение гидрообеспылевания, перевод на электропривод компрессоров и др. всё шире применяют частичную рециркуляцию , то есть повторное использование отходящих газов.
К сожалению, нынешний уровень развития экологизации технологических процессов, внедрение замкнутых технологий и т. д. недостаточен для полного предотвращения выбросов токсичных веществ в атмосферу. Поэтому на предприятиях повсеместно используются различные методы очистки отходящих газов.
Способы очистки выбросов от токсичных газо- и парообразных примесей подразделяют на три группы: 1) поглощение примесей путём применения каталитическ4ого превращения; 2)промывка выбросов растворителями примеси (абсорбционный метод) и 3)поглащение газообразных примесей твёрдыми телами (адсорбционный метод).
С помощью каталитического метода токсичные компоненты промышленных выбросов превращают в вещества безвредные или менее вредные путём введения катализаторов. Широко применют палладийсодержащие и ванадийсодержащие катализаторы. Одна из разновидностей этого метода это дожигание вредных примесей с помощью газовых горелок, широко используется на нефтеперерабатывающих заводах.
Абсорбционный метод основан на поглощении вредных веществ абсорбентом (вода, растворы щелочей или соды, аммиака и др.) устройства – абсорберы.
Адсорбционный метод позволяет извлекать вредные компоненты из промышленных выбросов с помощью адсорбентов – твёрдые тела с ультрамикропористой структурой (активированный уголь и глинозём, силикагель, цеолиты, сланцевая зола и др. ).
Выбросы углеводородов
Источником загрязнений атмосферы углеводородами является реактор установки каталитического крекинга. Так как смесь газообразных углеводородов является продуктом процесса, то потеря его в атмосферу является ни сколько экологической проблемой для завода НПЗ, сколько экономической.
Свойственный деструктивным процессам режим высоких температур и в ряде случаев высокого давления способствует потерям углеводородов и сопутствующего им сероводорода в атмосферу. При этом потери будут в несколько раз больше, чем при низкотемпературных процессах.
Степень загрязнения атмосферы углеводородами зависит также от системы охлаждения нефтепродуктов, получаемых на установках каталитического крекинга, и от стабилизации бензиновых фракций. Естественно, что потери от испарения будут тем меньше, чем ниже температура охлаждения продукта, особенно лёгкого бензина. Аналогично будет влиять полнота стабилизации бензина, поскольку газ, растворённый в бензине, повышает парциальное давление углеводородных паров. Поэтому для предотвращения потери продукта, газы идущие из реактора охлаждают и сконденсировавшиеся жидкие продукты направляют на колонну стабилизации.
Углеводороды, которые идут из регенератора установки не требуют дополнительной отчистки, так как их имеется незначительное количество, и они окисляются до CO2 и H2O в дожигателе CO. [1]
ПОДГОТОВКА СЫРЬЯ ДЛЯ ПРОЦЕССА ГИДРАТАЦИИ
Очистка этилена
Очистка этилена сводится к удалению из него сероводорода, двуокиси и окиси углерода, ацетилена и кислорода. Удаление этих примесей может осуществляться на различных стадиях процесса производства этилена.
Сероводород, двуокись углерода и органические сернистые загрязнения удаляют путём промывки газо-водной щёлочью (обычно 10% раствором едкого натра) в специальном скруббере. При этом протекают реакции:
H2S + 2NaOH → Na2S + 2H2O
CO2 + 2NaOH → Na2CO3 + H2O
COS + 4NaOH → Na2CO3 + Na2S+ 2H2O
CS2 + 6NaOH → Na2CO3+ 2Na2S+ 3H2O
Значительное снижение содержания сернистых соединений (до 0,0001%) и двуокиси углерода (до 0,001%) достигается при двухступенчатой промывке щёлочью.
Очистка от ацетилена может осуществляться промывкой ацетоном при низких температурах либо, чаще всего, селективным гидрированием. Содержание ацетилена в газе пиролиза колеблется от 0,1 до 1%. При очистке оно должно быть снижено до 0,001 – 0,002 %.
Удаление ацетилена абсорбции ацетоном основано на предпочтительном растворении ацетилена в ацетоне и проводится при низких температурах.
Охлажденный этилен промывают ацетоном в абсорбционной колонне 2; насыщенный ацетон регенерируется в колонне 8 путём отгона ацетилена и после охлаждения в системе теплообменников и холодильников вновь поступает в абсорбционную колонну 2.
Очистка от ацетилена селективным гидрированием основана на реакции:
С2Н2 + Н2 → С2Н4
Условия процесса выбираются таким образом, чтобы практически избежать побочной реакции гидрирования этилена. При гидрировании этилен также освобождается от кислорода и от окиси углерода:
О2 + 2Н2 → 2Н2О
СО + 3Н2 → СН4 + Н2О
В качестве катализаторов гидрирования могут применяться никель на кизельгуре, палладий на активированном угле или платина на окиси алюминия. В качестве водосодержащего газа для гидрирования применяется метано-водородная фракция. Гидрирование может проводиться при давлениях 20 - 30 кгс/см2 или более низких и при температуре газа на входе в реактор от 100 до 180 – 200 °C. Избирательное гидрирование ацетилена может проводиться в реакторах трубчатых или колонного типа. В первом случае тепло реакции отводится циркулирующим в межтрубном пространстве сырьём или водой, во втором поддувом холодного гидрированного продукта:
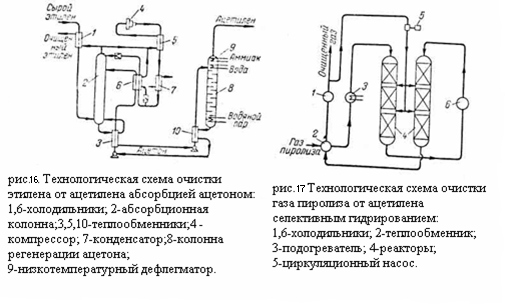
На рисунке приведена технологическая схема очистка газа пиролиза от ацетилена селективным гидрированием. Газ пиролиза после компримирования и осушки проходит теплообменник 2 и паровой подогреватель 3 с температурой 150 - 200°C проходит последовательно реакторы 4 колонного типа. Очищенный газ пиролиза через теплообменник 2 и холодильник 1 направляется на дальнейшее разделение. Часть очищенного газа циркуляционным компрессором 5 подаётся в реакторы 4 для снятия теплоты реакции.
Если очистке гидрированием подвергается этиленовая фракция, после гидрирования необходимо концентрирование этилена. Принципиальная технологическая схема доочистки и концентрирования этилена приведена на (рис.18):

Этиленовая фракция (97 – 98 % этилена) смешивается с метано-водородной фракцией и поступает в скруббер 1 для промывки раствором щёлочи с целью удаления углекислого газа, сероводорода и органических сернистых соединений. Отработанная щёлочь выводится снизу, а газ сверху. Газ после щелочной промывки делится на два потока. Один поток проходит межтрубное пространство реактора гидрирования 4 и смешивается со вторым холодным потоком перед паровым подогревателем 3. в паровом подогревателе 3 газ нагревается до 100 – 190 °C и направляется в реактор 4 на гидрирование. Реактор представляет собой трубчатый аппарат, в трубки которого загружен катализатор, например, палладий на активированном угле. Тепло реакции отводится холодной этиленовой фракцией циркулирующей через межтрубное пространство. Давление в реакторе около 23 кгс/см2. После гидрирования газ охлаждается в холодильнике 5 и направляется в осушитель 6 для удаления влаги. Осушенный газ после дополнительного охлаждения в холодильнике 7 направляется в колонну 8 и 9. Сверху из колонны 8 при температуре -38°C отбирается метано-водородная фракция с содержанием этилена до 70%, который возвращается на компримирование. Остаток колонны 8 освобождается от этана в колонне 9. Сверху из колонны 9 при температуре -28°C отбирается 99,9%-ный этилен. Остаток колонны 9 содержит до 60% этана. Температура низа колонны 9 около -20 °C.
Теоретические сведения
Реакция присоединения воды была открыта Фарадеем 1825 – 1828 гг. он нашёл, что при действии серной кислоты на этилен, содержащийся в светильном газе, наряду с диэтиловым эфиром и другими продуктами образуется этиловый спирт. Впоследствии было установлено, что первым продуктом присоединения серной кислоты к этилену является этилсерная кислота, которая при гидролизе превращается в этанол. В 1873 году А.М.Бутлеров и В.Горяинов детально изучили сернокислотную гидратацию этилена и предсказали техническое значение этого процесса. В начале тридцатых годов в Советском Союзе М.А.Далиным с сотр. были проведены исследования сернокислотной гидратации олефинов и в 1936 году в Баку была создана первая промышленная установка по получению этилового спирта из нефтяных газов.
Сернокислотная гидратация олефинов является обратимым процессом. Она протекает в две стадии:
CH2=CH2 + Н2SO4 ↔ CH2OSO2OHCH3 + H2O ↔ CH2OHCH3+ Н2SO4
Первая стадия – взаимодействие олефинов с серной кислотой – протекает через образование карбоний-иона, то есть как электрофильное замещение по правилу Марковникова. Поэтому сернокислотная гидратация олефинов выше С2 позволяет получать только вторичные и третичные спирты.
Серная кислота в этом процессе играет роль и катализатора и реагента. Сначала происходит отщепление протона от молекулы кислоты:
Н2SO4 ↔ Н+ + -OSO2OH
Под действием его из молекулы олефина образуется карбоний ион
CH2=CH2 + Н+ → CH2+CH3
который далее реагирует с серной кислотой с отщеплением от неё протона и образованием алкилсульфатов:
CH2+CH3 +Н2SO4 ↔ CH2OSO2OHCH3 + Н+
Если в системе присутствует вода, могут также образовываться ионы алкоксония, которые разлагаются с образов()анием спирта:
CH2+CH3 + H2O ↔ CH2(H2O) +CH3 → C2H5OH + Н+
Наряду с этим протекает ряд побочных реакций:
а)образование диалкил сульфатов:
CH2OSO2OHCH3 + CH2=CH2 → (CH3CH2)2SO4 + Н2SO4
б) образование простых эфиров из двух молекул спирта с отщеплением воды:
2C2H5OH +Н2SO4  (С2Н5)2О + H2O
(С2Н5)2О + H2O
Причём предполагается, что фактически сначала спирт реагирует с карбоний-ионом, а потом от продукта присоединения отщепляется протон:
C2H5OH + CH2 +CH3  (С2Н5)2О + H2
(С2Н5)2О + H2
в) образование карбонильных соединений (альдегидов) при дегидрировании спирта:
C2H5OH  C2H4O + H2
C2H4O + H2
г) полимеризация олефинов:
nCH2=CH2  (CH2–CH2)n
(CH2–CH2)n
Из-за этих побочных реакций при гидратации олефинов наряду со спиртами получаются небольшие количества эфиров, альдегидов и полимеров. Кроме того, образование нерасщепляющихся сульфопроизводных приводит к повышенному расходу серной кислоты.
Наиболее низкой реакционной способностью при взаимодействии с серной кислотой обладает этилен. Относительная скорость поглощения разных олефинов 80% серной кислотой меняется следующим образом: этилен (1), пропилен (500), бутилен-1(1 000), изобутилен (16 000).
Видно, что с увеличением молекулярного веса олефинов их реакционная способность возрастает. Олефины изостроения также обладают очень высокой реакционной способностью. Поскольку олефины в зависимости от молекулярного веса и строения реагируют с серной кислотой с разной скоростью, для каждого из них подбирают свои условия: концентрация кислоты, температуру, давление.

Абсорбцию олефинов серной кислотой осуществляют в реакторах колонного типа с колпачковыми тарелками, на которых расположены змеевики водяного охлаждения, поскольку реакция идёт с выделением тепла. Тепло выделяется не только за счёт собственной реакции, но также за счёт разбавления кислоты водой.
Вторая стадия – гидролиз алкилсульфатов водой, осуществляемый при нагревании острым паром; одновременно происходит отгонка спирта и разбавление серной кислоты до концентрации почти вдвое меньшей, чем исходная. Существенной особенностью процесса является расщепление при гидролизе на спирте кислоту, не только моноалкил-, но и диалкилсульфатов:
CH2OSO2OHCH3 + H2O ↔ C2H5OH + Н2SO4
(CH3CH2)2SO4 + 2H2O ↔ 2C2H5OH + Н2SO4
При избытке олефина количество диалкилсульфата возрастает, а расход кислоты снижается, что очень важно для экономики процесса. Обычно один моль серной кислоты поглощает до 1,2 – 1,3 моль олефина. Другой особенностью является возможность поглощения олефинов из соответствующих фракций (этан – этиленовые, пропан – пропиленовые и др.) без их концентрирования.
Селективность превращения олефина в спирт при сернокислотной гидратации составляет 85 – 95%, а общая степень конверсии олефина превышает 97%.
Олигомеризация этилена
При гидратации олефинов наряду с основной реакцией протекают олигомеризация олефина (получение низкомолекулярных полимеров) и образование простого эфира. Все они идут через промежуточную стадию карбокатиона, что можно изобразить схемой:
Н2О + R+; -H+(k1) ↔ ROH + R+; -H+(k2) ↔ ROR, R+ + олефин  олигомеры.
олигомеры.
Для состояния системы, далёкого от равновесия, из этой схемы вытекает следующее уравнение дифференциальной избирательности:
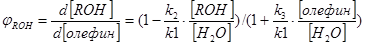
Из него ясно видно что избирательность растёт при наличии избытка воды по отношении к олефину и образующемуся спирту. Спирт более реакционноспособен, чем вода [ (k2/k1)>1], поэтому реакцию надо вести так чтобы сохранялся большой избыток воды по отношению к спирту (~ 15:1). Выход олигомеров зависит от способности олефинов к полимеризации (изобутен > пропилен > этилен). Образование олигомеров можно снизить, не только изменяя соотношение воды и олефина, но и уменьшая температуру, так как олигомеризация имеет более высокую энергию активации по сравнению с гидратацией. Следует отметить, что при приближении к равновесию скорость гидратации и избирательность падают, что делает невыгодным проведение реакции до степеней конверсии, близким к равновесным. При этом для каждого олефина и катализатора имеется некоторый оптимум соотношения реагентов, степени конверсии и температуры, зависящий от производительности и избирательности процесса.
Для дегидратации спиртов установлена схема превращения, по которой эфир способен к разложению на олефин и спирт:
этанол + H+; – Н2О ↔ R+ + H+ → олефин;
этанол + H+; – Н2О ↔ R+ + этанол ↔ ROR + H+ → ROH + олефин + H+. 
Внутримолекулярная дегидратация имеет более высокую энергию активации по сравнению с образованием простого эфира. По этой причине, а также из рассмотрения приведённой выше схемы следует, что дегидратацию с образованием ненасыщенной связи надо осуществлять при повышенной температуре и низком парциальном давлении или концентрации спирта. Дегидратацию с образованием простого эфира проводят при более низкой температуре, более высоких концентрации и парциальном давлении спирта (например, под некоторым давлением) и при неполной конверсии спирта в реакторе.
В результате рассматриваемых реакций нередко образуется ещё один побочный продукт – альдегид или кетон, получающийся за счёт дегидрирования спирта: С2Н5ОН → СН3СНО. Протонные кислоты не катализируют эту реакцию, но она становится возможной при использовании некоторых носителей или оксидных катализаторов. Из последних наиболее избирательны к дегидратации (по сравнению с дегидрированием) ThO2 и Al2O3, в то время как многие оксиды обладают смешанным, а другие – преимущественно дегидрирующим действием.
Термодинамика реакций
Рассмотрим равновесие основной реакции: гидратации – внутримолекулярной гидратации. Она протекает с выделением тепла, следовательно её равновесие смещается вправо при понижении температуры. Дегидратации, наоборот, способствует нагревание. Изменение энергии Гиббса при гидратации этилена, пропилена и изобутилена в зависимости от температуры представлено графически на (рис. 1.) Видно, что равновесие невыгодно для гидратации олефинов, так как при 150-300*С, когда катализаторы процесса достаточно активны, энергия Гиббса имеет большую положительную величину и равновесие смещается в сторону дегидратации. При этом для олефинов разного строения различия в термодинамике рассматриваемых реакций незначительны.
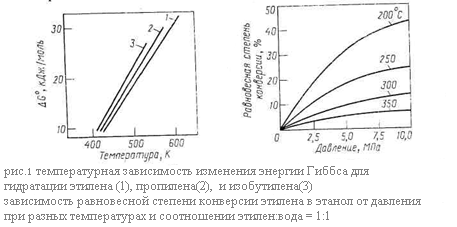
Как показывает стехиометрия реакций, на их равновесие можно влиять, изменяя давление. Внутримолекулярной дегидратации, идущей с увеличением числа молей веществ, способствует пониженное или обычное давление. Наоборот, гидратации олефинов благоприятствует высокое давление, увеличивающее равновесную степень конверсии олефина. Так последняя при 250 – 300 *С и атмосферном давлении составляет всего 0,1 – 0,2%, что совершенно неприемлемо для практических целей, но при 7 – 8 МПа и тех же температурах она возрастает до 12 – 20%. Зависимость равновесной степени конверсии этилена при его гидратации от давления и температуры изображена на рис.60, причём аналогичные кривые характерны и для других олефинов. Очевидно, что гидратации способствуют одновременное снижение температуры и повышение давления. Рассмотрим теперь равновесие в системе межмолекулярная дегидратация спиртов – гидролиз простых эфиров. Термодинамическим методом регулирования направления этих реакций является изменение давления: на образование простого эфира оно не влияет, но получению олефина его снижение благоприятствует.
Механизм и кинетика реакций
Все рассматриваемые реакции принадлежат к числу кислотно-каталитических процессов. Типичными катализаторами гидратации являются достаточно сильные протонные кислоты: фосфорная кислота на носителе, поливольфрамовая кислота, сульфокатиониты. Для дегидратации используют фосфорную кислоту на носителе, оксид алюминия, серную кислоту, фосфаты (например СаНРО4) и другие. Роль катализаторов при гидратации состоит в протонировании олефина через промежуточное образование π- и σ-комплексов, причём обратная реакция дегидратации идёт через те же стадии, но в противоположном направлении:
СН2=СН2 + Н+ = СН3=СН2+ + Н2О = СН3=СН2ОН + Н+
При межмолекулярной дегидратации карбокатион не отщепляет протон, а взаимодействует с другой молекулой спирта:
СН3=СН2+ + СН3=СН2ОН = [СН3=СН+2] 2 О+Н = [СН3=СН+2] 2 О + +Н
Электрофильный механизм дегидратации олефинов определяет уже отмеченные выше направления присоединения по правилу Марковникова, а также изменение реакционной способности олефинов, чем больше замещённость тем выше реакционная способность. В соответствии с этим этен самый нереакционноспособный. Для разных условий и катализаторов отношение реакционной способности олефинов меняется, составляя, например, для 80% серной кислоты 16 000: 1 000: 500: 1 и увеличиваясь для менее сильных кислот. Это очень существенно для выбора условий гидратации, особенно температуры: последняя может быть более низкой (и более благоприятной для равновесия) для изобутена по сравнению с пропиленом и особенно с этиленом.
Равновесие гидратации – дегидратации мало зависит от строения олефина и спирта, поэтому ряд реакционной способности олефинов к гидратации должен соответствовать аналогичному ряду спиртов по их способности к дегидратации:
Третичный > вторичный > первичный.
Эта способность особенно растёт у β-кето- и β-нитроспиртов, электроноакцепторные группы которых повышают кислотность атомов водорода, находящихся при соседнем с НО-группой углеродном атоме. Это нередко делает возможным некаталитическую, дегидратацию или даже катализ реакции основаниями:
–СОСН2–СНОН– + НО-; - Н2О = –СОСН-–СНОН– = –СОСН=СН– НО-
При гетерогенно-каталитической внутримолекулярной и межмолекулярной дегидратации в газовой фазе кинетика процесса описывается соответственно следующими уравнениями:
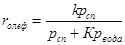 ,
,  .
.
Они учитывают практическую необратимость внутримолекулярной дегидратации и тормозящие влияние спирта и воды, лучше адсорбирующихся на активных центрах катализатора.
При гидратации олефинов вода всегда находится в избытке, поэтому тормозящим влиянием спирта можно пренебречь:
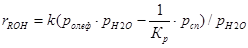
В ряде случаев роль воды более сложная. Так, фосфорная кислота, нанесённая на пористый носитель, образует на его поверхности жидкую плёнку, которая адсорбирует воду из газовой фазы. При каждых данных температуре и парциальном давлении водяных паров в газовой фазе устанавливается фазовое равновесие, и фосфорная кислота в плёнке имеет определённую концентрацию и соответствующую ей каталитическую активность. Последняя падает при снижении температуры и росте парциального давления воды, что ограничивает выбор этих параметров для каждого случая определёнными рамками.
При катализе реакций гидратации – дегидратации при помощи сульфокатионитов было найдено такое кинетическое уравнение:
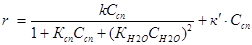
Первый его член соответствует катализу сульфогруппами катионита, а второй – специфическому катализу ионами гидроксония Н3О+. если количество воды в смеси мало, в уравнении преобладает первое слагаемое, сильно зависящее от концентрации воды; повышение этой величины ведёт к преобладанию второго слагаемого.
Теоретические сведения
В промышленности методом прямой гидратации получают этиловый и изопропиловый спирты. Прямая гидратация олефинов заключается в непосредственном присоединении воды к олефином:
С2Н4 + H2O ↔ C2H5OH
Синтез этилового спирта удалось осуществить лишь после того, как были изысканы достаточно активные катализаторы процесса. При газофазной гидратации в качестве катализаторов применяются фосфорная кислота или окись вольфрама на носителях. На последнем катализаторе процесс проводят и в жидкой фазе.
Газофазная реакция прямой гидратации олефинов обратима и идёт с выделением тепла. Тепловой эффект зависит от строения исходных олефинов и их молекулярного веса:
С2Н4 + H2O ↔ C2H5OH + 10,9 ккал/моль (45,6 кДж/моль);
Поскольку реакция идёт с выделением тепла и уменьшением объёма, ей благоприятствуют пониженные температуры и повышенные давления. Константа равновесия реакции равна: lgKр = (2100/T) – 6,195, где Т – температура, К. Практический выбор условий связан со скоростью реакции и, следовательно, с активностью катализатора. Реакцию удаётся реализовать при температурах от 200 до 300 °C, но эти условия термодинамически неблагоприятны для этилена. Поэтому на промышленных катализаторах степень конверсии олефинов в спирт низка.
Также, как и в случае сернокислотной гидратации, присоединение воды происходит по правилу Марковникова.
Механизм прямой гидратации олефинов в присутствии фосфорной кислоты был предложен Н.М.Чирковым. Первая стадия заключается в физическом растворении этилена в плёнке фосфорной кислоты на поверхности носителя. Затем происходит отщепление протона от молекулы кислоты:
H3PO4 ↔ Н+ + H2PO4-
Известно, что олефины, как и ароматические углеводороды являются слабыми основаниями, поэтому прямую гидратацию олефинов можно рассматривать как реакцию электрофильного замещения. Этилен образует с протоном π-комплекс, который переходит в более стабильный ион карбония. Далее ион карбония взаимодействует с водой за счёт неподелённой электронной пары атома кислорода; в данном случае проявляется нуклеофильность воды, обладающей амфотерными свойствами. В результате образуется ион алкоксония, который отщепляет протон с образованием спирта:
С2Н4 + Н+↔π-комплекс↔CH2+CH3 + H2O↔CH2(H2O) +CH3 + Н+↔C2H5OH
В производстве этилового спирта прямой гидратацией этилена наиболее широкое применение получил фосфорнокислотный катализатор на твёрдом носителе.
Катализаторы прямой гидратации не должны разрушаться под действием влаги, поэтому такой катализатор, как фосфорная кислота на кизельгуре, не применим – он не имеет скелета и легко разрушается. В качестве носителя для фосфорной кислоты применяют силикагель и алюмосиликат. Обычный шариковый алюмосиликат обрабатывают 20% -ной серной кислотой; при этом содержание оксида алюминия в нём снижается, а содержание оксида кремния повышается (излишнее количество оксида алюминия приводит к образованию малоактивных фосфатов алюминия). Затем носитель пропитывают 65%-ной фосфорной кислотой и сушат при 100°C. Готовый катализатор содержит 35-40% фосфорной кислоты. Если (как это и принято чаще всего) в качестве носителя используют шариковый силикагель, его обрабатывают водяным паром с целью пассивации.
В условиях реакции фосфорная кислота, осаждённая на носителе, растворена в плёнке воды, адсорбированной на поверхности пор, и реакция фактически протекает в жидкой плёнке фосфорной кислоты. Кислотный катализ, таким образом, сводится к гомогенному катализу в жидкой плёнке катализатора.
Как и в случае сернокислотной гидратации, при прямой гидратации этилена протекает ряд других реакций приводящих к побочным продуктам. За счёт взаимодействия иона карбония со спиртом образуется диэтиловый эфир:
C2H5OH + CH2 +CH3  (С2Н5)2О + H2
(С2Н5)2О + H2
За счёт дегидрирования спирта образуется ацетальдегид
C2H5OH  C2H4O+ H2
C2H4O+ H2
Причём реакция сопровождается образованием этана. Путём полимеризации этилена образуются полимеры:
CH2+CH3 + CH2CH2  CH2+CH3CH2CH2 и т.д.
CH2+CH3CH2CH2 и т.д.
По топытным данным конвертированный этилен расходуется на образование различных продуктов таким образом (в масс.%): на этанол – 94,5; на диэтиловый эфир – 2,5; на ацетальдегид – 2,0; на полимеры и сложные эфиры – 1,0.
Реакция прямой гидратации этилена описывается следующим интегральным уравнением при Т, рH2O, рC2H4 – const:
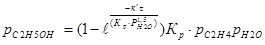
Влияние температуры
Реакцию прямой гидратации олефинов желательно проводить при невысоких температурах. Однако практически выбор температуры лимитируется скоростью реакции и активностью применяемых катализаторов.
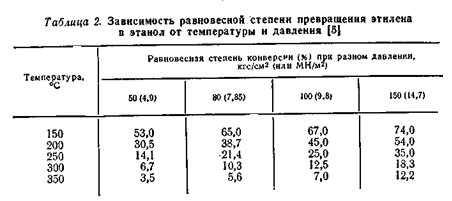
В таблице 2 приведена зависимость равновесной степени превращения этилена в этанол от температуры при разных давлениях.
Из приведённых данных видно, что с повышением температуры равновесная стиепень превращения этилена в спирт снижается. Однако, при низких температурах активность фосфорнокислотного катализатора мала. Так, степень конверсии этилена при 280 – 290 °C достигает лишь 4 – 5%, а при более низких температурах она ещё меньше (рис.3.)
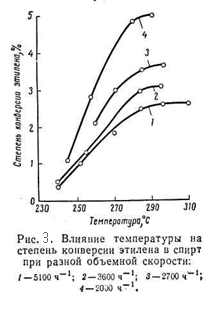
На практике процесс прямой гидратации в паровой фазе в присутствии фосфорнокислотного катализатора ведут в интервале 260 - 300°C.
Влияние мольного соотношения воды и этилена
Согласно термодинамическим данным, с увеличением отношения вода/этилен с 0,5/1 до 1/1 значительно повышается степень конверсии олефина

Однако экспериментальные данные отличаются от термодинамических (рис) с увеличением отношения вода/этилен до 0,7/0,75 степень конверсии этилена действительно возрастает, но при дальнейшем его увеличении она снижается.
Установлено также, что от соотношения вода/этилен зависит и активность катализатора гидратации. Оптимальная концентрация фосфорной кислоты в жидкостной плёнке на пористом носителе составляет 83 – 85%. Эта величина зависит от парциального давления водяного пара, которое определяется общим давлением в системе и мольным отношением вода/этилен. Оптимальная концентрация фосфорной кислоты наблюдается при отношении вода/этилен = 0,75/1. с дальнейшим ростом этого отношения возрастает количество воды в плёнке, уменьшается концентрация кислоты и снижается степень конверсии этилена. Поэтому в промышленных условиях принято мольное отношение вода/этилен = (0,6 – 0,7)/1.
Влияние давления
Повышение давления благоприятствует реакции гидратации, причём оптимальное давление составляет 70 – 80 кгс/см2. это давление связано с процессом абсорбции этилена фосфорной кислотой. Оптимальное парциальное давление водяных паров равно 27 – 30 кгс/см2; оно и определяет мольное соотношение водяных паров и этилена. Оптимальное парциальное давление этилена составляет 36 – 38 кгс/см2.

Общее давление складывается из парциальных давлениях воды, этилена и примесей. Прои концентрации этилена в циркулирующем газе 80 – 85% общее давление системы получается равным 70 - 80 кгс/см2.
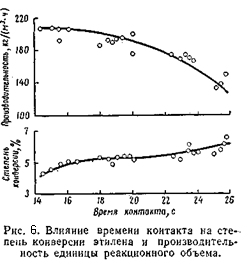
Влияние времени контакта
С увеличением времени контакта степень конверсии этилена возрастает, а производительность единицы объёма снижается. Оптимальное время контакта 17 – 19 с, что соответствует объёмной скорости 1 800 – 2 000 (1/час). В оптимальных условиях степень конверсии этилена не превышает 4,2 – 4,5 %, а селективность его использования достигает 95%. [2,3]
ЗАКЛЮЧЕНИЕ
Было рассмотрено три вида гидратации этилена: прямая гидратация с использованием в качестве катализатора фосфорной кислоты, сернокислотная гидратация этилена и гидратация на нейтральных катализаторах. Последняя, как уже было упомянуто выше, из-за своей дороговизны используется крайне редко. Большее распространение в промышленности получили первые два метода.
В случае сернокислотной гидратации основной статьёй расхода является сырьё и вспомогательные материалы, что связано с применением серной кислоты и с меньшей селективностью процесса, протекающего с образованием значительных количеств побочных продуктов. Себестоимость спирта полученного сернокислотной гидратацией примерно на 20% выше, чем при прямой гидратацией.
Поэтому с экономической точки зрения процесс прямой гидратации является наиболее выгодным.
Уже было упомянуто, что при сернокислотной гидратации образуется множество побочных продуктов, к ним относятся: диэтилсульфат, этилсульфат, диэтиловый эфир, этаналь и различные продукты полимеризации этилена (олигомеры и полимеры). Кроме того, сама серная кислота является опасным продуктом. Все эти вещества в больших количествах оказывают вредное воздействие на окружающую среду. И поэтому их нужно утилизировать, что увеличивает затраты на производстве.
При прямой гидратации тоже образуются побочные продукты: диэтиловый эфир, этаналь, фосфорные эфиры и различные виды полимеров, остатки фосфорной кислоты. Но в значительной меньшей мере, чем при сернокислотной гидратации этилена.
Поэтому с точки зрения экологичности процесса метод прямой гидратации этилена более выгоден. [2, 7]
УФИМСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ ЭКОНОМИКИ И СЕРВИСА
Уфимский государственный институт сервиса
Кафедра охраны окружающей среды
и рационального использования природных ресурсов
КУРСОВАЯ РАБОТА
По дисциплине «Промышленная экология»
На тему: Производство этанола методом гидратации этилена
Выполнил студент группы ОД-41 Давыдов Д.В. Проверил профессор Исмагилов Ф.Р.
Уфа 2006
СОДЕРЖАНИЕ
ВВЕДЕНИЕ...................................................................................................3
1. ЭКОЛОГИЗАЦИЯ ХИМИЧЕСКОЙ И НЕФТЕПЕРЕРАБАТЫВАЮЩЕЙ ПРОМЫШЛЕННОСТИ............4
1.1. Теоретические аспекты экологизации и экологизация производства..................................................................................................4
1.2 Очистка отходящих газов.......................................................................5
1.3. Очистка стоков нефтеперерабатывающей промышленности............6
1.4. Выбросы углеводородов........................................................................7
2. ПОДГОТОВКА СЫРЬЯ ДЛЯ ПРОЦЕССА ГИДРАТАЦИИ........8
2.1. Компримирование и осушка газа пиролиза........................................8
2.2. Фракционирование газа пиролиза......................................................10
2.3. Разделение пиролиза при высоком давлении....................................11
2.4. Очистка этилена...................................................................................15
2.5. Получение этилена диспропорционированием пропилена..............18
3. ОСНОВНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ СПИРТОВ......................20
4. ПРОИЗВОДСТВО СПИРТОВ СЕРНОКИСЛОТНОЙ ГИДРАТАЦИЕЙ ОЛЕФИНОВ..............................................................21
4.1. Теоретические сведения......................................................................21
4.2. Технология получения спиртов методом сернокислотной гидратации...................................................................................................28
5. ПРОИЗВОДСТВО СПИРТОВ ПРЯМОЙ ГИДРАТАЦИЕЙ ОЛЕФИНОВ...............................................................................................30
5.1. Теоретические сведения......................................................................30
5.2. Технологические особенности процесса...........................................35
5.3. Технологическая схема процесса.......................................................36
5.4. Характеристика основной аппаратуры..............................................40
5.5. Расчёт материального баланса гидратора..........................................41
6. ПРЯМАЯ ГИДРАТАЦИЯ ЭТИЛЕНА НА НЕЙТРАЛЬНЫХ КАТАЛИЗАТОРАХ..................................................................................46
ЗАКЛЮЧЕНИЕ.........................................................................................47
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ.............................48
ВВЕДЕНИЕ
В данной курсовой работе исследован процесс получения этанола из этилена путём гидратации последнего. А также рассмотрено получение сырья (этилен) путём фракционирования из газа пиролиза. И последующая его очистка от сероводорода, двуокиси и окиси углерода, ацетилена и кислорода.
Этанол принадлежит к числу многотоннажных и широко применяемых продуктов органического синтеза. Он является хорошим, хотя и огнеопасным растворителем; в больших количествах используется в пищевой и медицинской промышленности. Служит горючим в жидкостных ракетных двигателях, антифризом и т. д. Как промежуточный продукт органического синтеза этанол имеет важное значение для получения сложных эфиров: хлороформа, хлораля, диэтилового эфира, ацетальдегида и уксусной кислоты.
В России процесс производства синтетического этанола посредством гидратации этилена осуществляется двумя способами: сернокислотной и прямой гидратацией. Первый способ внедрен в промышленном масштабе с 1952г, второй получил широкое распространение в последние десятилетия.
На сегодняшний день любой технологический процесс должен рассматриваться не только с точки зрения экономических показателей, но и должно обязательно учитываться влияние этого процесса на окружающую среду.
Процесс получения этанола на всех этапах – от подготовки сырья до получения уже готового продукта – сопровождается использованием или образованием опасных для окружающей среды веществ. Таких как серная кислота, фосфорная кислота и др. Совершенно естественно, что выбор метода производства этанола должен учитывать вредное влияние продуктов производства на окружающую среду.
Но в то же самое время любой технологический процесс должен быть и экономически целесообразным.
Исследование вредного воздействия на окружающую среду с учётом экономической эффективности я и считаю целью данной курсовой работы.
ЭКОЛОГИЗАЦИЯ ХИМИЧЕСКОЙ И НЕФТЕПЕРЕРАБАТЫВАЮЩЕЙ ПРОМЫШЛЕННОСТИ
Дата: 2019-07-24, просмотров: 410.