Апробацию всех предлагаемых опытов мы проводили на базе МОУ Лицей информационных систем и технологий № 73 г. Пензы.
В ходе проведения нашей работы мы рассматривали возможности применения данной лаборатории в различных видах учебной деятельности: на уроках и на элективных курсах.
Апробацию возможностей этой лаборатории в процессе обучения мы проводили при изучении следующих тем:
· Растворение как физико-химический процесс. Растворимость. Типы растворов
· Тепловой эффект химической реакции
· Среда водных растворов. Водородный показатель.
· Реакции ионного обмена
· Окислительно-восстановительные реакции
· Гидролиз неорганических веществ
Бесспорно, каждый из этих опытов (1. Экзотермические реакции. Растворение гидроксида натрия и безводного сульфата меди в воде. 2. Эндотермические реакции. Понижение температуры раствора при растворении некоторых солей в воде: нитрата калия, нитрата аммония, тиосульфата натрия. 3. рН раствора при растворении гидроксида натрия в воде. 4. Реакции нейтрализации. Взаимодействие гидроксида натрия с соляной кислотой.), предлагаемых разработчиками лаборатории, позволил нам отследить процессы изменения температуры или рН в динамике, с показом конкретных значений температуры и водородного показателя растворов. Однако, по нашему мнению и по мнению ряда компетентных авторов все они требуют неоправданных затрат времени на настройку и обеспечение наглядности для всего класса на уроке. Ведь есть другие и при этом более наглядные, с позиций органолептики, способы показа и изменения температуры: примерзание стакана с раствором нитрата аммония или хлорида натрия к фанерной доске; а для показа изменения рН: использование универсальной индикаторной бумаги или растворов индикаторов. Да – это старые, не использующие ИКТ методики, но они проверены временем и вызывают у современного учащегося больший интерес, нежели график на дисплее монитора.
Нами были отмечены и другие недостатки в разработках авторов лаборатории Архимед:
1. Непродуманный расход реагентов при проведении опытов
1. Непродуманные установки для проведения экспериментов
2. Несовместимость карманного компьютера на базе Palm OS® с настольным ПК по формату графических файлов, файловой системе.
5. Не синхронизированное сохранение данных: программа Imagi Probe 2.0 сохраняет данные произвольно, а не в папки, выбираемые экспериментатором
6. Неудобства при работе с температурным датчиком: согласно идее разработчиков цифровой лаборатории «Архимед» температурный датчик необходимо целиком помещать в вещество, температуру которого мы хотим измерить. При этом необходимо будет нарушить герметизацию сосуда, а это испортит весь эксперимент. Так что при проведении термодинамических процессов приходится ограничиваться показаниями температуры воздуха рядом с исследуемым сосудом.
В предлагаемых разработках мы постарались учесть, все эти недостатки и предложили методики, максимально приближающие школьника к достоверным результатам.
Наш эксперимент с использованием цифровой лаборатории «Архимед» показал, что заявленные авторами преимущества использования этой лаборатории: повышение уровня знаний по химии за счёт активной деятельности учащихся; способствует раскрытию творческого потенциала учащихся; способствуют решению и освоению межпредметных задач – реальны, но скорее во внеурочной деятельности. Например, на элективных курсах и при реализации исследовательских работ школьников.
С 2006 года в учебный план МОУ Лицей информационных систем и технологий № 73 г. Пензы введён элективный курс «Химия и медицина», а с 2007 года элективный курс «Химия и экология».
Сегодня нами разработаны ряд методик к занятиям на элективном курсе «Химия и медицина» с анализом лекарственных препаратов и лекарственных форм.
В практике элективного курса «Химия и экология» был апробирован эксперимент: «Влияние продуктов коррозии на развитие водных растений». Данный эксперимент может быть проведён и в урочное время в 9 классе при изучении темы «Металлы» на уроке «Общие понятия о коррозии металлов». Однако, методика опыта предусматривает достаточно длительное время для получения результата и в результате школьники видят динамику только в графике на слайде, не приняв участия в самом процессе исследования изменения рН.
В практике элективного курса «Химия и медицина» у учеников 10 класса был апробирован эксперимент, методическая разработка которого, предполагает использование возможностей цифровой лаборатории «Архимед». Данный эксперимент был проведён в рамках занятия «Здоровое питание» (Приложение 4).
Для первого занятия нами была составлена презентация «Цифровая лаборатория «Архимед» – новое поколение школьных естественно-научных лабораторий» (см. УМК к работе). Данная презентация содержала ознакомительную информацию о возможностях, устройстве, внешнем виде, комплекте датчиков, настройке работы, регистрации данных, предполагаемым результатам при работе с цифровой лабораторией «Архимед».
На этом же занятии нами было проведено анкетирование среди учащихся – слушателей элективного курса «Химия и медицина» (Приложение 7). Целью анкетирования было исследование готовности учеников к экспериментальной работе с оборудованием и цифровой лабораторией.
Анализ проведённого анкетирования показал, что
1) На вопрос «Знаете ли, Вы, что такое «водородный показатель?»
- «Да» – 0%
- «Нет» – 100%
2). На вопрос «Знакома ли Вам методика титрования?»
- «Да» – 10%
- «Нет» – 90%
3). На вопрос «Имеете ли, Вы, опыт работы с цифровыми лабораториями?»
- «Да» – 20%
- «Нет» – 80%.
4). На вопрос «Заинтересовала ли Вас работа с цифровой лабораторией «Архимед» после просмотра презентации?»
- «Да» – 90%
- «Нет» – 10%
В анкетировании принимало участие 15 человек – учащиеся, посещающие факультатив «Химия и медицина».
На следующем занятии нами была проведена работа по теме «Анализ качества пищевых продуктов». Конспект фрагмента занятия «Здоровое питание» по теме «Анализ качества пищевых продуктов» представлен в Приложении 6. Цель занятия: освоение методов анализа качества продуктов питания и сырья, с использованием возможностей цифровой лаборатории «Архимед». Тематическое содержание занятия предполагает рассмотрение методик титрования растворов и вытяжек из выбранных для анализа продуктов питания и сырья, а также теоретическое обоснование проходящих процессов. Все результаты собственных исследований учащиеся заносили в таблицы, с дальнейшим подсчётом кислотности исследуемых продуктов (молока, хлеба, творога, муки). По окончании проведения эксперимента и на основании получаемой теоретической информации (виды сырья, показатели, характеризующие качество продуктов), учащимся предлагается сделать выводы. Выводы должны содержать заключения о качестве исследуемых продуктов. Такая исследовательская работа не только знакомит учащихся с физико-химическими методами анализа, но и позволяет каждому учащемуся побыть в роли эксперта, что не маловажно для реализации целей и задач элективных курсов: создание условий для обучения старшеклассников в соответствии с их профессиональными интересами и намерениями в отношении продолжения образования.
В заключение занятия «Анализ качества пищевых продуктов» у учащихся, использовавших в своей работе цифровую лабораторию «Архимед» было проведено анкетирование (Приложение 8).
Целью проведения анкетирования с учащимися, посещающими элективный курс «Химия и медицина» было:
1) Оценить доступность техники работы с цифровой лабораторией «Архимед» для учащихся.
2) Сделать выводы об эффективности использования цифровой лаборатории «Архимед», как средства обучения на элективном курсе.
3) Сделать вывод о степени наглядности данных, получаемых при работе с цифровой лабораторией «Архимед» для учащихся.
4) Получить информацию об актуальности темы «Анализ качества пищевых продуктов», проводимой в рамках элективного курса «Химия и медицина» для учащихся.
В анкетировании приняли участие 15 человек – учащиеся, посещающие элективный курс «Химия и медицина».
В результате анкетирования были получены следующие данные.
На вопрос об актуальности выбранной темы занятия «Анализ качества пищевых продуктов» на элективном курсе «Химия и медицина»
- 87% опрошенных ответили, что задумывались о качестве продуктов, которые потребляют.
- 13% ответили, что не задумывались над данным вопросом.
При проверке образовательного потенциала цифровой лаборатории «Архимед» были получены следующие данные:
1) На вопрос «Получили ли, Вы, новые знания по химии на сегодняшнем занятии?»
- 87% ответили «Да», из них 80% считают полученные знания полезными для себя, а 7% - очень полезными.
- 13% ответили « Нет».
2) На вопрос «Знаете ли, Вы, что такое «водородный показатель»?
- 27% ответили «Да, но сегодняшняя работа позволила закрепить теорию на практике»
- 34% ответили «Да, я узнал это при проведении работы сегодня»
- 39% ответили «Нет».
3) На вопрос «Знаете ли, Вы, что такое титрование?»
- 60% ответили «Да»
- 40% ответили «Нет»
4) На вопрос «Позволяет ли использование цифровой лаборатории « Архимед» получать данные, недоступные в традиционных учебных экспериментах»
- 100% ответили «Да»
- 0% ответили «Нет»
При проверке степени наглядности цифровой лаборатории «Архимед» на вопрос «Какой эксперимент был наиболее наглядным для понимания Вами учебного материала?»
- 53% ответили «С цифровой лабораторией « Архимед»
- 47% ответили «Без неё».
На вопрос о доступности техники работы с цифровой лабораторией «Архимед»
- 27% ответили «Да, я смогу использовать цифровую лабораторию «Архимед» в самостоятельной исследовательской деятельности»
- 46% ответили «Да, я смогу использовать цифровую лабораторию «Архимед», но только при руководстве учителя»
- 27% ответили «Нет».
Таким образом, наш небольшой опыт использования цифровой лаборатории «Архимед» показал, что доступность техники работы с предлагаемой цифровой лабораторией, как и с большинством технических средств, обеспечивается систематичностью её использования в обучении. В нашем случае для учащихся это был первый опыт. Вероятно, обозначенные учащимися сложности, являются не столько следствием технической неготовности учащихся использовать цифровые лаборатории, сколько их неготовностью использовать их применительно к химии. Однако, грамотная формулировка учителем актуальности использования цифровой лаборатории «Архимед» для получения данных недоступных в традиционных учебных экспериментах, по нашему мнению, позволит снять эту проблему.
Выводы
1. Проведён методический анализ материалов по основным направлениям развития информационных и коммуникационных технологий в современном естественно-научном образовании, в частности в обучении химии.
2. Освоена техника работы с использованием цифровой лаборатории «Архимед».
3. Проведён методический анализ разработок опытов по химии создателей цифровой лаборатории «Архимед».
4. Разработаны методики и теоретическое обоснование результатов экспериментов с использованием цифровой лаборатории «Архимед» в урочной и внеурочной деятельности (элективные курсы «Химия и медицина», «Химия и экология») по химии.
5. Проведена апробация самостоятельно разработанных, модифицированных и предложенных разработчиками цифровой лаборатории «Архимед» опытов в урочной и внеурочной деятельности по химии.
6. Для исследования эффективности применения цифровой лаборатории «Архимед» в процессе обучения применяли метод выборочного‚ группового‚ очного анкетирования.
7. Составлено пособие к практикуму для учащихся – слушателей элективных курсов «Химия и экология» и «Химия и медицина» в форме рабочей тетради.
Список Литературы
1. Аксёнова Э.Н., Андрианова О.П. Руководство к лабораторным занятиям по фармацевтической химии. – 3-е изд., перераб. и доп. – М.: Медицина, 2001. – 384 с.
2. Анисимова Г.А. Библиотека сетевых образовательных ресурсов для современного учителя химии // Современные информационные технологии в обучении химии: Материалы III областной научно- практической конференции учителей химии и преподавателей вузов (Пенза, ПГПУ им. В. Г. Белинского, 2006). – Пенза: ПГПУ, 2006. – С. 20 –21.
3. Архимед 2004. Первый шаг (http: //www.9151394. ru/projects/arhimed/ arhkonkurs_040315/pobediteli.html).
4. Беспалько, В. П. Персонифицированное образование / В. П. Беспалько // Педагогика. – №2. – 1998. – С. 17.
5. Бондарев А.С., Дмитриева Н.В., Терехин М.Б. Цифровые лаборатории «Архимед» в обучении биологии (http://sputnik.mto.ru/Docs_35/Kongress/6.html).
6. Габриелян О.С. Химия. 8-9 класс: Методическое пособие. – М., Дрофа, 1999-2001. – 128с.
7. Габриелян О.С.‚ Остроумов Г. Химия 9 класс: Настольная книга учителя. – М.: Дрофа, 2003. – 400с.
8. О.С. Габриелян. Химия. 8 кл.: тетрадь для лабораторных опытов и практических работ к учебнику О.С. Габриеляна « Химия. 8 класс» / О.С. Габриелян, А.В. Яшукова. – 3-е изд., стереотип. – М.: Дрофа, 2008. – 96 с.
9. Габриелян О.С. и др. Химия. 9 класс: Учебник для общеобразовательных учреждений. М.: Дрофа, 2003. – 224с.
10. Додонов Е.Д. «Живой калейдоскоп» информационных технологий / Международный педагогический мастер-класс 2004 Цифровая школьная четверть. 2004 (http://www.bgpu.ru/intel/Material/mc_04/text/dodonov.htm).
11. Дорофеев М.В. Информатизация школьного курса химии // Химия. Первое сентября. – 2002. – №37. С.35 –38.
12. Дружинин В. Н. Экспериментальная психология. – СПб.: Питер, 2002. – 45 с.
13. Дунин С.М., Федорова Ю.В. «Живая физика» плюс цифровая лаборатория «Архимед» (материалы Педагогического марафона – 2005) // Физика. Приложение к газете «Первое сентября». – 2005. – № 11.
14. Дунин С.М., Федорова Ю.В. Совместное использование программы «Живая физика» и цифровой лаборатории «Архимед» (http://www.9151394.ru/projects/arhimed/arhkonkurs_040315/dunin/sovm_isp.htm).
15. Закурдаева С.Ю. Цифровая лаборатория «Архимед». Исследовательская деятельность учащегося (материалы Педагогического марафона – 2004) // Физика. Приложение к газете «Первое сентября». – 2004. – № 22, Новые технологии в образовании / Семинар в Центре информационных технологий и учебного оборудования (http://pedsovet.edu.ru/nfpk_web/start.htm)
16. Intel® “Обучение для будущего” (при поддержке Microsoft® ) – М.: «Русская редакция», 2005. – 368с.
17. Каталог образовательных средств и решений. Школьные лаборатории. Цифровая лаборатория «Архимед» / Институт новых технологий (http://www.int-edu.ru/arhimed/).
18. Концепция информатизации системы общего образования республики Саха (Якутия).
19. Кузнецова А.В. Практикум по прикладной химии: Учебное пособие ( ПГПУ им. В.Г. Белинского). – Пенза, 2004. – 108 с.
20. Линьков В.М. // Современные информационные технологии в обучении химии: Материалы III областной научно- практической конференции учителей химии и преподавателей вузов (Пенза, ПГПУ им. В. Г. Белинского, 2006). – Пенза: ПГПУ, 2006. – C. 7 –8.
21.Мелентьева Г.А., Антонова Л.А. Фармацевтическая химия. – М.: Медицина, 1985. – 480 с.
22.Мещерякова Е. А. Метод компьютерных проектов в практике обучения химии // Современные информационные технологии в обучении химии: Материалы III областной научно- практической конференции учителей химии и преподавателей вузов (Пенза, ПГПУ им. В. Г. Белинского, 2006). – Пенза: ПГПУ, 2006. – С. 72 –75.
23.Мещерякова О. А. Организация проектной деятельности в локальной сети // Современные информационные технологии в обучении химии: Материалы III областной научно- практической конференции учителей химии и преподавателей вузов (Пенза, ПГПУ им. В.Г. Белинского, 2006). – Пенза: ПГПУ, 2006. – С. 70 –72.
24.Морозов М.Н., Танаков А.И., Герасимов А.В., Быстров Д.А., Цвирко В.Э., Дорофеев М.В. Разработка виртуальной химической лаборатории для школьного образования. Educational Technology & Society, 2004, №3 – С. 155 –164.
25.Новые технологии в образовании / Семинар в Центре информационных технологий и учебного оборудования (http://pedsovet.edu.ru/nfpk_web/start.htm).
26. Подьячева Е.А., Ашкеева Г.Х., Макеева Е.Е. и др. Практикум по химии: ( для подготовительных отделений). – Алма-Ата: Мектеп, 1987. – 160 с.
27. Полат Е. С. Новые педагогические технологии / Пособие для учителей – М.: 1997. – С. 55 –58.
28. Программа курса химии для 8-11 классов общеобразовательных учреждений. – М.: Дрофа, 2000-2002. –160с.
29.Роева Н. Н., Клячко Ю. А, Кирничная В. К. Методы исследования свойств сырья и продуктов питания. Лабораторный практикум для студентов технологических специальностей. – М.: 2000. – С. 24 –26.
30.Таирова Е. А. Обзор учебников и пособий по химии на электронных носителях // Современные информационные технологии в обучении химии: Материалы III областной научно- практической конференции учителей химии и преподавателей вузов (Пенза, ПГПУ им. В. Г. Белинского, 2006). – Пенза: ПГПУ, 2006. – С. 22 –31.
31.Уваров А.Ю. Два кризиса образования, учебная архитектура и Интернет // Организационные инновации в управлении интегрированными образовательными учреждениями: Материалы Всероссийской научно-практической конференции (Барнаул, 2002). – Барнаул. – 2002. - С. 16-17.
32.Уваров А.Ю. О конструктивных элементах открытой учебной архитектуры // «Информационные технологии в непрерывном образовании»: Тезисы докладов Международной конференции (Петрозаводск, Петрозаводский государственный университет, 1995). – Петрозаводск.: Изд-во Петрозаводского государственного университета, 1995 г. – С. 15.
33.Уваров А.Ю.Открытая учебная архитектура для школы информационного века // Образование и информатика: Труды Международного конгресса ЮНЕСКО. Т. 4, М.: 1997.
34.Уваров А.Ю. Подготовка педагогов в проекте «Информатизация системы образования» // «Телематика'2003»: Материалы X Всероссийской научно-методической конференции. – СПб.: 2003. С. 25 –27.
35.Федорова Ю.В., Трактуева С.А., Шапиро М.А., Панфилова А.Ю. Цифровые лаборатории «Архимед» // Информационные технологии в образовании-2003. Сборник трудов конференции (http://www.bitpro.ru/ito/2003/II/1/II-1-2863.html; http://www.ito.su/2003/tezis/II-1-2863-Ustniy.html
36.Филиппова В.М, Тихомирова В. П. Фрагменты коллективной монографии под общей редакцией В. М. Филиппова и В.П. Тихомирова. http: / /academy.odoportal.ru/documents/academ/bibl/russia/1/html.
37. Фирстова Н. В., Мещерякова О. А. Практикум к элективному курсу «Химия и экология». – Пенза: ПГПУ‚ 2007. – 50 с.
38. Цифровая лаборатория « Архимед». Методические материалы. Институт новых технологий. – М.: 2007. – 375 с.
39. Штремплер Г.И. Химия на досуге: Домашняя хим. лаб.: Кн. для учащихся. – М.: Просвещение: « Учеб. лит.», 1996. – 94 с.
40.sota –as.ru
41.www. FIZfaq 1502.narod.ru./ arhimed.)
42. Эпштейн Д.А., Ходаков Ю.В. Неорганическая химия. Учебник для 9 класса. – М.: Просвещение, 1986. – С. 112 – 116.
Приложение 1. Примерное календарно-тематическое планирование учебного материала по химии в 9 классах
| № урока | Содержание учебного материала |
| 1-2 | Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева |
| 3 | Амфотерные оксиды и гидроксиды |
| 4 | Периодический закон и система элементов Д.И.Менделеева |
| Раздел 1.Скорость химических реакций. Химическое равновесие(6ч) по учебнику 8 класса | |
| 5 | Скорость химических реакций |
| 6 | Зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры |
| 7 | Катализ и катализатор |
| 8 | Обратимые и необратимые реакции |
| 9 | Химическое равновесие и способы его смещения |
| 10 | Обобщение и систематизация знаний по теме |
| Раздел 2 . Металлы (15 ч) | |
| 11 | Положение элементов металлов в Периодической системе Д.И.Менделеева и особенности строения их атомов Физические свойства металлов |
| 12 | Химические свойства металлов |
| 13 | Общие понятия о коррозии металлов |
| 14 | Сплавы |
| 15 | Металлы в природе. Общие способы их получения |
| 16 | Общая характеристика элементов главной подгруппы I группы |
| 17 | Соединения щелочных металлов |
| 18 | Общая характеристика элементов главной подгруппы II группы |
| 19 | Соединения щелочноземельных металлов |
| 20 | Алюминий, его физические и химические свойства |
| 21 | Соединения алюминия |
| 22 | Железо, его физические и химические свойства |
| 23 | Генетические ряды Fe2+ и Fe3+ |
| 24 | Обобщение по теме «Металлы» |
| 25 | Контрольная работа по теме «Металлы» |
| Раздел 3 . Неметаллы (20ч.) | |
| 26 | Общая характеристика неметаллов |
| 27 | Общая характеристика галогенов |
| 28 | Соединения галогенов |
| 29 | Сера, ее физические и химические свойства |
| 30 | Оксиды серы (IV) и (VI) |
| 31 | Серная кислота и ее соли |
| 32 | Азот и его свойства |
| 33 | Аммиак и его свойства |
| 34 | Соли аммония |
| 35 | Азотная кислота и ее свойства |
| 36 | Соли азотистой и азотной кислот. Азотные удобрения |
| 37 | Фосфор |
| 38 | Соединения фосфора |
| 39 | Углерод |
| 40 | Оксиды углерода(II) и (IV) |
| 41 | Карбонаты |
| 42 | Кремний |
| 43 | Силикатная промышленность |
| 44 | Обобщение по теме «Неметаллы» |
| 45 | Контрольная работа по теме «Неметаллы» |
| Раздел 4. Практикум по неорганической химии (5 ч) | |
| 46 | Получение амфотерного гидроксида и изучение его свойств |
| 47 | Получение аммиака и исследование |
| 48-49 | Решение экспериментальных задач на распознавание важнейших катионов и анионов |
| 50 | Решение экспериментальных задач на распознавание важнейших катионов и анионов |
| Раздел 5 . Органические вещества (12ч.) | |
| 51 | Предмет органической химии. Строение атома углерода |
| 52 | Алканы. Химические свойства и применение алканов |
| 53 | Алкены. Химические свойства этилена |
| 54 | Понятие о спиртах на основе реакции гидратации этилена и взаимодействия этилена с раствором перманганата калия |
| 55 | Окисление альдегида в кислоту и понятие об одноосновных карбоновых кислотах |
| 56 | Понятие о сложных эфирах. Жиры |
| 57 | Понятие об аминокислотах |
| 58 | Реакция поликонденсации аминокислот. Белки |
| 59 | Углеводы |
| 60 | Полимеры |
| 61 | Обобщение знаний учащихся по органической химии |
| 62 | Решение экспериментальных задач на распознавание органических веществ с использованием качественных реакций на альдегиды, многоатомные спирты, крахмал и непредельные соединения |
| Тема 7. Обобщение знаний по химии за курс основной школы (6ч.) | |
| 63 | Периодический закон и Периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома |
| 64 | Строение вещества (виды химических связей и типы кристаллических решеток) |
| 65 | Химические реакции |
| 66 | Классы химических соединений в свете ТЭД. |
| 67 | Контрольная работа по теме «Органические вещества» и «Обобщение знаний по химии за курс основной школы» |
| 68 | Подведение итогов |
Приложение 2. Примерное календарно-тематическое планирование учебного материала по химии в 8 классах
| № урока |
Содержание учебного материала
Раздел 1. Атомы химических элементов (10 часов)
Приложение 3. Примерное календарно-тематическое планирование учебного материала по химии в 11 классах
| № | Содержание учебного материала | Примерные сроки | ||
| 11А | 11Б | |||
| Раздел №1 Строение атома | ||||
| 1. | Основные сведения о строении атома. | 2.09 | 5.09 | |
| 2. | Электронная оболочка. Особенности строения электронных оболочек переходных элементов. | 6.09 | 6.09 | |
| 3. | Периодический закон и периодическая система химических элементов Д.И.Менделеева. | 9.09 | 12.09 | |
| 4. | Значение периодического закона Д.И. Менделеева. | 13.09 | 13.09 | |
| 5. | Виды химической связи. Ионная связь. | 16.09 | 19.09 | |
| 6. | Ковалентная полярная и неполярная химическая связь. | 20.09 | 20.09 | |
| 7. | Металлическая связь. | 23.09 | 26.09 | |
| 8. | Водородная химическая связь. | 27.09 | 27.09 | |
| 9. | Повторение и обобщение знаний по теме «Строение атома. Химическая связь» | 30.09 | 3.10 | |
| 10. | Контрольная работа №1 по теме «Строение атома» | 4.10 | 4.10 | |
| Раздел №2 Строение вещества и их свойства | ||||
| 11. | Полимеры. | 7.10 | 10.10 | |
| 12. | Органические полимеры. Волокна. | 11.10 | 11.10 | |
| 13. | Органические полимеры. Волокна. | 14.10 | 17.10 | |
| 14. | Неорганические полимеры. | 18.10 | 18.10 | |
| 15. | Вещества молекулярного строения. Газообразные вещества. | 21.10 | 24.10 | |
| 16. | Жидкие вещества. | 25.10 | 25.10 | |
| 17. | Твердые вещества. | 28.10 | 31.10 | |
| 18. | Чистые вещества и смеси. | 1.11 | 1.11 | |
| 19. | Дисперсные системы. | 11.11 | 14.10 | |
| 20. | Состав смесей. Разделение смесей. | 15.11 | 15.11 | |
| 21. | Истинные растворы. Способы выражения концентрации. | 18.11 | 21.10 | |
| 22. 23. 24. 25. | Решение задач на массовую долю растворимого вещества. Решение задач на массовую долю растворимого вещества. Решение задач на массовую долю растворимого вещества. Решение задач на массовую долю растворимого вещества. | 22.11 25.11 29.11 2.12 | 22.11 28.10 29.11 5.12 | |
| 26. | Урок-зачет «Решение задач» | 6.12 | 6.12 | |
| 27. | Классификация химических реакций. Реакции, которые идут без изменения состава. | 9.12 | 12.12 | |
| 28. | Классификация химических реакций, которые идут с изменением состава вещества. | 13.12 | 13.12 | |
| 29. | Тепловой эффект химической реакции. | 16.12 | 19.12 | |
| 30. | Скорость химической реакции. | 20.12 | 20.12 | |
| 31. | Обратимость химических реакций. Химическое равновесие. | 23.12 | 26.12 | |
| 32. | Условия смещения химического равновесия. | 27.12 | 27.12 | |
| 33. | Электролитическая диссоциация. | |||
| 34. | Реакции ионного обмена. | |||
| 35. | Гидролиз. Гидролиз неорганических веществ. | |||
| 36. | Гидролиз органических веществ. | |||
| 37. | Среда водных растворов. Водородный показатель. | |||
| 38. 39. | Окислительно-восстановительные реакции. | |||
| 40. 41. | Электролиз. | |||
| 42. | Обобщение знаний по теме «Строение вещества и их свойства» | |||
| 43. | Контрольная работа №2 по теме «Строение вещества и их свойства» | |||
| Раздел №3 Вещества и их свойства | ||||
| 44. | Металлы и их свойства. |
| ||
| 45. | Металлотермия. Коррозия металлов |
| ||
| 46. | Общие способы получения металлов |
| ||
| 48 | Общая характеристика инертных газов. |
| ||
| 49 | Общая характеристика галогенов. |
| ||
| 50 | Классификация неорганических и органических веществ. |
| ||
| 51 | Оксиды. |
| ||
| 52 | Кислоты. Химические свойства кислот. Неорганические и органические кислоты. |
| ||
| 53. | Особые свойства серной кислоты. |
| ||
| 54. | Особые свойства азотной кислоты. |
| ||
| 55. | Основания. |
| ||
| 56. | Соли. |
| ||
| 57. | Химические свойства солей. |
| ||
| 58. | Генетическая связь между классами неорганических соединений |
| ||
| 59. | Генетическая связь между классами органических соединений |
| ||
| 60. | Повторение и обобщение темы «Вещества и их свойства» |
| ||
| 61. | Урок-зачет по теме «Вещества и их свойства». |
| ||
| 62. | Контрольная работа №3 по теме «Вещества и их свойства» |
| ||
| 63. | Практическая работа №1 |
| ||
| 64. | Практическая работа №2 |
| ||
| 65. | Химия в жизни общества (урок- конференция) · Химия и промышленность · Химия и сельское хозяйство · Химия и экология · Химия и повседневна жизнь человека |
| ||
| Резерв | ||||
| 66. 67. 68 | Решение задач и упражнений |
| ||
| Общее число по курсу | 68 | |||
| Демонстрации | 5 | |||
| Лабораторные опыты | 22 | |||
| Практические работы | 2 | |||
| Контрольные работы | 3 | |||
Приложение 4. Тематическое содержание программы элективного курса «Химия и медицина»
| № | Наименование тем курса | Количество часов |
| I | Теоретический курс | 11 |
| 1 | Химия и лекарства | 1 |
| 2 | Здоровое питание | 1 |
| 3 | Пищевые добавки | 1 |
| 4 | Витамины | 1 |
| 5 | Гормоны | 1 |
| 6 | Ферменты | 1 |
| 7 | Антибиотики | 1 |
| 8 | Анестезирующие средства | 1 |
| 9 | Полимеры в медицине | 1 |
| 10 | Неорганические вещества как лекарства | 1 |
| 11 | Экскурсия в домашнюю аптечку | 1 |
| II | Практикум | 4 |
| 12 | Изучение свойств веществ, производных салициловой кислоты | 1 |
| 13 | Изучение свойств лекарственных веществ, производных п-аминофенола | 1 |
| 14 | Обнаружение витаминов | 1 |
| 15 | Решение экспериментальных задач с использованием лекарственных веществ | 1 |
| III | Подведение итогов | 2 |
| 16 | Экскурсия в центр сертификации контроля и качества лекарственных препаратов. | |
| 17 | Защита проектов | 1 |
Приложение 5. Тематическое содержание программы элективного курса «Химия и экология»
| № | Наименование тем курса | Количество часов |
| I | Теоретический курс | 24 |
| 1 | История экологии, значение экологии, прикладная экология. | 1 |
| 2 | "Страхи" современного мира. | 1 |
| 3 | Современные проблемы утилизации мусора (Экологическая ситуация в городе и условия жизни населения). | 1 |
| 4 | Современные экологические проблемы с точки зрения химика. | 1 |
| 5 | Яды вокруг нас! Решение задач. | 1 |
| 6 | Диоксины и окружающая среда. Решение задач. | 1 |
| 7 | Медь и окружающая среда. | 1 |
| 8 | Изучение белков в связи с охраной природы. | 1 |
| 9 | Бензин и кислотные загрязнители. | 1 |
| 10 | Эпидемиология. | 1 |
| 11 | Решение задач с экологическим содержанием. | 1 |
| 12 | Работа в Интернет-классе по отбору информации для проектов и сообщений. | 1 |
| 13 | Решение задач с экологическим содержанием. | 1 |
| 14 | Нужно ли бояться Леонидовки? | 1 |
| 15 | Экология воды. Решение задач. | 1 |
| 16 | Чистая вода для хвори беда! | 1 |
| 17 | Экология почв | 1 |
| 18 | Экологические проблемы в добыче полезных ископаемых | 1 |
| 19 | Источники загрязнения атмосферы. | 1 |
| 20 | Экология воздуха. | 1 |
| 21 | Пластмасса вчера, сегодня и завтра. | 1 |
| 22 | Экология питания. | 1 |
| 23 | Консерванты, красители в пищевых продуктах. | 1 |
| 24 | Решение задач с экологическим содержанием. | 1 |
| II | Практикум. | 6 |
| 25 | Методы экологии. | 1 |
| 26 | Мониторинг водных сред (1). | 1 |
| 27 | Мониторинг водных сред (2). | 1 |
| 28 | Мониторинг почвы. | 1 |
| 29 | Минеральные удобрения как возможные загрязнители почв и сельхозпродукции | 1 |
| 30 | Медико-экологические исследования Определение нитратов в пищевых продуктов (овощных культурах). | 1 |
| III | Подведение итогов. | 4 |
| 31 | Экскурсия в Росприроднадзор Пензенской области. | 1 |
| 32 | Экскурсия в ЦЛАТИ по Пензенской области. | 1 |
| 33 | Защита проектов. | 1 |
| 34 | Защита проектов. | 1 |
Приложение 6. Конспект занятия «Анализ качества пищевых продуктов»
Цель: освоение методов анализа качества продуктов питания и сырья, с использованием возможностей цифровой лаборатории «Архимед».
Задачи:
1. Сформировать у учащихся представление о водородном показателе растворов на основе выполнения опытов по определению рН.
2. Познакомить школьников с методикой титрования.
3. Сформировать у учащихся интерес к проблеме здорового питания.
4. Активизировать познавательную активность учеников в процессе проведения эксперимента.
Форма работы: фронтальная (демонстрационный опыт)
Тип занятия: изучение нового материала
Ведущий метод: объяснительно-иллюстративный
Реактивы и оборудование: молоко, творог, хлеб, мука, 2% спиртовой раствор фенолфталеина, дистиллированная вода, 0,1 М раствор едкого натра; цифровая лаборатория «Архимед», датчик рН, химический стакан, бюретка, конические колбы для титрования,.
План занятия
1. Презентация «Цифровая лаборатория «Архимед»
2. Анкетирование № 1 (Приложение 7)
3. Знакомство учащихся с методикой проведения анализа качества пищевых продуктов без цифровой лаборатории «Архимед».
4. Знакомство учащихся с методикой проведения анализа качества пищевых продуктов с цифровой лабораторией «Архимед».
5. Анкетирование № 2 (Приложении 8)
Ход занятия
Каждый опыт проводится сначала с использованием индикатора (фенолфталеина) – опыт А, а затем с использованием возможностей цифровой лаборатории «Архимед» - опыт Б.
| Смысловые блоки | Основное содержание |
| 1. Мотивация учащихся | 1. Вопрос обеспечения пищей был одним из самых существенных для человека. С развитием техники возможности для увеличения количества производимой пищи постоянно возрастали. Продукты питания расходовались на удовлетворение спроса растущего населения и требовались во всё возрастающем количестве. Хотя основная проблема обеспечения пищей не перестала быть актуальной‚ содержание её изменилось. На сегодняшний день остро встал вопрос о качестве потребляемой нами пищи. Кто из Вас может с уверенностью сказать о том, что употребляет пищу, удовлетворяющую стандартам качества? |
| 2. Изучение нового материала | 2. В настоящее время существуют специальные организации, которые следят за качеством производимых продуктов питания. При этом все эти учреждения используют в своей работе различные методики проведения анализа. На сегодняшнем занятии мы с Вами возьмём на себя роль экспертов качества. В своей работе мы также рассмотрим различные способы выполнения анализа продуктов питания. Мы будем использовать для анализа молоко, творог, хлеб и муку. В нашей работе мы будем исследовать кислотность этих продуктов. Согласно исследованиям Т. Пауль, кислый вкус кислых жидких веществ зависит не от количества кислоты, а от концентрации водородных ионов. Концентрацию ионов водорода называют водородным показателем – рН. рН = - lg [Н+] Величина водородного показателя характеризует реакцию среды: кислую (рН < 7), нейтральную (рН = 7) и щелочную (рН > 7) Водородный показатель и реакция среды могут быть определены с помощью индикаторов (метилоранжа, фенолфталеина, лакмуса), а также, при этом точнее с помощью специальных приборов рН-метров. |
| Анализ качества пищевых продуктов. Анализ кислотности молока | - Молоко содержит в своем составе жиры (в виде эмульсии), белки – казеин, альбумин, глобулин (в виде коллоидного раствора), растворённые в воде азотистые небелковые вещества, соли и молочный сахар – лактозу (формулу на доске).
Процесс скисания молока связан с образованием молочной кислоты (С3Н6О3) в результате молочнокислого брожения, образующейся из лактозы, глюкозы.
Схема на доске:
Лактоза → гидролиз → глюкоза → брожение → молочная кислота
Реакция молочнокислого брожения глюкозы:
С6Н12О6 → 2 СН3 – СН (ОН) – СООН
Определение кислотности молока основано на методе кислотно-основного титрования.
Объяснить суть процесса кислотно-основного титрования (используя схему).
 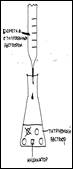  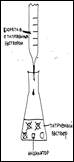 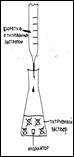 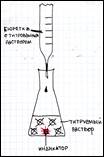 В процессе работы мы определяем какое количество гидроксида натрия пошло на полную нейтрализацию молочной кислоты и по формуле высчитываем кислотность.
В процессе работы мы определяем какое количество гидроксида натрия пошло на полную нейтрализацию молочной кислоты и по формуле высчитываем кислотность.
|
| Опыт №1. Определение кислотности молока. Форма работы: индивидуальная (в группах) | Оборудование и реактивы: молоко пастеризованное и не пастеризованное, 0,1 М раствор гидроксида натрия, бюретка, воронка, колбы для титрованиия, фенолфталеин, цифровая лаборатория «Архимед», насадка – рН-метр, мешалка. А) Ход опыта: В колбу для титрования наливают 10 мл молока, 20 мл дистиллированной воды, 5 капель 2% раствора фенолфталеина. Смесь хорошо перемешивают. Затем по каплям прибавляют 0,1 М раствор едкого натра, фиксируя при этом цвет индикатора (появление розоватой окраски). Б) Настройка параметров измерения «Архимеда»: 1) частота измерений – каждую секунду; 2) число замеров – 1000 Ход опыта: В колбу для титрования наливают 10 мл молока, 20 мл дистиллированной воды, 5 капель 2% раствора фенолфталеина. Смесь хорошо перемешивают при помощи магнитной мешалки. Затем опускают датчик рН и начинают по каплям из бюретки прибавлять 0,1 М раствор едкого натра, при включённой мешалке, до рН 8,2 (по показаниям прибора), фиксируя при этом цвет индикатора (появление розоватой окраски). Полученные данные занести в таблицу №1 .Опыт повторяют 3 раза. |
Таблица №1 - Кислотность молока
| Образец молока | Объём молока, мл | Объём, прилитого раствора NaOH, мл | Среднее значение объёма, прилитого раствора NaOH, мл | Кислотность молока, град |
| Пастеризованное молоко | ||||
| Пастеризованное молоко, образец 1 |
|
| ||
| Пастеризованное молоко, образец 2 | ||||
| Пастеризованное молоко, образец 3 | ||||
| Не пастеризованное молоко | ||||
| Не пастеризованное молоко, образец 1 |
|
| ||
| Не пастеризованное молоко, образец 2 | ||||
| Не пастеризованное молоко, образец 3 | ||||
Результаты измерений: вычислить кислотность пастеризованного и не пастеризованного молока в условных градусах Тёрнера по формуле:
Кислотность молока = V р ( NaOH ) · 10
Свежее молоко имеет 16-18 градусов кислотности по Тёрнеру. Предельная кислотность свежего молока 20 градусов.
Задание.
1. Сделать вывод о свежести использованного молока
2. Чем вызвана кислотность молока, какая кислота образуется при скисании молока? Напишите уравнения реакции образования этой кислоты и её нейтрализации гидроксидом натрия.
Кислоты как продукт кислотного брожения находятся в хлебе в довольно большом количестве. Их содержание колеблется естественно в зависимости от способов изготовления хлеба и особенно брожения теста. Особенно важны молочная и уксусная кислоты, есть следы муравьиной и масляной кислот.
Приготовленный на дрожжах после краткого и быстрого брожения разрыхленный пшеничный хлеб содержит то же количество кислоты, что и мука; оно соответствует количеству содержащихся в последней кислых фосфатов. В хлебе на закваске, особенно в кислом ржаном черном хлебе, кислотность возрастает в зависимости от продолжительности брожения.
Градусом кислотности называется то количество кислоты в 100 г хлебного мякиша, которое требует для своей нейтрализации 1см2 щелочи.
Таким образом, кислотность хлеба обусловлена наличием уксусной и молочной кислоты.
В процессе титрования мы определяем количество щёлочи, которое необходимо для нейтрализации кислот в хлебной вытяжке (процесс связан с изменением окраски индикатора) и по формуле рассчитываем кислотность хлеба.
Оборудование и реактивы: хлебобулочная продукция (хлеб Дарницкий, хлеб пшеничный из сортовой муки, батон, хлеб пшеничный, приготовленном на жидких дрожжах, хлеб пшеничный обойный, хлеб ржаной из сеяной муки), 0,1 М раствор гидроксида натрия, бюретка, воронка, колбы для титрованиия, фенолфталеин, цифровая лаборатория «Архимед», насадка – рН-метр, мешалка.
Ход опыта:
Подготовка к анализу. Образцы разрезают пополам по ширине и от одной половины отрезают кусок (ломоть) массой около 70 г, у которого срезают корки и подкорочный слой общей толщиной 1 см. Для изделий массой менее 200 г берут целые булки, с которых срезают корки слоем приблизительно 1 см. Из кусков приготовленных изделий удаляют все включения (повидло, варенье,, изюм и т.п.), затем их быстро измельчают и перемешивают.
25 г измельченного мякиша отвешивают с погрешностью до 0,05 г. Навеску помещают в сухую бутылку (типа молочной) вместимостью 500 см3, с хорошо пригнанной пробкой. Мерную колбу вместимостью 250 см3 наполняют до метки дистиллированной водой, подогретой до температуры 60 °С. Около 1/4 взятой дистиллированной воды переливают в бутылку с хлебом, который после этого быстро растирают деревянной лопаточкой до получения однородной массы, без заметных комочков нерастертого хлеба.
К полученной смеси прибавляют из мерной колбы всю оставшуюся дистиллированную воду. Бутылку закрывают пробкой и энергично встряхивают в течение 3 мин. После встряхивания дают смеси отстояться в течение 1 мин и отстоявшийся жидкий слой осторожно сливают в сухой стакан через чистое сито или марлю.
А) Ход опыта: Из стакана отбирают пипеткой по 50 см3 раствора в три конические колбы вместимостью по 100-150 см3 каждая. Затем начинают по каплям из бюретки прибавлять 0,1 М раствор едкого натра, фиксируя при этом цвет индикатора (появление розоватой окраски).
Б) Настройка параметров измерения:
1) частота измерений – каждую секунду;
2) число замеров – 1000
Ход опыта: Из стакана отбирают пипеткой по 50 см3 раствора в три конические колбы вместимостью по 100-150 см3 каждая. Затем опускают датчик рН и начинают по каплям из бюретки прибавлять 0,1 М раствор едкого натра, при включённой мешалке, до рН 8,2 (по показаниям прибора), фиксируя при этом цвет индикатора (появление розоватой окраски). Полученные данные занести в таблицу №2. Опыт повторяют 3 раза.
Таблица № 2 - Кислотность хлеба
| Образец хлеба | Объём хлебной вытяжки, мл | Объём, прилитого раствора NaOH, мл | Среднее значение объёма, прилитого раствора NaOH, мл | Кислотность хлеба, град |
| Хлеб пшеничный | ||||
| Образец 1 |
|
| ||
| Образец 2 | ||||
| Образец 3 | ||||
| Хлеб ржаной | ||||
| Образец 1 |
|
| ||
| Образец 2 | ||||
| Образец 3 | ||||
Результаты измерений: вычислить кислотность образцов хлеба по формуле:
Кислотность хлеба = 25·50·4·V/(250·10),
где V – объем 0,1 моль/дм3 раствора гидроксида натрия, см3; 1/10 – приведение 0,1 моль/дм3 раствора гидроксида натрия или гидроксида калия к 1 моль/дм3; 4 – коэффициент, приводящий к 100 г навески; 25 – масса навески испытуемого продукта, г; 250 – объем воды, взятый для извлечения кислот, см3; 50 – объем испытуемого раствора, взятый для титрования, см3.
Задание.
1. Сделать вывод о соответствии кислотности использованного образца хлебобулочной продукции, если известно, что кислотность:
· Хлеба пшеничного из сортовой муки – не более 2 - 4°
· Хлеба пшеничного, приготовленного на жидких дрожжах – 3-5°,
· Хлеба пшеничного обойного – не более 7°,
· Хлеба ржаного из обойной муки – не более 12°,
· Хлеба ржаного из обдирной муки – 11°,
· Хлеба ржаного из сеяной муки – 7°.
2. Чем вызвана кислотность хлеба.
Виды муки:
1. обойная (цельнозерновая) мука - мука грубого помола. Обойная мука содержит большое количество оболочек, поэтому она имеет цвет с сероватым или коричневым оттенком. Размер частиц неоднородный
Хлеб из цельнозерновой муки по праву назван лечебным продуктом против ожирения, сахарного диабета, атеросклероза, пониженной моторики кишечника. Зерновой хлеб эффективно удаляет вредные вещества из организма - соли тяжелых металлов, радиоактивных вещества, ядовитые компоненты, остатки продуктов биологического происхождения, увеличивает продолжительность жизни.
Ученым США удалось доказать, что смертность людей, потребляющих продукты из цельного зерна, снижается на 15-20%. В большинстве западных странах Комитеты Национального Питания рекомендуют взрослым прием 25-35 г диетического пищевого волокна. Съедая один кусочек цельнозернового хлеба, вы получаете 5г клетчатки. Ежедневно включая в свой рацион хлеб из цельнозерновой муки, вы полностью удовлетворяете потребность организма в клетчатке и пищевых волокнах.
2. обдирная мука – состоит в основном из наружных частей зерна. Обдирную муку получают грубым помолом; она содержит больше оболочек, цвет ее белый с серым оттенком, частицы отрубей хорошо заметны.
3. Сеяная мука – состоит в основном из эндосперма зерна с включением 1.2% периферийных его частей, самая полезная, ценная по содержанию белков, углеводов, незаменимых аминокислот, витаминов, минеральных веществ.
Мука высшего сорта вырабатывается из центральных слоев эндосперма; размер ее частиц однородный до 0,05 мм, цвет белый с кремовым оттенком.
Муку 1-го сорта получают из внутренних слоев эндосперма, цвет ее белый с желтоватым оттенком. Размер частиц - до 0,1 мм.
Мука 2-го сорта имеет более грубый помол; цвет белый с сероватым оттенком, частицы более крупные - 0,03-0,20 мм.
Кислотность свежей муки зависит от ее сорта и вида. Она обусловлена содержанием белков (продуктов гидролиза белков), продуктов гидролитического расщепления жира муки (жирных кислот) минеральных кислых фосфорсодержащих веществ (дигидрофосфатов) и органических кислот (молочной, уксусной, щавелевой и др.).
В нормальных условиях кислотность муки достигает 2,5—5,5 °Т. В процессе хранения кислотность муки увеличивается. Это связано главным образом с расщеплением жира муки под влиянием тканевых и микробных ферментов до свободных жирных кислот, с образованием окси- и кетокислот. Так как поверхностные слои зерна характеризуются большим содержанием жира, то
· мука грубого помола имеет более высокую кислотность,
· мука высших сортов – кислотность ниже, чем у муки грубого помола.
· мука низких сортов имеет большую кислотность (т.к. больше жира, фосфора и ферментов)
· мука высших сортов ниже, а потому
· кислотность ее больше, чем муки высших сортов.
Повышение кислотности муки расценивается как признак изменения ее свежести. Нарастание титруемой кислотности муки особенно интенсивно происходит в первые 15—20 дней после помола. При дальнейшем хранении муки кислотность ее возрастает незначительно и очень медленно. Такая мука хранению не подлежит и должна быть срочно реализована.
Анализ качества муки также проводится в специализированных лабораториях качества пищевых продуктов и сырья. Затем проводится анализ соответствия ГОСТам и только после этого делается заключение о качестве этого сырья.
Мукомольная промышленность нашей страны выпускает пять сортовпшеничной муки и три сорта ржаной хлебопекарной муки.
Крупчатка – 10% Сеяная – 63%
Высший сорт – 30% Обдирная – 87%
Первый сорт – 72% Обойная – 95%
Второй сорт – 85%
Обойная – 96%
Оборудование и реактивы: разные сорта (1, 2, 3) и/или виды (пшеничная, ржаная, кукурузная) муки, 0,1 М раствор гидроксида натрия, бюретка, воронка, колбы для титрованиия, фенолфталеин, цифровая лаборатория «Архимед», насадка – рН-метр, мешалка.
А) Ход опыта: В колбу для титрования помещают 5 г муки, затем прибавляют 40 мл воды, 5-6 капель фенолфталеина. Затем начинают приливать (по каплям) 0,1 М раствор едкого натра до появления розового окрашивания.
Б) Настройка параметров измерения:
1) частота измерений – каждую секунду;
2) число замеров – 1000
Ход опыта : В колбу для титрования помещают 5 г муки, затем прибавляют 40 мл воды, 5-6 капель фенолфталеина. Затем опускают датчик рН, начинают регистрацию данных и приливание (по каплям) 0,1 М раствор едкого натра при включённой мешалки до рН 8,2. Опыт повторяют 3 раза. Полученные данные занести в таблицу №3.
Таблица № 3 - Кислотность муки
| Образец муки | Масса муки в образце, г | Объём, прилитого раствора NaOH, мл | Среднее значение объёма, прилитого раствора NaOH, мл | Кислотность муки, град |
| Мука пшеничная | ||||
| Образец 1 |
|
| ||
| Образец 2 | ||||
| Образец 3 | ||||
| Мука ржаная | ||||
| Образец 1 |
|
| ||
| Образец 2 | ||||
| Образец 3 | ||||
| Мука кукурузная | ||||
| Образец 1 |
|
| ||
| Образец 2 | ||||
| Образец 3 | ||||
Результаты измерений: вычислить кислотность образцов муки по формуле:
Кислотность муки = V ( NaOH ) · 20 / 10
Задание:
Сделать вывод о различии в кислотности муки разного вида (пшеничной, ржаной, кукурузной)
Кислотность творога, прежде всего, свидетельствует о принадлежности к тому или иному сорту.
Так известно, что (запись на доске):
· Высший сорт творога имеет кислотность не более 200
· 1-й творога имеет кислотность не более 220,
· 2-й сорт творога имеет кислотность не выше 240 градусов.
Оборудование и реактивы: разные виды творога, 0,1 М раствор гидроксида натрия, бюретка, воронка, колбы для титрованиия, фенолфталеин, цифровая лаборатория «Архимед», насадка – рН-метр, мешалка.
А) Ход опыта: В колбу для титрования помещают 10 г творога (очистить от изюма и др. включений) и небольшими порциями приливают 20 мл воды, нагретой до 30-40 0С. Творог тщательно перемешивают стеклянной палочкой. Прибавляют 5 капель спиртового раствора фенолфталеина. Начинают титрование 0,1 М раствором едкого натра до появления розовой окраски.
Б) Настройка параметров измерения:
1) частота измерений – каждую секунду;
2) число замеров – 1000
Ход опыта : В колбу для титрования помещают 10 г творога (очистить от изюма и др. включений) и небольшими порциями приливают 20 мл воды, нагретой до 30-40 0С. Творог тщательно перемешивают стеклянной палочкой. Прибавляют 5 капель спиртового раствора фенолфталеина. Помещают в раствор датчик рН, начинают регистрацию данных, одновременно прибавляя 0,1 н. раствор гидроксида натрия до рН 8,2 (появления розовой окраски). Опыт повторяют 3 раза.
Полученные данные занести в таблицу №4.
Таблица № 4. Кислотность творога
| Образец творога | Масса творога в образце, г | Объём, прилитого раствора NaOH, мл | Среднее значение объёма, прилитого раствора NaOH, мл | Кислотность творога, град |
| Образец творога 1 | ||||
| 1 | ||||
| 2 | ||||
| 3 | ||||
| Образец творога 2 | ||||
| 1 | ||||
| 2 | ||||
| 3 | ||||
Результаты измерений: вычислить кислотность образцов творога по формуле:
Кислотность творога = V ( NaOH ) · 20
Задание.
1. Сделать вывод о принадлежности исследованного творога к определённому сорту, по записи, приведённой выше
o Какой метод мы использовали для определения качества продуктов питания? (Метод кислотно-основного титрования)
Дата: 2019-07-24, просмотров: 397.