Закон сохранения энергии устанавливает, что энергия не создается и не уничтожается и что одна форма энергии может переходить в другую. Превращение энергии из одного вида в другой происходит в строго определенных соотношениях, которые постоянны. Например, тепловвая энергия может превращаться в механическую (в виде совершения работы) и наоборот, работу в теплоту, причем, определенное количество тепла эквивалентно определенному количеству работы. Если тепло измеряется в тепловых единицах (ккал), а работа – в механических (кгдм), то константа указанного отношения Е ( 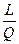 = Е или L = E Q) носит название механического эквивалента тепла Е = 4264,5 ≈ 4270 кгдм/ккал.
= Е или L = E Q) носит название механического эквивалента тепла Е = 4264,5 ≈ 4270 кгдм/ккал.
Величина, обратная Е называется тепловым эквивалентом работы.
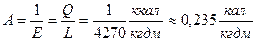
Первый закон термодинамики
Первый закон термодинамики гласит: при подводе к газу тепла одна часть его расходуется на увеличение внутренней энергии газа, а другая на совершение газом внешней работы, что выражается следующей формулой:
Q = Δu + Aℓ (2.19.)
Или для равновесных процессов
dq = du + Apdw
Применительно к идеальным газам
dq = СwdT + Apdw (2.20.)
Для изобарного процесса dq = СрdT. Подставим это выражение в уравнение (2.20.) и используя уравнение состояния для идеального газа, окончательно получим формулу Майера
Ср = Сw + AR
Энтальпия газа
Формулу (2.20.) можно представить в виде
dq = du + Apdw = du + Ad(pw) – Awdp = di – Awdp
где: i = u + Apw – энтальпия газа.
Энтальпия газа, как и внутренняя энергия не зависит от характера процесса.
Для изобарного процесса dq = du или СрdT = du (2.21)
Для адиабатического процесса – процесса без подвода или отвода тепла (dq = 0) имеем dq = СwdT + Apdw = 0.
Из уравнения состояния 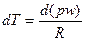 , подставив в предыдущее уравнение получим
, подставив в предыдущее уравнение получим
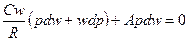
Используя формулу Майера окончательно получим 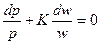 или
или
р·wк = const (2.22.)
В случае газа Дюпре
р·(w – в)к = const (2.23.)
Политропический процесс
Реальные термодинамические процессы настолько сложны, и иногда практически невозможно составить уравнение, чтобы учесть, например, диссоциации, рекомбинацию молекул, теплоотдачу и т.д. Поэтому в расчетах такие процессы заменяют фиктивным или политропическим процессом, который имеет вид р·wn = const
где n – показатель политропы. В зависимости от показателя политропы мы можем получить:
адиабатический процесс, когда n = к;
изобарный процесс, когда n = 0;
изохорный процесс, когда n = ± ∞;
изотермический процесс, когда n = 1;
Таким образом, реальный процесс с достаточной точностью можно аппроксимировать политропическим процессом, меняя значения n по участкам, на которые разбит реальный процесс. Политропному процессу, как и всякому из перечисленных выше процессу соответствует своя теплоемкость C, которая имеет вид
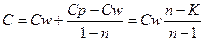 (2.24.)
(2.24.)
Дата: 2019-07-24, просмотров: 348.