| Период беременности | Потребность в основных пищевых веществах | Белки, г | Белки естественных продуктов, г | Жиры, г | Углеводы, г | Калории, ккал |
| I триместр | На кг массы | 1-1,6 | 0,11-0,13 | 1,5 | 6,5-7 | 40-50 |
| Среднесуточная потребность | 70-80 | 6,6-9,2 | 90-100 | 400 | 2400-3500 | |
| II триместр | На кг массы | 1,2-1,7 | 0,15-0,2 | 1,6 | 7-7,5 | 45-55 |
| Суточная потребность | 80 | 9-14 | 96-110 | 420-520 | 2700-3800 | |
| III триместр | На кг массы | 1,2-1,9 | 0,25-0,33 | 1,6 | 7-7,5 | 45-55 |
| Суточная потребность | 85 | 15-20 | 96-110 | 420-520 | 2700-3800 |
После родов потребность матери в ФА снижается по сравнению с увеличенными анаболическими требованиями в третьем триместре, поэтому для профилактики негативных послеродовых состояний следует продолжать тщательный метаболический и пищевой мониторинг. Использование лечебных продуктов может обеспечить энергетические и белковые потребности, необходимые для поддержки грудного вскармливания. Противопоказаний к грудному вскармливанию у женщин с ФКУ нет, так как младенцы, не имеющие недостаточности ФАГ, способны самостоятельно метаболизироватьфенилаланин, содержащийся в грудном молоке матери.
Дети женщин с ФКУ сразу после рождения должны пройти полное неврологическое обследование и исследование Эхо-КГ, в возрасте 1, 4, 8 и 14 лет - обследование невролога и психолога, включающее определение интеллектуального уровня.
Таким образом, правильно построенная тактика ведения беременности у пациенток с фенилкетонурией поможет добиться хорошего исхода беременности и улучшения качества жизни будущего ребенка.
РИБОЗИМЫ И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ
А.К. Узакова, 2 курс
Научный руководитель –к. б. н., доц. Л.В.Гирина
Кафедра биологической химии
Оренбургский государственный медицинский университет
RIBOZYMESANDTHEIRUSEINMEDICINE.
A.K Uzakova, 2 course
Supervisor – Candidate of Biological Sciences, Assistant Professor L.V. Girina
Department of Biochemistry
The Orenburg State Medical University
В 1981 г. группой американских биохимиков во главе с Томасом Чехом было обнаружено, что в природе имеются виды РНК, которые, подобно белкам, обладают высокоспецифической каталитической активностью. Их субстратсвязывающий домен присоединяется к комплементарному участку РНК-мишени с помощью водородных и других связей, а каталитический участок расщепляет ее в специфическом сайте. Такие РНК-катализаторы были названы рибозимами (сокращение от «рибонуклеиновая кислота» и «энзим»), также называемые ферментативными РНК.
Ключевые слова: рибозимы, РНК, субстрастсвязывающий домен.
In 1981, a group of American biochemists, led by Thomas Czech, found that in nature there are types of RNA, which, like proteins, have a highly catalytic activity. Their substrate binding domain joins the complementary portion of the RNA target using hydrogen and other bonds, and the catalytic portion splits it into a specific site. Such RNA catalysts have been called ribozymes (short for "ribonucleic acid" and "enzyme"), also called enzymatic RNAS.
Key words: ribozymes, RNA substrate binding domain.
Целью данной работы явилось определение значимости рибозимов в организме человека и возможность применения их в медицине. Для достижения поставленной цели необходимо решить следующие задачи: определить механизм действия рибозимов, выявить их эффективность в борьбе с вирусными инфекциями, онкологическими заболеваниями и определить причины невозможности повсеместного использования рибозимов в медицинской практике.
Многие рибозимы естественного происхождения катализируют расщепление самих себя или других молекул РНК, кроме того образование пептидной связи в белках происходит при помощи рРНК рибосомы. В рамках исследований, посвященных происхождению жизни, удалось создать искусственные рибозимы типа РНК-полимеразы, способные при определенных условиях катализировать свою собственную сборку. Лабораторные образцы, однако, показали невысокую каталитическую способность: они успевают собрать в цепочку не более 14 нуклеотидов за 24 часа, по истечении которых они разлагаются за счет гидролиза фосфодиэфирных связей.
Несмотря на то, что большинство рибозимов достаточно редко встречаются в клетках, иногда они очень важны для их существования. Например, активная часть рибосомы — молекулярной машины, осуществляющей трансляцию белков из РНК — является рибозимом.
В качестве кофакторов некоторые рибозимы часто содержат двухвалентные ионы металлов, например, Mg2+.
То обстоятельство, что РНК может содержать наследственную информацию, позволило Уолтеру Гилберту выдвинуть предположение, что в древности РНК использовалась как в качестве генетического материала, так и в качестве катализаторов и структурных компонентов клетки, а впоследствии эти роли были перераспределены между ДНК и белками. Эта гипотеза сейчас известна как Гипотеза мира РНК.
На основании результатов рассмотренных опытов, а также других накопленных знаний о рибозимах складывалось мнение о принципиальной возможности использования рибозимов для регуляции активности конкретных генов человека. Область применения рибозимов как лекарственных средств может быть весьма широкой. В качестве возможных сфер их использования в клиниках в настоящее время рассматривают лечение вирусных инфекций, онкологических заболеваний, для которых известны продукты онкогенов, а также патологических состояний организма, вызываемых сверхэкспрессией конкретных генов.
Подобно антисмысловой технологии, рибозимы могут применятся при лечении вируснх инфекций. Можно синтезировать рибозимы, способные атаковать мРНК, транскрибируемую с вирусного генома. В культуре клеток было продемонстрировано действие рибозимов на мРНК вируса гепатита В после того, как плазмиды с генами, кодирующими специфические рибозимы, были введены в инфицированные клетки.
Этот механизм действия был реализован в новых лекарственных средствах для лечения больных с хроническими вирусными гепатитами С и В, которые находятся на этапе испытаний: хеберон, аллоферон, фосфоглив, VX-497, ингибиторы протеаз, кодируемые NS3, NS5 HCV; рекомбинантные рибозимы, катализирующие процессы расщепления РНК HCV, адефавир. Подобные системы эффективны в случае вируса простого герпеса
Большие усилия предпринимаются для использования рибозимов в лечении СПИДа, вызываемого вирусами иммунодефицита человека (ВИЧ). Уже в 1990 г. Н. Сарвер и соавторы продемонстрировали возможность расщепления геномной ВИЧ-РНК с помощью рибозимаin vitro в бесклеточной системе, что сопровождалось снижением уровня р24-антигена на 98%. Длительные эксперименты на культурах клеток показали, что клетки, экспрессирующие такие рибозимы, не изменяли своего обычного фенотипа на протяжении, по крайней мере, 9 месяцев. Одновременно с этим было показано, что клетки линии MT4, стабильно трансфецированные вектором, экспрессирующимрибозим под контролем промотора гена тимидинкиназы вируса простого герпеса, были частично устойчивы к ВИЧ-инфекции. Полностью устойчивыми к заражению ВИЧ оказались клетки, содержащие рибозим под контролем вирусного регуляторного элемента tar, в которых вирус не обнаруживали даже через 22 дня после заражения. В этих клетках высокий уровень индукции синтеза рибозима происходит как раз во время ВИЧ-инфекции. Та же самая стратегия была применена и к рибозимам, образующим структуру типа шпильки. Экспрессия гена рибозима под контролем промотора гена b-актина подавляла ВИЧ-инфекцию в культивируемых клетках. При этом продукты расщепления ВИЧ-РНК в таких клетках специфически и быстро деградировали.
Еще одним подходом к преодолению ВИЧ-инфекции является отщепление 5’-концевой кэп-структуры ВИЧ-РНК с помощью рибозимов. Известно, что у большинства изолятов ВИЧ 5’-концевая лидерная последовательность их геномной РНК высококонсервативна. Из всех известных изолятов только штамм MN содержит замену одного нуклеотида в лидерной области РНК, расщепляемой рибозимом. Эндонуклеазное удаление в составе олигонуклеотида 5’-концевой кэп-группы РНК ВИЧ подавляет трансляцию РНК и делает ее более доступной мишенью для внутриклеточных нуклеаз. Все имеющиеся экспериментальные данные позволяют сегодня сделать вывод о перспективности использования 5’-концевой лидерной последовательности ВИЧ-РНК в качестве мишени для рибозимов.
Основной сложностью, которую приходится преодолевать при конструировании рибозимов, расщепляющих геномную ВИЧ-РНК, является высокая мутабильность этих РНК. Из-за мутационных замен отдельных нуклеотидов в сайтах, по которым происходит расщепление РНК рибозимами, последние утрачивают свою активность по отношению к этим РНК и соответственно противовирусную активность. Новейшая стратегия в решении данной проблемы заключается в создании нескольких рибозимов, действие которых направлено против разных консервативных участков генома ВИЧ, причем отдельные рибозимы должны входить в одну молекулу рекомбинантной РНК ("метод дробовика"). Этот метод не позволяет вирусу ВИЧ избежать инактивирующего действия рибозимов путем мутационных преобразований своего генома.
Другая потенциальная область применения рибозимов — лечение рака. Класс белков, обеспечивающий устойчивость раковых клеток к лекарственным препаратам, называют АВС-транспортерами. Внедрение рибозимов, которые специфически нацелены на разрушение мРНК, кодирующую ABC-белки, восстанавливает чувствительность раковых клеток к лекарственным препаратам. Проверка данного метода была осуществлена на раковых клетках печени, которые обладают высокой устойчивостью к лекарственным препаратам. В культуру раковых клеток печени были введены гены, кодирующие рибозимы. В этих клетках наблюдалась пониженная экспрессия генов, ответственных за синтез ABC-белков, и возрастала чувствительность к препарату химиотерапии — эпирубуцину. Сходные результаты были получены для белка, способствующего устойчивости клеток к медикаментам при раке молочной железы. Конечно, существует огромная разница между клетками в культуре и лечением раковых больных.
Теломеры защищают концы хромосом от разрушения клеточными ферментами. Обычно длина теломер уменьшается при удваивании хромосом. Этот процесс, как полагают, связан со старением и смертью клетки. В раковых клетках фермент, называемый теломеразой, добавляет последовательности к теломерам, делая клетки бессмертными. Были изолированы рибозимы, ингибирующие активность теломеразы в раковых клетках. Рибозимы также можно использовать против белка раковых клеток сюрвивана (survivan), который ингибирует апоптозные белки, вызывающие гибель обычных клеток в определенных условиях.
Основные препятствия для терапевтического применения рибозимов — их низкая скорость поступления в клетку и трудности в доставке к определенному сайту. Эти ограничения создают опасения относительно доставки рибозимов к опухолевым клеткам, а также возможных побочных эффектов. Поэтому рибозимы стали разочарованием в плане медицинского применения. Например, FDA недавно не дало разрешения на применение разработанного компаниями Genta (Беркли Хайте, Нью Джерси, США) и Aventis (Страсбург, Франция) препарата Genasense, основанного на применении анти-смысловой технологии и предназначенного для лечения злокачественной меланомы, на основании сомнительных результатов клинических испытаний.
Таким образом, была установлена колоссальная значимость рибозиомов в борьбе с такими заболеваниями, которые в данный момент тяжело поддаются лечению или не излечиваются вовсе. Однако также было выявлено, что имеются некоторые сложности в применении лекарственных препаратов, содержащих рибозимы. Тем не менее есть несколько многообещающих методов лечения с их помощью, находящихся в данный момент на стадии клинических испытаний. Например, ведутся разработки по применению рибозима со структурой типа «головки молотка» в отношении рецептора эндотелиального фактора роста при метастатических злокачественных новообразованиях толстого кишечника, а также рибозима против человеческого эпидермального фактора роста 2. Это, конечно же, дает большие надежды на возможность использования рибозимов для излечивания тяжелых заболеваний у больных в будущем.
ЦИНКЗАВИСИМЫЕ ФЕРМЕНТЫ
Д.С. Фоменко,М.В. Шамакина, 2 курс
Научный руководитель - асс. Е.И. Глушихина
Кафедрабиологическойхимии
Оренбургский государственный медицинский университет
ZINC DEPENDENT ENZYMES
D . S . Fomenko , M . V . Shamakina ,, 2 course
Supervisor – a ss . E.I. Glushihina
Department of Biochemistry
The Orenburg State Medical University
Аннотация. В данной статье рассматривается роль цинка в энзимологии организма. Представленыферменты, всоставкоторыхвходит цинк или является их активатором или ингибитором.
Ключевые слова: цинк, цинкзависимые ферменты, эссенциальный микроэлемент, алкогольдегидрогеназа, карбонатдегидратаза, автофосфорилирование.
Abstract. This article discusses the role of zinc in the enzymology of the organism. Presents enzymes, which include zinc or is their activator or inhibitor.
Keywords: zinc, zinc-dependent enzymes, essential trace element, alcohol dehydrogenase, carbonate dehydratase, autotransferase.
Цинк является одним из основных эссенциальных микроэлементов в организме человека и вторым элементом по распространенности после железа.
Биологическая роль цинка была установлена около 150 лет назад благодаря изучениям Е.Ундервуда (1971) недостатка цинка на животных.
Состояния человека, вызванные недостатком цинка, были впервые распознаны как синдром гипогонадизма и карликовости у молодых иранцев – болезнь Прасада (А.С. Прасад, 1961).
В сутки организм взрослого здорового человека должен получать от 9 до 11 мг цинка, дети – чуть меньше, от 2 до 8 мг, в период беременности и кормления грудью потребность в Zn возрастает – от 11 до 13 мг.
В настоящее время цинк обнаружен во всех тканях и органах, однако его количество находится в широких пределах: от 0,15 до 3,3 ммоль на 1 кг сырой ткани (Р.И. Хэнкин, 1971). Скелетные мышцы наиболее богаты цинком, на их долю приходится 63% от всего количества этого микроэлемента (Г.А. Шрэдер, 1967).
По последним данным цинк является компонентом более чем 2700 ферментов в организме, включая гидролазы, трансферазы, оксидоредуктазы, лигазы, изомеразы и лиазы.
В качестве примера можно привести фермент алькогольдегидрогеназу, которая участвует в окислении спиртов (Рис.1).
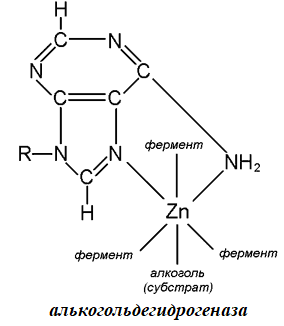
Рис.1. Алкогольдегидрогеназа
Большое значение имеет карбонатдегидратаза (карбонатдегидратаза, карбонатгидролиаза). Этот фермент участвует в процессах безопасной транспортировки углекислого газа в организме. Благодаря наличию этого фермента в эритроцитах происходит быстрая утилизация углекислого газа (Рис.2).
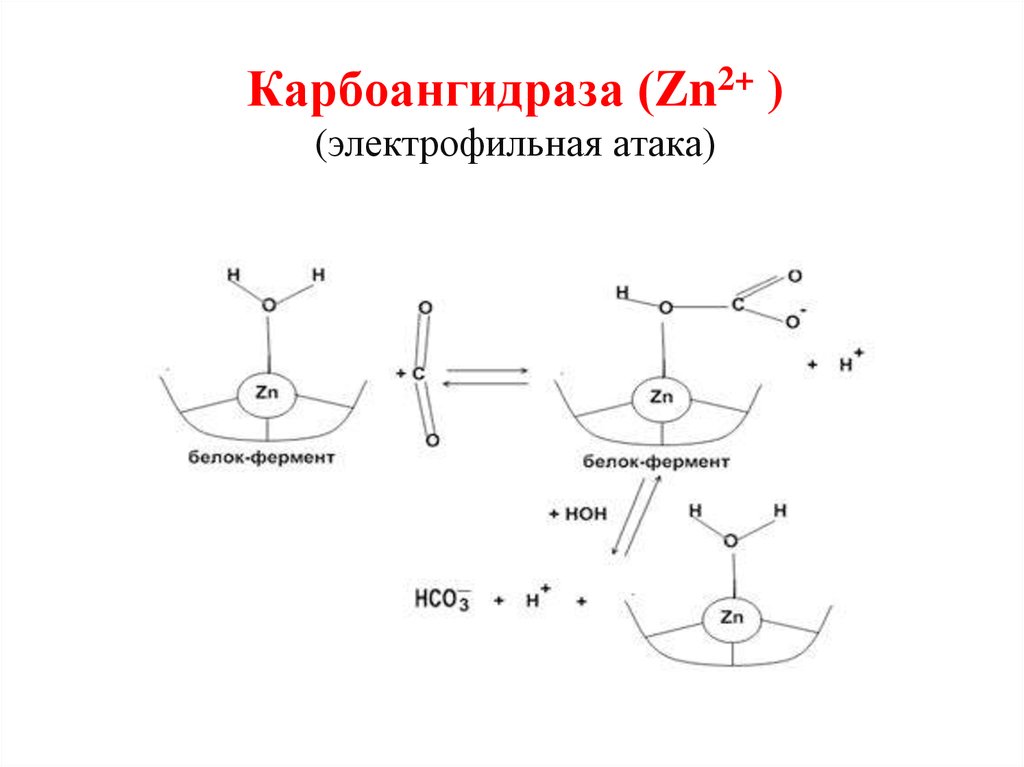
Рис.2. Карбоангидраза (электрофильная атака)
Цинк входит также в состав различных фосфатаз, дегидрогеназ и участвует таким образом в процессах клеточного дыхания. Его присутствие в таких ферментах, как протеиназы и пептидазы, обуславливает влияние элемента на синтез РНК, ДНК, метаболизм белковых веществ. Также он необходим для всех процессов, связанных с усиленным клеточным делением (рост, заживление ран, сперматогенез), активно участвует в метаболизме нуклеиновых кислот и синтезе белков: входит в состав ДНК- и РНК-полимеразы, тимидинкиназы – фермента, катализирующего синтез ТМФ из АТФ, оказывает ингибирующее действие на рибонуклеазу, НАДФ-оксидазу, снижает активность АТФ-азы в макрофагах, индуцирует биохимические реакции, действуя сам как фермент, расщепляя фосфодиэстеразные мостики РНК, стабилизируя структуру ДНК. Он необходим для всех фаз клеточного цикла. Микроэлементу цинку отводят важную роль в структуре и функции биомембран. Он обладает стабилизирующим действием на мембраны эритроцитов, снижает их хрупкость, уменьшая оксидантные повреждения эритроцитов.
Кроме того, цинк играет важную роль в работе инсулина, т.к. биосинтез и его хранение регулируется ионами цинка и кальция.
Также цинк оказывает влияние на иммунную систему и включает вирус-рецепторные взаимодействия, активацию разных видов лимфоцитов, уменьшение апоптоза и корректировку секреции цитокинов.
Сражение иммунной системы с вирусными инфекциями требует иммунокомпетентных активных Т-лимфоцитов, число и активность которых в значительной степени зависит от уровня цинка. Среди иммунных клеток, страдающих от недостатка цинка, Т-лимфоциты имеют наиболее высокую чувствительность. На молекулярном уровне цинк стимулирует автофосфорилирование белка тирозинкиназыLck через взаимодействия с цитоплазматическими петлями CD4 и CD8, что приводит к активации Т-клеток, которые затем атакуют вирусные частицы.
Роль цинка в организме неоценима. Недостаток данного микроэлемента ведет к ферментативной недостаточности, что вызывает нарушение ферментативных процессов. Важнейшим метаболическимнарушением вследствие недостатка цинка и соответственно цинкосодержащих энзимов, является нарушение обмена белков и нуклеиновых кислот, что приводит к быстрой гибели организма.
ТЕЛОМЕРНАЯ ТЕОРИЯ СТАРЕНИЯ
Е.В. Хайбулина, 2 курс
Научный руководитель - асс. Н.В.Зобкова
Кафедра биологической химии
Оренбургский государственный медицинский университет
TELOMERTHEORYOFAGING
E . V . Haibulina ,2 course
Scientificadvisor – ass . N.V.Zobkova
Department of Biochemistry
The Orenburg State Medical University
Старение есть одно из основных свойств всех живых организмов. При всей спорности вопроса о сущности этого процесса в конечном итоге он проявляется определенными изменениями функциональных способностей как отдельных клеток, так и организма в целом. Остается вопрос, обусловлены ли возникающие в отдельных клетках и органах изменения старением самих клеток и органов, или же они являются следствием общего процесса старения всего организма.
Ключевые слова: теломеры, теломераза, теломерная теория старение, репликация
Aging is one of the basic properties of all living organisms. With all the controversial issues about the nature of this process, in the end, it is manifested by certain changes in the functional abilities of both individual cells and the organism as a whole. The question remains whether the aging of the cells and organs themselves causes the changes occurring in individual cells and organs, or they are a consequence of the general aging process of the whole organism.
Key words: telomeres, telomerase, telomer theory of aging, replication
Механизмы старения организма являются многообразными и сложными для понимания. На данный момент существует множествопротивоположных теорий, которые отчасти оспаривают друг другу, а отчасти – дополняют. Проблема старения находится под бдительным вниманием современной биологии, появляются новые факты, позволяющие понять различные аспекты старения глубже.
Одну из теорий представил выдающийся российский ученый Алексей Оловников в 1971 г. В 1961 году американский геронтолог Л. Хейфлик установил, что «в пробирке» клетки кожи – фибробласты – могут делиться не более 50 раз. В 1971 г. научный сотрудник Института биохимической физики РАН А.М. Оловников предложил гипотезу, по которой «предел Хейфлика» объясняется тем, что при каждом клеточном делении укорачиваются теломеры – концевые участки хромосом. Поэтому после некоторого количества делений клетка больше делиться не может. А. Оловников сформулировал проблему концевой недорепликации линейных молекул ДНК, поскольку ДНК-полимераза не может реплицировать несколько нуклеотидов на 3'-конце матрицы ДНК. Он же высказал мысль о том, что должен существовать особый биологический механизм, предотвращающий этот эффект.
Открытие в 1985 г. фермента теломеразы, достраивающего укороченные теломеры в половых клетках и клетках опухолей, обеспечивая их бессмертие, стало блестящим подтверждением теории Оловникова. Правда, предел в 50-60 делений справедлив далеко не для всех клеток: раковые и стволовые клетки теоретически могут делиться бесконечно долго даже в культуре, в живом организме стволовые клетки могут делиться не десятки, а тысячи раз, но связь старения клеток с укорочением теломер является общепризнанной.
Теломеры обязательны для начала репликации (удвоения) ДНК: к ним прикрепляется РНК-затравка, с которой на каждой из нитей двойной спирали ДНК начинается синтез второй нити, комплементарной первой. После каждого деления клетки часть концевых нуклеотидов на каждой из вновь образованных хромосом безвозвратно теряется вместе с РНК-затравкой. Когда рано или поздно хромосома израсходует все нуклеотиды своих теломер, клетка не сможет делиться и через некоторое время погибает.
Предложено несколько гипотетических моделей, объясняющих, каким образом клетка «определяет» длину своих теломер и в определенный момент запускает механизм блока пролиферации. Возможно, определяется общее количество ТТАGGG повторов благодаря учету специфически связывающегося с ними белка. Другая модель исходит из того, что длинные теломеры молодых клеток представляют собой гетерохроматиновые блоки. Предполагается, что ген, супрессирующий программу клеточного старения, локализован в субтеломерном районе. По мере укорачивания теломер всё больше субтеломерной ДНК подвергается гетерохроматинизации. Гетерохроматинизация гена-супрессора приводит к его инактивации и запуску механизма клеточного старения. Обнаружено, что в соматических клетках, делящихся в организме, длина теломер со временем уменьшается. Укорочение теломер наблюдается также по мере старения фибробластов в культуре. Более того, оказалось, что длина теломер лучше предсказывает способность клетки к делению, чем возраст донора клеток. Предположительно, теломеры укорачиваются в результате того, что механизм, ответственный за удвоение ДНК в процессе клеточногоделения, делает характерную ошибку: в каждой новой копии ДНК элиминируется маленький участок каждой теломеры. Из этого следует, что теломеры могут быть теми часами, которые определяют в клетках потерю способности к пролиферации. Интересно, что длина теломер сохраняется или даже немного увеличивается в сперматозоидах и в трансформированных («бессмертных») клетках. Такое постоянство помогает объяснить, каким образом половые и злокачественные клетки не утрачивают способности к делению.
Серьезным подтверждением основополагающей роли укорочения теломер в старении человека служат исследования клеток людей, страдающих прогериями – очень редкими болезнями преждевременного старения. Здесь четко прослеживается корреляция между старением на молекулярном, клеточном и организменном уровнях. Известны всего несколько подобных заболеваний истинного преждевременного старения: синдром Хатчинсона-Гилфорда, синдром Вернера и атаксия-телеангиэктазия, иначе называемая синдромом Луи-Бар. Патогенез всех этих болезней разный, но во всех случаях теломеры в клетках таких больных оказались от рождения, либо в первые годы жизни, резко укороченными (в разной степени при разных формах прогерий), лимит Хейфлика – существенно ограниченным, и фенотипические проявления старения – атеросклеротические изменения сердца и сосудов, возрастные изменения в других органах, истончение и морщинистость кожи, пресбиопия, поседение и потеря волос и другие симптомы старения – развиваются у таких больных значительно раньше, чем у лиц, стареющих с нормальной скоростью. Таким образом, причинная связь естественного старения организмов с репликативным старением клеток в подобных случаях сомнений не вызывает.
Данные о механизмах ускоренного старения при прогериях представляются очень существенными для понимания механизмов естественного старения человека.
ЗНАЧИМОСТЬ ЭНЗИМОВ АНТИОКСИДАНТНОЙ ЗАЩИТЫ В МЕТАБОЛИЗМЕ ЭРИТРОЦИТОВ
А.С. Цындяйкина, 4 курс, Э.Э. Лалаев, 4 курс, Н.А. Щербенёв, 5 курс
Научный руководитель – к.м.н., ст. преподаватель Ананьев Р.В.
Кафедра спортивной медицины и лечебной физкультуры
Курский государственный медицинский университет
THE IMPORTANCE OF ANTIOXIDANT PROTECTION ENZYMES IN THE METABOLISM OF RED BLOOD CELLS
A. S. Chindyaiki, E. C., Lal, 4 course, N.. Scherbenev, 5 course
Supervisor-Candidate of Sciences in Medicine, senior lecturer R.V. Ananiev
Department of sports medicine and physical therapy
The Kursk State Medical University
Аннотация: эритроциты выполняют разнообразные функции. Они не только доставляют кислород к тканям и выводят углекислый газ, но и участвуют в создании мощной буферной системы крови, в тромбообразовании, в иммунных реакциях, в метаболизме гормонов, нейромедиаторов, аминокилот, липидов, переносе вирусов, токсинов, лекарственных веществ, обладают бактерицидной функцией. Всякая функция имеет под собой физиологическую основу, поэтому изучение метаболизма эритроцитов представляетогромный интерес.
Ключевые слова: эритроциты, ферменты. АФК, метаболизм, гликолиз, ФАЗ.
Annotation: red blood cells perform various functions. They not only deliver oxygen to the tissues and remove carbon dioxide, but also participate in the creation of a powerful blood buffer system, in thrombus formation, in immune reactions, in the metabolism of hormones, neurotransmitters, amino acids, lipids, transfer of viruses, toxins, drugs, have a bactericidal function. Every function has a physiological basis, so the study of the metabolism of red blood cells is of great interest.
Keywords: erythrocytes, enzymes, аctive oxygen, metabolism, glycolysis, AFP.
Для защиты от АФК и других радикалов все клетки содержат антиоксиданты. Последние являются восстановителями, которые легко реагируют с окисляющими веществами и вследствие этого защищают более важные молекулы от окисления. К биологическим антиоксидантам принадлежат витамины С и Ε, кофермент Q и некоторые каротиноиды. Образующийся при разрушении гема билирубин также служит защитой от окисления. Особенно важен глутатион, трипептидGlu-Cys-Gly, находящийся почти во всех клетках в высокой концентрации. Глутатион содержит нетипичную γ-связь между Glu и Cys. Восстановителем здесь является тиольная группа цистеинового остатка. Две молекулы восстановленной формы при окислении образуют дисульфид. Эритроциты также обладают системой (супероксид-дисмутаза, каталаза, GSH), способной инактивировать АФК и ликвидировать нанесенные ими повреждения. Для этого необходимы вещества, обеспечивающие поддержание в эритроцитах нормального обмена веществ. Метаболизм в эритроцитах в сущности ограничен анаэробным гликолизом и гексозомонофосфатным путем [ГМП (HMW)].
Целью нашей работы было изучение роли антиоксидантной системы в защите от негативных факторов в процессе выполнения своей основной функции – переносе кислорода и углекислого газа.
Анаэробный гликолиз является основным источником энергии и дает 2,3-дифосфоглицерат. Пентозофосфатный путь в норме составляет лишьнебольшую долю в катаболизме глюкозы. Из кислорода постоянно в небольших количествах образуются токсичные вещества - реактивные оксигенные радикалы (РОР), повреждающие липиды клеточной мембраны, молекулы ДНК, окисляющие белковые SH группы, инактивируют ферменты. Для их устранения существуют антиоксиданты и ферменты антирадикальной защиты (ФАЗ): супероксиддисмутаза, каталаза, пероксидаза. К антиоксидантам относятся витамины С и Е, кофермент Q, некоторые каротиноиды, билирубин, особенно важен глутатион. Система «РОР- ФАЗ» инициирует процесс оксигенации, обеспечивая образование молекулы О2 из разлагающейся здесь Н2О2. Она присоединяется к Fe2+ гема одной из субъединиц дезокси-Hb, вызывает конформационные изменения в остальных трёх субъединицах и облегчает взаимодействие их гемов с молекулой кислорода. В эритроцитах мембранная каталаза взаимодействует с Н2О2 бактерий, катализируя реакцию разложения Н2О2, происходит микровзрыв на мембране и плазмолиз обоих клеток. Функционирование системы РОР-ФАЗ необходимо на заключительных стадиях митоза всех клеток организма. Разделение в области перешейка сформировавшихся двух дочерних клеток совершается также за счёт реакции разложения собственной клеточной Н2О2 каталазой.
Многообразие функций говорит об огромном значении эритроцитов, нарушение их метаболизма сказывается на состоянии других клеток, и наоборот, состояние некоторых тканей влияет на кровь в целом и на эритроциты. Поэтому состояние ФАЗ эритроцитов можно считать диагностическим признаком при развитии каких-либо заболеваний.
ЭНЗИМОДИАГНОСТИКА
Оценка уровня активности аминотраНСфераз в крови детей, рожденных путем кесарева сечения
А.А. Абдурахманов, 4 курс
Научный руководитель – асс. А.И. Онощенко
Кафедра оперативной хирургии и топографической анатомии
Гродненский государственный медицинский университет, Беларусь
ASSESSMENTOFTHELEVELOFACTIVITYOFAMINOTRASPFERASESINTHEBLOODOFCHILDRENBORNBYTHECAESARIANSECTION
A .А. Abdurakhmanov , 4 course
Supervisor - ass . A.I. Onoshchenko
Department of Operative Surgery and Topographic Anatomy
TheGrodno State Medical University, Belarus
Несмотря на широкое распространение, кесарево сечение относят к разряду сложных операций с высокой частотой осложнений
Аннотация. Оценить уровень активности АлАТ и АсАТ в крови детей, рожденных путем кесарева сечения как одного из метаболических показателей постнатальной адаптации.
Методы. Проведено ретроспективное сравнительное исследование. Обследовали детей, рожденных путем кесарева сечения (n = 103). Комплексное обследование включало оценку ряда показателей: клинического, биохимического анализа крови.
Результаты. Среднее значение исследуемых показателей: АлАТ — 15,75±9,30; АсАт — 43,2±24,22. У 12% детей после кесарева сечения в раннем периоде адаптации отмечен повышенный уровень АсАт, что свидетельствует о нарушениях со стороны миокарда, и возможном развитии метаболической дезадаптации.
Заключение. Выявление нарушений метаболических процессов в раннем неонатальном периоде необходимо для своевременного начала коррекционной терапии с целью предотвращения развития заболеваний в более отдаленные периоды жизни ребенка.
Ключевые слова: новорожденные, кесарево сечение, ферменты, метаболизм, аминотрансферазы, адаптация.
Annotation. Despite widespread use, caesarean section is classified as a complex operation with a high incidence of complications. The purpose of the study: to evaluate the level of activity of AlAT and AsAT in the blood of children born by caesarean section as one of the metabolic parameters of postnatal adaptation.
Methods: a retrospective comparative study. Examined children born by caesarean section (n = 103). Comprehensive examination included an assessment of a number of indicators: clinical, biochemical analysis of blood. Results: The average value of the studied parameters: AlAT — 15.75 ± 9.30; AcAt — 43.2 ± 24.22. In 12% of children after cesarean section in the early period of adaptation, an increased level of AsAt was observed, which indicates violations of the myocardium and the possible development of metabolic maladjustment.
Conclusion: Detection of metabolic disturbances in the early neonatal period is necessary for the timely start of corrective therapy in order to prevent the development of diseases in more distant periods of a child's life.
Key words: newborns, cesarean section, enzymes, metabolism, aminotransferases, adaptation.
Возросший интерес неонатологов, педиатров, врачей смежных специальностей к проблемам детей, рожденных оперативным путем, связан прежде всего с исключением естественного биомеханизма родов и, следовательно, онтогенетически запрограммированных процессов адаптации к внеутробному существованию. В связи с этим следует учитывать, что постнатальная адаптация включает в себя перестройку метаболических процессов новорожденного, нарушение которых может вначале привести к дисфункции органов и систем, а в последующем — к развитию заболеваний.
Цель настоящего исследования: оценить уровень активности АлАТ и АсАТ в крови детей, рожденных путем кесарева сечения как одного из метаболических показателей постнатальной адаптации.
Методы: проведено ретроспективное сравнительное исследование. Обследовали детей, рожденных путем кесарева сечения (n = 103). Источник данных — стационарные карты новорожденных УЗ «Гродненский областной клинический перинатальный центр», г. Гродно, Беларусь. Комплексное обследование включало оценку ряда показателей: клинического, биохимического анализа крови. Критерии включения: доношенные дети, рожденные путем кесарева сечения. Критерии исключения: родовая травма, синдромальная патология, пороки развития органов и систем, инфекционные болезни, гемолитическая болезнь новорожденных.
Результаты.Одним из важнейших аспектов адаптации является адекватное течение метаболических процессов. Ферментный статус является объективным отражением изменений, происходящих во всем организме, в т. ч. при хроническом стрессе, к которому относятся плацентарные нарушения. Доказана высокая кардиоспецифичность креатинфосфокиназы, лактатдегидрогеназы, аспартатаминотрансферазы и их диагностическая значимость при гипоксически-ишемических поражениях миокарда. Индукция щелочной фосфатазы происходит при хроническом стрессе, указывает на стимуляцию системы гипофиз–кора надпочечников.
Активность аминотрансфераз, являясь маркером состояния печени и миокарда, часто используется в неонатальной неврологии. Для новорожденных младше пяти дней их уровень: АлАт <49, АсАт <97; от пяти дней до шести месяцев: АлАт <57, АсАт <77.
У новорожденных обследуемой группы средние значения активности аминотрансфераз составили: АлАТ — 15,75±9,30 (минимум - 4,1; макс – 78,8); АсАт — 43,2±24,22(минимум - 8,5; макс – 145).
У 12 % новорожденных зарегистрирована высокая ферментативная активность АсАТ крови, что свидетельствует о нарушениях со стороны миокарда, и возможном развитии метаболической дезадаптации.
Заключение. Выявление нарушений метаболических процессов в раннем неонатальном периоде необходимо для своевременного начала коррекционной терапии с целью предотвращения развития заболеваний в более отдаленные периоды жизни ребенка.
ФЕРМЕНТЫ В ДИАГНОСТИКЕ ИНФАРКТА МИОКАРДА
А.А Ахметгареева, А.Г. Янгурчина, Ю.Г. Янгурчина, 3 курс
Научный руководитель – к.м.н., доц. М.А. Белова
Кафедра клинической лабораторной диагностики
Оренбургский государственный медицинский университет
ENZYMESINTHEDIAGNOSISOFMYOCARDIALINFARCTION
A . A . Akhmetgareeva , A . G . Yangurchina , Y . G . Yangurchina , 3 course
Supervisor – CandidateofSciencesinMedicine , AssistantProfessorM . A . Belova
Departmentofclinicallaboratorydiagnostics
TheOrenburgStateMedicalUniversity
Аннотация. В настоящее время уделяется большое внимание изучению ферментативной диагностике инфаркта миокарда. В ходе работы был проведен анализ научной литературы по данной теме и сопоставлено диагностическое значение ферментов (КФК – креатинфосфокиназа; АсАТ – аспартатаминотрасфераза; ЛДГ - лактатдегидрогеназа) и других лабораторных маркеров некроза миокарда (миоглобин, сердечные тропонины).
Ключевые слова: ферменты, ферментативная диагностика, маркеры некроза, креатинфосфокиназа, аспартатаминотрансфераза, миоглобин, лактатдегидрогеназа, сердечные тропонины.
А nnotation.Much attention is paid to the study of the enzymatic diagnosis of myocardial infarction today. An analysis of the scientific literature on this topic were carried out during of this work. The diagnostic value of enzymes was matced (CPK — creatine phosphokinase; AsAT — aspartate aminotransferase; LDH — lactate dehydrogenase) and other laboratory markers of myocardial necrosis (myoglobin, cardiac troponins) were compared.
Key words: enzymes, enzyme diagnostics, necrosis markers, aspartate aminotransferase, creatine phosphokinase, myoglobin, lactate dehydrogenase,cardiac troponins.
Актуальность темы вызвана социальной значимостью инфаркта миокарда (ИМ): он имеет тенденцию квсе большему распространению в мире, отличается сложностью диагностики и высоким процентом диагностических ошибок, является одной из основных причин инвалидности во взрослом возрасте.
У больных острым инфарктом миокарда происходит разрушение кардиомиоцитов и выход высвобождающихся клеточных ферментов в кровь, это и служитосновной причиной повышения активности и содержания ферментов в сыворотке крови, что является важным диагностическим показателем.
Идеальный биохимический маркер должен обладать наивысшей специфичностью и чувствительностью в отношении некроза миокарда, в течение короткого времени после начала симптомов ИМ достигать в крови диагностически значимого уровня, этот уровень должен сохраняться в течение многих дней. В настоящее время маркера, полностью отвечающего всем этим требованиям, не существует, поэтому для диагностики ИМ рекомендуется параллельно использовать два маркера — "ранний" и "поздний". Содержание "раннего" маркера при ИМ диагностически значимо повышается в крови в первые часы заболевания, "поздний" —достигает диагностически значимого уровня только через 6—9 часов (ч.), но обладает высокой специфичностью в отношении некроза миокарда.
К ранним диагностическим маркерам относятся миоглобин и сердечная форма креатинфосфокиназы (МВ-КФК).
Миоглобин — дыхательный пигмент, широко представленный в мышечной ткани человека. Молекулярная масса его составляет 18 кДа. Содержание миоглобина при ИМ повышается в сыворотке крови наиболее рано — в пределах 2 ч после возникновения симптомов. Он в неизмененном виде выводится мочой и к 24-му часу с момента начала симптомов исчезает из кровотока. Существуют методики, позволяющие определить концентрацию миоглобина в крови в течение 10 минут (мин.). Наиболее целесообразно применение миоглобина для суждения об успехе тромболитической терапии. У больных с успешной реканализацией артерии, кровоснабжающей зону ИМ, концентрация миоглобина в сыворотке крови нарастает уже через 60—90 мин после начала введения фибринолитика. Большое содержание миоглобина в скелетной мускулатуре и зависимость его концентрации от функции почек делают его неспецифичным в отношении некроза миокарда и ограничивают его применение для диагностики ИМ.
КФК — фермент, широко представленный в мышечной ткани человека. Изолированное определение в крови общей КФК в настоящее время большинством экспертов признано нецелесообразным для диагностики ИМ из-за высокого содержания этого фермента в скелетной мускулатуре и низкой специфичности в отношении некроза миокарда. MB-изоформа КФК — это гетеродимер с молекулярной массой 86 кДа. Скелетные мышцы содержат мышечную форму КФК (ММ-КФК) и менее 3% сердечной формы (МВ-КФК). МВ-КФК при ИМ появляется в сыворотке крови через 3—4 ч после начала симптомов и достигает диагностически значимого уровня к 4—6-му часу. Повышенный ее уровень сохраняется 48—72 ч. Доля МВ-КФК среди общей КФК, превышающая 5—6%, является специфичным признаком некроза миокарда. Однако хроническая почечная недостаточность, травматичные операции, гипотиреоз, некоторые онкологические заболевания, инсульты, миастении могут привести к повышенному уровню МВ-КФК в крови и гипердиагностике ИМ. При использовании MB-КФК для диагностики ИМ необходимо повторно определять концентрацию этого маркера в крови. Экспертами Европейского кардиологического общества (ЕКО) в настоящее время считается предпочтительным для диагностики ИМ определять массу МВ-КФК, а не активность этого фермента в крови.
К поздним диагностическим маркерам ИМ относятсялактатдегидрогеназа (ЛДГ), аспартатаминотрансфераза (АсАТ), сердечные тропонины I и Т.
ЛДГ — цитозольный белок с молекулярной массой 135 кДа, использующийся в клинической практике на протяжении четырех десятилетий. ЛДГ имеет пять изоэнзимов. В сердечной мышце содержится преимущественно изоэнзим ЛДГ-1. При ИМ концентрация ЛДГ начинает превышать нормальный уровень через 14—48 ч после начала симптомов, достигает максимального значения на 3—6-е сутки заболевания и возвращается к норме на 7—14-е сутки. ЛДГ-1 была обнаружена также в эритроцитах, почках, мозге, желудке, повышение концентрации этого белка в крови больных далеко не всегда связано с некрозом миокарда. Отношение ЛДГ-1/ЛДГ-2, превышающее 0,76, обладает 90% специфичностью при выявлении некроза миокарда. Это соотношение может увеличиваться и в случае отсутствия ИМ, если у больного имеются массивный гемолиз, мегалобластическая анемия, распространенное повреждение скелетных мышц, тяжелое заболевание печени. Из-за позднего повышения концентрации ЛДГ в сыворотке крови этот маркер не применяется для ранней диагностики ИМ и суждения об успехе тромболитической терапии, однако ЛДГ длительно использовалась для диагностики ИМ в поздние сроки заболевания.
АсАТ несколько десятилетий используется для диагностики ИМ. У больных ИМ уровень АсАТ превышает норму через 8—12 ч после начала боли, достигает максимального значения к 24—З6-му часу и возвращается к норме за 3—4 дня. Большое количество этого фермента содержится в тканях печени, что сильно снижает его специфичность в отношении некроза миокарда. АсАТ неудобна как для ранней, так и для поздней диагностики ИМ, она используется только в сочетании с более чувствительными и специфичными маркерами. Низкая специфичность в отношении некроза миокарда послужила причиной того, что использование этого маркера, как и ЛДГ, для диагностики ИМ в настоящее время также признано нецелесообразным.
Тропониновый комплекс, регулирующий процесс мышечного сокращения в кардиомиоцитах, состоит из трех субъединиц: Т, I и С . Сердечные тропонины и тропонины скелетных мышц имеют различную аминокислотную последовательность, что позволяет создавать высокоспецифичные диагностикумы для определения концентрации сердечных тропонинов Iи Т (сТн)в сыворотке крови. Молекулярная масса сТн Т составляет 37 кДа, сТн I —23,8 кДа. Сердечные тропонины при ИМ обычно достигают в крови больных диагностически значимого уровня через 6 ч после начала симптомов, повышенный их уровень сохраняется в дальнейшем в течение 7—14 суток, что делает их удобными для поздней диагностики ИМ. Из-за высокой специфичности и чувствительности определение сердечных тропонинов стало "золотым стандартом" в биохимической диагностике ИМ.
Таким образом, наибольшее значение в диагностике инфаркта миокарда имеют ферменты КФК и ЛДГ, появление вышеперечисленных ферментов в крови является важным диагностическим признаком. Другие лабораторные маркеры (миоглобин, тропонины) имеют ряд преимуществ, но имеют и свои ограничения. В связи с этимнеобходимо продолжение поиска более ранних и специфичных маркеров.
ДИНАМИКА УРОВНЯ ПЕЧЕНОЧНЫХ ТРАНСАМИНАЗ И АМИЛАЗЫ У БОЛЬНОГО С ОСТРЫМ БИЛИАРНЫМ ПАНКРЕАТИТОМ (КЛИНИЧЕСКИЙ СЛУЧАЙ)
Р.Р. Ахметгареева, 5 курс
Научный руководитель - к.м.н., доц. Е.В.Малицкая
Кафедра госпитальной хирургии, урологии
Оренбургский государственный медицинский университет
DYNAMICSOFTHELEVELOFHEPATICTRANSAMINASEANDAMYLASESINAPATIENTWITHACUTEBILIARYPANCREATITIS(CLINICALCASE)
R . R . Ahmetgareeva 5 course
Supervisor – CandidateofSciencesinMedicine , AssistantProfessorE . V . Malitskaya
Department of Hospital Surgery , Urology
The Orenburg State Medical University
Аннотация. Динамика уровня печеночных трансаминаз и сывороточной амилазы при билиарном панкреатите имеет большое значение при диагностике и лечении данного заболевания.
Ключевые слова: уровень печеночных трансаминаз, сывороточная амилаза, билиарный панкреатит.
Annotation. The dynamics of the level of liver transaminases and serum amylase in biliary pancreatitis is of great importance in the diagnosis and treatment of this disease.
Key words: liver transaminase level, serum amylase, biliary pancreatitis.
Диагностика острого билиарного панкреатита носит комплексный характер и включает в себя анализ жалоб, данных анамнеза, объективный осмотр, лабораторные и инструментальные методы исследования. В клиническом анализе крови выявляют лейкоцитоз, при биохимическом исследовании отмечаются изменение функциональных проб печени (повышение активности трансаминаз, ЩФ, ГГТП), а также повышение уровня сывороточной амилазы и липазы. Следует также отметить, что изменения печеночных тестов и сывороточной амилазы более выражены при билиарном панкреатите. При проведении биохимического анализа крови эти ферменты остаются более простым и доступным способом, в комплексе с другими методами исследованиями, определения дальнейшей тактики врача – хирурга, так как проблема лечения билиарного панкреатита остается сложной задачей в хирургии.
Разнообразные билиарные дисфункции, хронический холецистит и желчнокаменная болезнь являются наиболее частой причиной развития острого и хронического билиарнозависимого панкреатита. Холедохолитиаз в 25-65 % случаев приводит к развитию билиарного панкреатита. Основным направлением лечения острого билиарного панкреатита (ОБП) является устранение причины заболевания – холедохолитиаза, холецистолитиаза, стриктур терминального отдела холедоха и большого дуаденального сосочка и др. Для этого используются современные возможности базовой интенсивной консервативной терапии, малоинвазивные эндоскопические вмешательства. Тактика лечения ОБП должна основываться на максимальном использовании эндоскопических методов лечения в наиболее ранние сроки поступления больного в стационар.
Цель работы – оценить в динамике изменение уровня печеночных трансаминаз и амилазы сыворотки у больного с острым билиарным панкреатитомна клиническом примере.
Материалы и методы -клинический случай. Пациент Д., 66 с диагнозом - ПХЭС. Холедохолитиаз. Холангит. Механическая желтуха. Острый билиарный панкреатит.
Результаты.Больной А., 66 лет поступил в экстренном порядке через 10 часа от начала заболевания с жалобами на боли в эпигастрии с иррадиацией в спину, возникшие после погрешности в диете (после употребления жирной пищи). Из анамнеза холецистэктомия в 2014 году. Объективно при поступлении: в сознании, адекватен, АД 130/80 мм.рт.ст, пульс 76 ударов в минуту.
По данным лабораторных исследований: в общем анализе крови лейкоцитоз 10,7х109/л, в общем анализе мочи диастаза повышена Д 2828 ед/л. В биохимическом анализе крови: повышено содержание общего билирубина – 50,4 мкмоль/л, прямого билирубина – 33,3 мкмоль/л, повышен уровень трасаминаз АСАТ – 58 ед/л, АЛАТ - 66 ед/л, сывороточной амилазы – 2157 ед/л, ЩФ 501 ед/л. По результатам УЗИ – состояние после холецистэктомии, диффузные изменения печени, поджелудочной железы, признаки холестаза. По данным МРТ: нельзя исключить конкремент в холедохе.
Начата консервативная терапия: диета, спазмолотики, антибиотики, инфузионная терапия, октреотид. Состояние с улучшением. Боли в животе уменьшились. При контрольном ЭГДС: в просвете желчь, эрозивный гастрит.
Однако, через 6 дней после проведенного лечения у пациента возник рецидив болей в животе, наросла желтуха, появилась гектическая лихорадка. При УЗИ-контроле: внутрипеченочные протоки расширены до 2-3 мм, холедох 12 мм. В биохимическом анализе крови: повышено содержание общего билирубина на 62,2 мкмоль/л – 112, 6 мкмоль/л, прямого билирубина на 60 – 99,3мкмоль/л, уровень амилазы – 1822 ед/л по сравнению с предыдущими результатами.
На основании жалоб, лабораторных и инструментальных методах исследования установлен диагноз: ПХЭС. Холедохолитиаз. Холангит. Механическая желтуха. Острый билиарный панкреатит. Основанием для установления диагноза острого билиарного панкреатита являлись наличие выраженного болевого синдрома, желтуха и гиперамилаземия.
Выставлены показания к операции - эндоскопическая папиллосфинктеротомия. Извлечен конкремент 0,7 см в диаметре.
В послеоперационном периоде состояние больного улучшилось, боли в животе стихли. В общем анализе крови снижено количество гемоглобина – 108 г/л, эритроцитов – 3,5х1012/л, лимфоцитов - 15 %, ускорена СОЭ - 44 мм/час. Сахар в норме – эндокринных нарушений со стороны поджелудочной железы не выявлено. В общем анализе мочи диастаза нормализуется Д 262 ед/л. В биохимическом анализе крови: содержания общего билирубина – 29,0 мкмоль/л, прямого билирубина – 17,9 мкмоль/л почти снизились до нормы, уровень амилазы – 85 ед/л, АСАТ – 21 ед/л, АЛАТ 33 ел/л в норме, ЩФ-525 ед/л остается повышенной. УЗИ - контроль: холедох 6 мм, внутрипеченочные желчные протоки не расширены, дополнительных объёмных образований, свободной жидкости в брюшной полости нет.
Выполненная в срочном порядке эндоскопическая декомпрессия желчных путей - ЭПСТ с восстановлением проходимости общего желчного протока - оказалась эффективной. Длительность стационарного лечения составило 13 койко-дней. Сочетание методов интенсивной терапии, малоинвазивных эндохирургических методик, методов дезинтоксикации позволили значимо снизить длительность лечения, количество осложнений. Пациент выписан ус улучшением, без осложнений.
Заключение.У больного с острым билиарным панкреатитом отмечена корреляция уровня печеночных трансаминаз и сывороточной амилазы с выраженностью клинической картины заболевания и их мониторинг играет важную роль в диагностике острого билиарного панкреатита.
ИММОБИЛИЗАЦИЯ ФЕРМЕНТОВ: ПРИМЕНЕНИЕ В ДИАГНОСТИКЕ И МЕДИЦИНЕ
Кхарат Й., 2 курс
Научный руководитель - асс. Н. В. Зобкова
Кафедра биологической химии
Оренбургский государственный медицинский университет
ENZYMEIMMOBILIZATION : APPLICATIONSINDIAGNOSISANDMEDICINE
KharatY ., 2 course
Supervisor – Ass . N . V . Zobkova
DepartmentofBiochemistry
TheOrenburgStateMedicalUniversity
The current demands of the world’s biotechnological industries are enhancement in enzyme productivity and development of novel techniques for increasing their shelf life. These requirements are inevitable to facilitate large-scale and economic formulation. Enzyme immobilization provides an excellent base for increasing availability of enzyme to the substrate with greater turnover over a considerable period of time. Several natural and synthetic supports have been assessed for their efficiency for enzyme immobilization. Nowadays, immobilized enzymes are preferred over their free counterpart due to their prolonged availability that curtails redundant downstream and purification processes. Future investigations should endeavor at adopting logistic and sensible entrapment techniques along with innovatively modified supports to improve the state of enzyme immobilization and provide new perspectives to the industrial sector.
Enzyme immobilization is a technique to produce stable enzymes. This is an important technique for storage and use of enzymes for commercial purposes.
Enzymes are bio-catalysts formed inside the body of animals, plant and cells.
They have diverse role on the physiology and when isolated out of the body for external use they get damaged easily. Hence forth immobilization is a technique adopted to isolate enzymes and store them externally for long duration.
The process involves extraction, purification and stabilization of the enzymes.
Enzyme Immobilization methods:
1. Extraction of crude enzyme.
2. Preparation of crude enzyme.
3. Purification of Enzymes.
4. Final processing. Which includes reaction of enzyme with inert substances in reactors to make them immobile.
Application of Immobilized Enzymes in Medicine and Drug Manufacture.
In production of Antibiotics: Immobilizedpencillinaseis used in converting Pencillin-G or V to 6-amino pencillinic acid. From this 6-APA Ampicillin is produced using immobilized enzyme pencillamidase. Other examples include: bacitracin, tyrosine, nikkomycin are manufactured using suitable immobilized enzymes.
Production of Steroids: Prednisolone is produced from cortisone using immobilized enzyme obtained from curcurialanata.
To produce amino acids: Immobilized L-aspartase-4-decarboxylase enzyme helps in conversion of L-Aspartic acid to L-Alanine an amino acid.
In production of L-DOPA: L-DOPA is a drug used in treatment of Parkinsonism. This can be produced by using immobilized enzyme β-tyrosinase.
To produce: medicinal plant derivatives like anthraquinone (a glycoside to relieve constipation).
Application in Diagnosis of Medical Conditions.
Immobilized enzymes are used to study the type of disease present in the patient and also to study the pathological conditions.
Immobilized enzyme Aldolase is used in diagnosis of muscle disorders.Glutamate oxalo acetate transfrerase” to diagnose myocardial infarction.Iso-citrate dehydrogenase is used in diagnosis of acute hepatitis.Prostate cancer is detected using immobilized enzymes Acid phosphatase.In Organo phosphorous poisoning (like pesticide poisoning), enzyme Choline esterase in RBC cells is used for diagnosis.Further immobilized enzymes like Alkaline phosphatase and β-lactamase are used in analysis of antigens and antibodies.
Immobilized enzymes are also used as bio-sensors to measure the concentration of biologicals in the body fluids.
Kinetic reactions which involve the measurement of percentage conversion of substrate into product and also to study the rate of reaction are done by immobilized enzymes.
Дата: 2019-07-24, просмотров: 457.