Гемолитическая болезнь (ГБ) плода и новорожденного является патологическим состоянием, возникающим в результате несовместимости крови матери и плода по некоторым антигенам, при котором происходит гемолиз эритроцитов плода под влиянием изоантител матери, проникающих через плацентарный барьер.
Чаще всего заболевание развивается в результате резус-конфликта или конфликта по системе ABO (1 случай на 250-300 родов).
Существуют три основных вида Rh-фактора: антигены D (Rh), С (Rhj) и Е (Rhn) и три разновидности антигена Hr: d, с, е. Наиболее выраженными антигенными свойствами обладает фактор D. Из Нг-факторов большей способностью вызывать образование антител отличается фактор с.
Этиология и патогенез. Конфликт вследствие изосерологической несовместимости матери и плода чаще всего развивается по эритроцитарным антигенам Rh-Hr и AB0.
В зависимости от этнической принадлежности, частота резус-отрицательной принадлежности крови в популяции варьирует от менее 1% у китайцев, до 30% и более у басков. У европейцев частота в среднем составляет 15%. Изоиммунизация может явиться следствием двух основных причин:
— первая, к счастью, все реже и реже встречающаяся — ятрогенная. Она связана с введением в организм женщины резус-положительной крови при проведении ей в прошлом переливаний крови или при аутогемотерапии;
— вторая является основной — это плодово-материнский трансплацентарный
перенос эритроцитов плода в кровоток матери во время беременности и
родов.
Rh-изоиммунизация — это иммунный ответ организма матери на попадание в него чужеродных для него антигенов, находящихся на мембране эритроцитов плода. Размеры и формы эритроцитов плода и взрослого человека различны, поэтому путем количественного определения в циркуляции матери эритроцитов плода можно косвенно судить об объеме плодово-материнских трансплацентарных кровотечений. Их частота и объем существенно увеличиваются по мере прогрессирования беременности. Если в течение I триместра беременности они регистрируются только у 3% беременных (их объем составляет около 0,03 мл), то в III триместре они выявляются у 45% беременных женщин и расчетный объем трансплацентарных кровотечений достигает 25 мл.
Первичный иммунный ответ после попадания D-антигена в кровоток матери проявляется через определенное время — от 6 недель до 12 месяцев. Он состоит в появлении иммуноглобулинов класса М, молекулы которых имеют значительные размеры и не проникают к плоду через плацентарный барьер. Это объясняет отсутствие гемолитической болезни у плодов большинства первобеременных резус-отрицательных женщин.
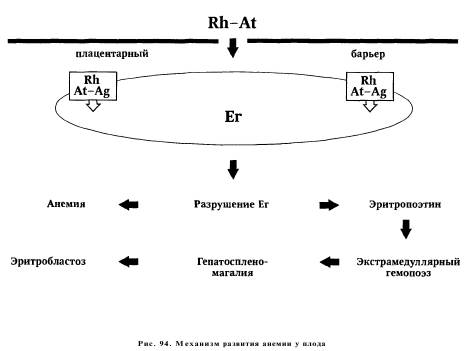
Попадание D-антигена в кровоток матери при повторной беременности вызывает быстрый вторичный иммунный ответ в виде образования небольших по своему размеру иммуноглобулинов класса G, которые, свободно проникая через плацентарный барьер, осаждаются на мембране эритроцитов резус-положительного плода, приводя к их гемолизу.
Rh-антигены обнаруживаются на мембране эритроцита плода уже к 30-му дню беременности. Циркулирующие при повторной беременности анти-Б-антитела (иммуноглобулины G) проникают через плацентарный барьер, связываются с соответствующими антигенами на мембране эритроцитов, что вызывает ускоренное разрушение последних в органах ретикулоэндотелиальной системы.
Массивное разрушение эритроцитов приводит к развитию анемии у плода (анемическая форма), появление которой вызывает повышение концентрации эритропоэтина в кровотоке у плода. Эритропоэтин, в свою очередь, стимулирует гемопоэз, в результате которого появляются очаги экстрамедуллярного кроветворения, в основном в печени и селезенке плода, которые существенно увеличиваются. Экстрамедуллярный гемопоэз характеризуется незавершенностью развития эритроцитов и появлением в циркуляции эритробластов.
Хотя непрямой билирубин, образующийся при гемолизе эритроцитов плода, интенсивно выводится через плаценту, повышение его концентрации нарушает синтез белков в печени плода, уже измененный за счет появления экстрамедуллярного гемопоэза. Следствием этого патологического процесса становится гипопротеинемия, снижение онкотического давления плазмы крови плода и портальная гипертензия. Развитие анемии у плода приводит к снижению кислородной емкости его крови. Это, в свою очередь, влечет за собой усиление анаэробного гликолиза в тканях, ацидоз, снижение буферных резервов крови, повреждение эндотелия капилляров и развитие хронической гипоксии. На фоне хронической гипоксии и ацидоза возникает компенсаторное увеличение сердечного выброса и минутного объема, приводящее к гипертрофии миокарда и постепенному развитию сердечной недостаточности, и как следствие, к повышению центрального венозного давления (ЦВД). Повышение ЦВД затрудняет ток лимфы по магистральным лимфатическим сосудам, вызывая нарушение оттока интерстициальной жидкости и увеличение ее онкотического давления. Весь комплекс происходящих патологических процессов вызывает накопление жидкости в тканях и серозных полостях плода, что клинически проявляется развитием у него генерализованного отека (отечная форма ГБ) и при отсутствии соответствующего лечения приводит к внутриутробной гибели плода.
Понимание патофизиологии развития гемолитической болезни плода позволило разработать методы профилактики изоиммунизации Rh-отрицательных беременных женщин, методы диагностики и легения гемолитической болезни плода и новорожденного.
Всем беременным женщинам при первом же визите к врачу следует провести типирование по группе крови и Rh-фактору, а также определение антирезусных антител. При выявлении Rh-отрицательной принадлежности крови беременной, имеющей Rh-положительный фактор у мужа, показано повторное определение антирезусных антител каждые 4 недели вплоть до родов. Следует помнить о том, что резус-положительные лица могут быть гомозиготными или гетерозиготными, тогда как резус-отрицательные — только гомозиготными. Это имеет практическое значение, поскольку потомство гомозиготного резус-положительного отца и резус-отрицательной матери будет резус-положительным в 100% случаев. Если отец гетерозиготный, вероятность для плода быть резус-положительным составит только 50%.
Анамнез Rh-изоиммунизированной беременной женщины имеет большое значение в оценке риска развития тяжелых форм гемолитической болезни. Титр антител в крови беременной женщины и его динамика могут быть использованы для оценки степени тяжести гемолитической болезни. При этом границей, после которой возможно развитие клинически значимых форм гемолитической болезни плода, является титр 1: 8. При последующих беременностях величина титра Rh-антител в крови матери не имеет корреляции со степенью тяжести гемолитической болезни плода и, кроме того, отек у плода может развиться при минимальной величине титра антител —1:2.
Опыт применения ультразвукового сканирования для диагностики и определения степени тяжести гемолитической болезни плода показывает его высокую чувствительность и специфичность при развитии у плода только тяжелой — отечной формы заболевания, о чем свидетельствует определение свободной жидкости в его серозных полостях. При других формах гемолитической болезни плода чувствительность и специфичность однократного ультразвукового исследования низки. Однако ценность ультразвукового исследования может быть увеличена при динамическом наблюдении за состоянием плода одним и тем же исследователем. При этом уделяется внимание размерам печени, селезенки, толщине плаценты и эхогенности кишечника, что имеет особое значение для выявления самых начальных стадий развития отека у плода и его разрешения на фоне внутриматочного лечения. Кроме того, косвенным показателем наличия анемии у плода, не имеющего отека, может служить увеличение скорости кровотока в средней мозговой его артерии и аорте, определяемой при допплерометрии с использованием цветного допплеровского картирования. Изменение скорости кровообращения связано с формированием гипердинамического типа циркуляции у плода, формирующейся на фоне развивающейся анемии, а также обусловленным возрастанием сердечного выброса на фоне увеличения венозного возврата, являющегося следствием снижения вязкости крови. Этот критерий, оцененный в динамике, может быть использован как дополнительный маркер для определения оптимальных сроков начала инфузий и их повторов при анемической форме гемолитической болезни.
Тактика ведения беременности при Rh-изоиммунизации беременной женщины зависит от Rh-принадлежности плода.
Существует возможность определения Rh-генотипа плода при помощи молекулярно-генетических методов с использованием любых клеток плодового происхождения, что дает уникальную возможность определять тактику ведения Rh-иммунизированных женщин уже в начале беременности. Полимеразная цепная реакция имеет 100% чувствительность и специфичность при определении Rh-генотипа плода.
Амниоцентез является наиболее безопасным инвазивным вмешательством для плода в период с 14-й по 18-ю неделю беременности, так как это наилучший срок для Rh-типирования плодов у Rh-иммунизированных беременных женщин.
Очевидно, в ближайшем будущем совершенствование методов выделения клеток крови плода в периферической крови матери (а клетки крови плода всегда присутствуют в кровотоке матери за счет плодово-маточных трансфузий) постепенно вытеснит из клинической практики инвазивные вмешательства во время беременности для определения Rh-генотипа плода.
В настоящее время оценка степени тяжести гемолитигеской болезни плода базируется на инвазивных вмешательствах.
Начиная с 1961 г. анализ оптической плотности околоплодной жидкости, полученной при амниоцентезе, был основным методом диагностики степени тяжести гемолитической болезни. Однако этот метод имеет очевидные недостатки. Речь идет, прежде всего, о весьма высокой частоте ложноположительных и ложноотрицательных результатов, особенно во II триместре беременности, и о необходимости повторных, 2-4-кратных операций амниоцентеза.
Разработка в 1983 г. метода получения крови плода при помощи кордоцентеза — пункции сосудов пуповины под ультразвуковым контролем — открыла новую страницу в диагностике и лечении гемолитической болезни плода. Этот метод может быть использован уже в конце первой половины беременности, что имеет принципиальное значение при необходимости диагностики раннего развития тяжелых форм гемолитической болезни плода.
Анализ гематологических показателей у плодов при неосложненном течении беременности позволил определить границы нормального распределения величин всех показателей крови в зависимости от срока беременности. Все основные показатели, позволяющие оценить степень анемии у плода, такие как величина гемоглобина и гематокрита, а также содержание эритроцитов, повышаются по мере прогрессирования беременности. При этом в начале второй половины физиологически протекающей беременности уровень гемоглобина составляет 120 г/л и возрастает к 37-й неделе до 140 г/л. Средний уровень гематокрита крови повышается с 36 до 43%.
Классификация степеней тяжести гемолитической болезни плода зависит от величин гематокрита и гемоглобина его крови, полученной при кордоцентезе.
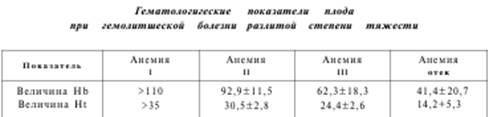
Оценка степени тяжести позволяет определить тактику ведения изоиммунизированной беременности, обосновать необходимость внутриматочного лечения и оптимального времени досрочного родоразрешения.
Содержание общего белка и альбумина в плазме крови плодов по мере увеличения срока беременности при неосложненной беременности увеличивается.
Концентрация альбумина с 20-й по 37-ю неделю увеличивается почти в полтора раза, достигая к концу беременности величины 35 г/л. При развитии у плодов тяжелой анемии, особенно при формировании отека, содержание альбумина в крови плода снижается, что позволило разработать новый патогенетический метод лечения тяжелых форм гемолитической болезни плода с использованием
препарата альбумина.
Отечная форма гемолитической болезни может развиваться уже в течение II триместра беременности, и, в этом случае, практически 100% таких плодов погибают антенатально до 30-й недели беременности. Тем не менее, даже при отечной форме плода показатели красной крови могут быть успешно корригированы. Однако при проведении переливания только отмытых эритроцитов донора, несмотря на полную нормализацию показателей крови у плода, отек разрешается после первого переливания лишь у 33% плодов. Поэтому в настоящее время разработан метод сочетанного переливания плоду отмытых эритроцитов донора и 20% раствора альбумина в соотношении 5:1. Такая терапия приводит к исчезновению выраженного отека у всех плодов. При этом происходит нормализация как показателей красной крови, так и содержания сывороточного альбумина.
Так как до настоящего времени этиопатогенетических методов лечения гемолитической болезни плода в начальной стадии развития не существует (нет убедительных данных о положительном влиянии на течение заболевания у плода каких-либо медикаментозных средств или процедур), то сегодня можно утверждать, что основным методом легения тяжелых форм гемолитшеской болезни плода является проведение ему внутриматоъных переливаний отмытых эритроцитов донора в соъетании с альбумином под ультразвуковым контролем.
Например, при отсутствии отека у плода после переливания наблюдается полная нормализация показателей его крови, в частности, гематокрит повышается в среднем в 1,9 раза. Даже при тяжелейшей гемолитической анемии на фоне развившегося отека у плода этот метод позволяет осуществить полную коррекцию анемии при увеличении значений гематокрита в 3 раза.
При лечении рано развившейся тяжелой формы гемолитической болезни требуются неоднократные внутрисосудистые переливания плоду. В НИИАГ им. Д. О. Отта РАМН имеется собственный опыт 5-кратных переливаний одному плоду и 10-кратных у одной беременной при двуплодной беременности. Опыт
трансфузий отмытых эритроцитов донора и одновременно 20% раствора альбумина свидетельствует о том, что своевременное их выполнение позволяет существенно пролонгировать течение беременности на фоне удовлетворительных показателей крови плода и производить родоразрешение близко к сроку родов. При ведении подобных пациентов следует стремиться к родоразрешению при сроке беременности 36-37 недель.
Для успешного внутриматочного лечения тяжелых форм гемолитической болезни плода важно своевременное обращение беременных женщин высокого риска по развитию этого заболевания в специализированный перинатальный центр. Общеизвестны данные, которые свидетельствуют: при обращении женщин в центр до 18 недель беременности все внутриматочные переливания были предприняты до развития у плода отека. При позднем обращении — после 24 недель беременности у 81% женщин лечение начиналось уже на фоне имеющегося отека плода. Таким образом, особая роль в обеспечении хороших результатов терапии гемолитической болезни принадлежит женской консультации.
Риск осложнений, непосредственно связанных с диагностическими вмешательствами при проведении только кордоцентеза, незначительно превышает 1%.
Общие потери плодов за время беременности и раннего неонатального периода не превышают при этом популяционного уровня. При проведении длительных внутриматочных вмешательств — а именно такими являются трансфузии — риск, естественно, повышается Это связано с тремя основными причинами:
1. Вмешательства проводятся на фоне исходно патологического состояния плода.
2. На сердечно-сосудистую систему плода оказывается существенная нагрузка введением объемов крови, сопоставимых, а иногда и превышающих общий фетоплацентарный объем циркулирующей крови.
3. Двигательная активность плода существенно затрудняет выполнение длительных внутриматочных манипуляций.
Контроль за состоянием плода во время вмешательства, во избежание перегрузки его сердечно-сосудистой системы и развития тяжелой брадикардии, проводится путем постоянного кардиомониторного наблюдения за сердечным ритмом. При появлении признаков нарушений функционального состояния плода следует уменьшать скорость трансфузии вплоть до ее полного прекращения. Это особенно важно при отечной форме гемолитической болезни, поскольку развитие отека обусловлено сердечно-сосудистой недостаточностью, формирующейся на фоне нарушения плодово-плацентарной циркуляции.
Двигательная активность плода значительно усложняет условия выполнения переливаний и может явиться причиной тяжелых повреждений сосудов пуповины и органов плода. Для обездвиживания плоду внутрисосудисто вводится миорелаксант пипекуроний (ардуан). Ардуан не оказывает влияния на частоту сердечных сокращений плода и в дозе 0,1 мг на 1 кг расчетной массы плода вызывает полное его обездвиживание в течение 40-50 минут. Обездвиживание плода позволяет сократить длительность внутриматочных вмешательств, значительно снизить частоту случаев выхода конца пункционной иглы из просвета сосуда пуповины и, следовательно, избежать трансфузии крови донора в амниотическую полость и необходимости выполнения повторных кордоцентезов в целях продолжения переливания.
Течение беременности при изосерологигеском конфликте. Течение беременности отличается большим числом осложнений, к которым относятся: невынашивание за счет увеличения частоты самопроизвольных выкидышей (13%) и преждевременных родов (до 10%), анемии, ОПГ-гестозов, кровотечений в последовом и раннем послеродовом периодах. Повышается число гнойно-септических заболеваний у матерей и новорожденных.
Гемолитигеская болезнь новорожденного. Значительный гемолиз эритроцитов плода, как правило, приводит к развитию тяжелой формы гемолитической болезни, завершающейся антенатальной гибелью плода или смертью ребенка в первые часы жизни из-за сердечно-легочной недостаточности. Однако в большинстве случаев заболевание быстро развивается после рождения, чему способствует поступление большого количества антител в кровь ребенка при нарушении целостности сосудов плаценты, повышение конглютинационной активности крови ребенка. Значительную роль в патогенезе ГБ играет пониженная ферментативная активность печени новорожденного. В норме в ретикулоэндотелиальных клетках в результате гемолиза эритроцитов из гемоглобина образуется свободный (или непрямой) билирубин, который далее в печени при участии системы ферментов, из которых основным является глюкуронилтрансфераза, соединяется с глюкуроновой кислотой и превращается в конъюгированный (или прямой) билирубин. Последний хорошо растворяется в воде и выводится печеночными клетками в желчные протоки, а затем удаляется с мочой и калом.
У новорожденных в первые дни жизни активность ферментов печени еще низкая, и даже физиологический гемолиз приводит к накоплению в крови повышенного количества свободного билирубина (физиологическая гипербилирубинемия) и к так называемой физиологической желтухе новорожденных. При гемолитической болезни, когда интенсивный гемолиз наслаивается на пониженную способность печени трансформировать билирубин, происходит патологическое накопление в крови новорожденного свободного непрямого билирубина.
Свободный билирубин циркулирует в крови в виде комплексов с альбумином, в таком состоянии он не проникает через клеточные мембраны. При значительном накоплении прямого билирубина его связи с альбумином нарушаются, и он легко проникает из сосудистого русла через клеточные мембраны в ткани, особенно в ткани, богатые липидами, — жировую, нервную. Переходу билирубина в ткани способствуют недостаточное количество альбумина, сдвиг кислотно-основного состояния в сторону ацидоза, наличие в крови повышенного количества веществ — конкурентов билирубина при связывании с альбумином (гормоны, свободные жирные кислоты, салицилаты, сульфамиды).
В клетках нервной системы билирубин проявляет свое токсическое действие, нарушая процессы клеточного дыхания. Это приводит к расстройству функций центральной нервной системы, т. е. к развитию клинических симптомов билирубиновой энцефалопатии (ядерная желтуха), в результате чего могут наступить или смерть ребенка, или стойкие неврологические нарушения, сохраняющиеся на всю жизнь. а всю жизнь.
Клиническая картина. Гемолитическая болезнь новорожденного имеет следующие варианты течения:
1) гемолитическая анемия без желтухи и водянки;
2) гемолитическая анемия с желтухой;
3) гемолитическая анемия с желтухой и водянкой.
Гемолитигеская анемия без желтухи и водянки (анемическая форма) в чистом виде встречается редко. Анемия выявляется, как правило, на 2-й и 3-й неделе жизни и быстро прогрессирует. Количество эритроцитов снижается до 2 х 1012/л, гемоглобина — до 60-80 г/л. Анемия связана не с усиленным гемолизом эритроцитов, а с подавлением функции костного мозга. При анемической форме заболевания нет ретикулоцитоза, эритробластоза, гипербилирубинемии. Анемия является нормохромной или гипохромной и относительно микроцитарной. Прогноз благоприятный.
Гемолитигеская анемия с желтухой (желтушная форма) встречается наиболее часто. Она может иметь легкое течение с умеренным, но длительным повышением уровня билирубина без увеличения печени и селезенки, но часто с последующей умеренной анемией.
Легкая форма заболевания чаще наблюдается при несоответствии крови матери и ребенка по групповым антигенам системы АВО.
Тяжелая желтушная форма гемолитической болезни иногда выявляется уже при рождении ребенка: его кожные покровы бледно-желтушные, печень и селезенка увеличены, мышечный тонус и рефлексы снижены, недостаточно активен крик. Даже при тяжелом течении болезни ребенок при рождении может выглядеть здоровым, розовым, однако уже в первые часы жизни появляется желтушность кожных покровов, которая быстро усиливается. Ребенок становится сонливым, вялым, снижаются мышечный тонус и рефлексы, нарушается активность сосания и далее, если не начать активное лечение, развиваются отчетливые симптомы билирубиновой энцефалопатии или ядерной желтухи. Первыми симптомами являются снижение активности сосания и изменение мышечного тонуса — появление ригидности затылочных мышц. Затем присоединяются гиперестезия, беспокойство, вскрикивания, глазодвигательные нарушения («симптом заходящего солнца»), судороги, расстройство дыхания, сердцебиения, резкое повышение температуры до 40-41 °С (пирогенное действие билирубина) и наступает смерть. В агональном периоде нередко отмечают геморрагические явления — кровоизлияния в кожу, кишечник, легкие. Перед смертью может развиться отек легких и пневмония, чаще геморрагического характера.
В некоторых случаях после ядерной желтухи наступает выздоровление, все симптомы исчезают, ребенок становится активным, хорошо сосет, увеличивается масса тела. Однако в большинстве случаев в дальнейшем выявляются неврологические последствия: от небольших моторных нарушений (координация движений, походка) до значительных расстройств, сочетающихся с глухотой и нарушением интеллекта.
В клинической картине тяжелой желтушной формы гемолитической болезни степень анемизации ребенка к моменту рождения не имеет решающего прогностического значения. Основным показателем тяжести заболевания является интенсивность прироста билирубина в крови.
При гемолитигеской анемии с желтухой и водянкой (отечная форма) плод чаще погибает внутриутробно. Это наиболее тяжелая форма заболевания.
Если плод не погибает, то ребенок рождается преждевременно и имеет характерный внешний вид: бледные слизистые оболочки и кожные покровы, видны петехии и геморрагии. Обращает на себя внимание большой живот вследствие асцита и увеличенных печени и селезенки. В крови число эритроцитов не превышает 1,5 х 1012/л, содержание гемоглобина до 80 г/л, значительно увеличено число ядерных форм эритроцитов («фетальный эритробластоз»).
Помогает в диагностике положительный прямой тест Кумбса, доказывающий наличие фиксированных эритроцитами ребенка блокирующих антител, указывает на резус-конфликт. Об этом же свидетельствует уровень билирубина в пуповинной крови, превышающий 51 мкмоль/л (по Ван-ден-Бергу), наличие анемии, нормобластов и ретикулоцитоз. Для постановки диагноза большое значение имеет анамнез матери (указания на самопроизвольные аборты, мертворождения, смерть ребенка от желтухи в первые дни после рождения).
Лечение желтушной формы гемолитической болезни направлено на борьбу с гипербилирубинемией и предотвращение развития билирубиновой энцефалопатии.
Наиболее эффективным способом снижения уровня билирубина является заменное переливание крови. Показаниями к нему у доношенных детей являются положительная проба Кумбса, содержание гемоглобина ниже 90 г/л, билирубина 342 мкмоль/л, темп нарастания (в час) билирубина выше 6,0 мкмоль/л и уровень его в пуповинной крови 60 мкмоль/л. Сущность его состоит в том, чтобы заменить кровью донора кровь ребенка, содержащую неполноценные, гемолизированные эритроциты, иногда и свободные антитела и, главным образом, продукты распада гемоглобина (билирубин). Кровь донора временно выполняет обычную функцию крови. Собственное кроветворение ребенка в первое время подавляется. Для заменного переливания крови раньше применяли только резус-отрицательную кровь. Далее было показано, что в крови ребенка почти не содержится свободных антител, они преимущественно связаны с эритроцитами и, следовательно, возможно применение для переливания менее дефицитной резус-положительной крови. Это испытано и широко применяется, но в самых тяжелых случаях болезни предпочтительнее применять резус-отрицательную кровь. При АВО несовместимости используется кровь группы 0(1), совпадающая с кровью ребенка по резус-фактору. Количество переливаний крови определяется из расчета 150-160 мл на 1кг массы,, в среднем при операции вводится 500 мл крови донора, выводится такое же количество крови ребенка (или на 50 мл меньше). Если после первого заменного переливания крови желтуха продолжает нарастать, уровень билирубина снова повышается до величин, близких к критическим, требуются повторные заменные переливания крови.
Для борьбы с гипербилирубинемией используют гемосорбцию, наибольшая эффективность которой отмечена при выполнении ее через 12-24 ч после заменного переливания крови в количестве 2 ОЦК.
Консервативное лечение гемолитической болезни включает внутривенное капельное введение белоксодержащих растворов с глюкозой (раствор альбумина 10%, фенобарбитал, зиксорин, после 5-7-го дня — карболен, витамин Е).
При развитии синдрома «сгущения желчи» необходимо назначить внутрь 5-10% раствор магния сульфата по 5 мл 2-3 раза в сутки, облучение ребенка лампами дневного света. Фототерапия — облучение ребенка источниками света с длиной волны 450 нм, что приводит к образованию изомера билирубина, растворимого в воде, поэтому легко элиминируемого из организма ребенка.
Кормление детей с гемолитической болезнью молоком матери можно начинать не ранее 5-10-го дня жизни. Дети, получившие лечение своевременно, в дальнейшем хорошо развиваются. При развитии ядерной желтухи в дальнейшем обнаруживается органическое поражение ЦНС, отставание в психическом развитии.
Профилактика. В настоящее время общепризнанна необходимость профилактического введения анти-О-гаммаглобулина после родоразрешения (постнатально) неиммунизированных Rh-отрицательных женщин по 300 мкг (1500 ME) в течение 48-72 ч, а также после проведения искусственного аборта, внематочной беременности и инвазивных манипуляций во время беременности. Такая тактика снижает вероятность развития иммунизации родильниц с 7,5%о до 0,2%о.
Возможность развития изоиммунизации во время беременности послужила основанием к изучению эффективности антенатального применения анти-D-иммуноглобулина. Исследования показали, что его профилактическое введение при сроке 28 и 34 недели беременности в дозе 150 мкг в сочетании с послеродовой профилактикой снижает вероятность изоиммунизации до 0,06%.
Дата: 2019-07-24, просмотров: 372.