Загальноклінічний аналіз крові полягає у визначенні кількості гемоглобіну, еритроцитів, тромбоцитів, лейкоцитів, розрахунку лейкоцитарної формули, визначенні швидкості осідання еритроцитів (ШОЕ), кольорового показника.
Не рекомендується брати кров на дослідження після психоемоційних та фізичних перевантажень, після приймання медикаментів, фізіотерапевтичних процедур, рентгенологічного та радіоізотопного обстеження. Кров на аналіз треба забирати вранці перед сніданком.
Кров беруть переважно з подушечки четвертого пальця лівої руки, проколовши шкіру одноразовою голкою.
Визначення кількості гемоглобіну. Для визначення кількості гемоглобіну використовують колориметр найпростішої будови – гемометр Салі. Метод ґрунтується на перетворенні гемоглобіну на солянокислий гематин, який розводять до кольору стандарту.
Останніми роками рівень гемоглобіну визначають за допомогою фотоелектроколориметра.
Норма гемоглобіну для чоловіків становить 132–164 г./л, для жінок – 115–145 г./л.
Визначення кількості еритроцитів. Проводиться за допомогою лічильної камери Горяєва з двома сітками, розмежованими глибокою поперечною канавкою. Камера дає змогу на одній сітці підраховувати кількість еритроцитів, на другій – лейкоцитів. Сітка Горяєва складається з 225 великих квадратів. Перед заповненням камери її покривне скельце необхідно добре вимити й просушити. Потім шліфоване покривне скельце притирають до камери так, щоб з'явилися райдужні, так звані ньютонові кільця, тільки за цієї умови зберігається необхідна висота та об'єм камери.
Методика визначення: у серологічну пробірку наливаємо 4 мл ізотонічного розчину натрію хлориду і 20 мкл крові. Кров, розведену в пробірці (1: 200), декілька разів струшують, тримаючи пробірку вертикально. Після цього кінчиком скляної палички беруть з пробірки краплю крові та вносять її під покривне скельце камери. Якщо однієї краплі для заповнення камери недостатньо, то слід узяти ще одну краплю. Еритроцити рахуємо (об'єктив 8х, окуляр 10х або 15х) у п'яти великих квадратах (5x16 = 80 малих), розташованих по діагоналі. Кількість еритроцитів в 1 мкл крові для всіх сіток розраховуємо за формулою
X = (а × 4000 × c) / b,
де X – кількість еритроцитів у 1 мкл крові; а – кількість еритроцитів, порахованих у певній кількості малих квадратів; b – кількість порахованих малих квадратів; с – ступінь розведення крові; 4000 – коефіцієнт для приведення результату до об'єму 1 мкл крові.
Визначення кількості лейкоцитів. Заповнення камери Горяєва та методика підрахунку формених елементів такі самі, як при визначенні еритроцитів.
Методика визначення. В аглютинаційну пробірку наливають 0,4 мл розчину оцтової кислоти. З пальця капілярною піпеткою від гемометра набирають 20 мкл крові і обережно видувають у пробірку з розчином оцтової кислоти, розведення 1: 20. Перед заповненням лічильної камери вміст пробірки необхідно ретельно змішати.
Піпеткою набираємо невелику кількість розведеної крові з пробірки і заповнюємо камеру. Після цього камеру залишаємо в стані спокою на 1,0 – 1,5 хв для осадження формених елементів і подальшого їх підрахування. Лейкоцити рахуємо у 100 великих або 160 малих квадратах (100 х 16). Наприклад, якщо у 1600 малих квадратах нараховано 125 лейкоцитів, а кров розведена 1: 20, то кількість лейкоцитів в 1 мкл становить:
(125 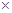 4000
4000 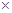 20)/1600 = 6250 в 1 мкл крові, або 6,25
20)/1600 = 6250 в 1 мкл крові, або 6,25 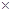 109/л.
109/л.
Лейкоцитарна формула. її розраховують у пофарбованих мазках крові на 100 лейкоцитів і подають у вигляді відсоткового співвідношення окре мих видів лейкоцитів. У здорових дорослих людей кількість різних видів лейкоцитів така: базофілів 0–1%, еозинофілів 0,5–5,0%, нейтрофілів паличкоядерних 1–6%, нейтрофілів сегментоядерних 47–72%, моноцитів 3–11%, лімфоцитів 19–37%.
Визначення швидкості осідання еритроцитів (ШОЕ). У капілярну піпетку Панченка набирають 5% розчин цитрату натрію до відмітки Р (50 мм) і видувають його у відалівську пробірку. Цим самим капіляром набирають кров із пальця до відмітки К і двічі змішують з розчином натрію цитрату в пробірці. Потім суміш насмоктують до відмітки 0, ставлять вертикально у штатив Панченкова і через годину відзначають висоту стовпчика плазми в міліметрах. У нормі ШОЕ у чоловіків 5–10 мм/год, у жінок – до 14–15 мм/год.
Дослідження сечі. Кількість виділеної за добу сечі в нормі у дорослої людини становить 1000–2000 мл, або в середньому 50–80% кількості спожитої рідини.
Забарвлення сечі коливається від світло-жовтого до насичено-жовтого і залежить від кількості пігментів – урохрому, уроеритрину. Інтенсивність забарвлення сечі залежить також від її питомої маси та кількості. У нормі сеча завжди прозора, її помутніння може бути спричинене надлишком солей, кліткових елементів, бактерій, жирів. У нормі реакція сечі при змішаному харчуванні кисла або слабокисла. Питома маса сечі залежить від кількості розчинених у ній речовин.
Визначення відносної густини сечі. Відносну густину сечі визначають за допомогою урометра. Найзручніший урометр з поділками від 1,000 до 1,050. Перевіряють показання урометра на дистильованій воді, яка за температури 4 °С має відносну густину 1,000.
Методика визначення. Сечу наливають у циліндр таким чином, щоб не утворилася піна. Урометр обережно занурюють у рідину так, щоб його верхня частина залишалася сухою. При цьому урометр повинен вільно плавати в рідині. Необхідно також ураховувати температуру навколишнього середовища. У нормі відносна густина сечі 1,010–1,025.
Визначення рН сечі за допомогою лакмусового тесту. Дослідження здійснюють за допомогою лакмусового паперу з діапазоном рН 0–12. Якщо лакмусовий папірець червоніє, то реакція сечі кисла, якщо синіє – реакція основна, якщо не змінюється – реакція нейтральна.
Якісна проба на білок. Якісна проба на білок ґрунтується на його осадженні деякими хімічними реактивами. Наприклад, за наявності в сечі білка вона помутніє, якщо додати до неї 20% сульфасаліцилової кислоти.
Методика визначення білка в сечі. Сеча повинна бути прозорою. Якщо вона мутна, то її слід профільтрувати через паперовий фільтр. Профільтровану прозору сечу наливаємо у дві пробірки по 4–5 мл, в одну з них додаємо 4–6 крапель реактиву. При позитивній пробі виявляється помутніння, яке чітко проглядається на темному фоні порівняно з другою пробіркою. У нормальній сечі міститься незначна кількість білка, яка не визначається якісними пробами.
Кількісне визначення білка в сечі. Методика визначення його. У пробірку наливаємо 1,0–1,5 мл азотної кислоти й обережно по стінці пробірки нашаровуємо сечу. Поява тонкого кільця через 2–3 хв на межі цих двох рідин свідчить про наявність у сечі 0,033 г./л білка. Надалі сечу розводимо залежно від властивостей отриманого кільця: якщо при нашаруванні відразу утворилося тонке ниткоподібне кільце, то сечу слід розвести в пропорції 1:2; якщо кільце широке, то сечу треба розвести в пропорції 1: 4, а при утворенні компактного кільця сечу розводимо в пропорції 1: 8. Якщо в розведеній у кілька разів сечі після її нашарування на азотну кислоту відразу не утворюється білкове кільце, то сечу слід розводити доти, доки кільце не з'явиться – через 2–3 хв. Щоб визначити кількість білка в сечі, необхідно 0,033 г./л помножити на величину розведення. Наприклад, якщо сечу розвели в 10 разів і білкове кільце утворилося наприкінці третьої хвилини, то кількість білка в цій сечі становитиме 0,033 х 10 = 0,33 г./л.
Якісне визначення глюкози в сечі. Останніми роками широко використовують експрес-метод визначення глюкози в сечі за допомогою реактивних папірців «Глюкотест», «Глюкофан», «Біофан-Г». Метод полягає в специфічному окисленні глюкози за допомогою фермента глюкозооксидази. Утворений при цьому пероксид водню розкладається іншим ферментом – пероксидазою та окислює вміщений барвник. Зміна забарвлення барвника свідчить про наявність у сечі глюкози.
Визначення кетонових тіл. До кетонових тіл належать ацетон, ацетооцтова і бета-оксимасляна кислоти, які в основному середовищі під впливом натрію нітропрусиду утворюють комплекс червоно-фіолетового забарвлення. Останнім часом користуються готовими наборами для експрес-аналізу ацетону в сечі.
Визначення білірубіну в сечі. Метод ґрунтується на здатності білірубіну під впливом йоду перетворюватися на білівердин, який має зелене забарвлення.
Методика визначення білірубіну в сечі. До 4–5 мл сечі обережно нашаровують по стінці 2–3 краплі 1% спиртового розчину йоду або розчину Люголя. При позитивному результаті на межі між рідинами з'являється зелене кільце. У нормі проба на білірубін у сечі від'ємна.
Визначення кількості формених елементів у сечі (за Нечипоренком). Методика визначення їх. Беремо разову порцію сечі (бажано вранішньої) у середині сечовипускання, визначаємо рН (при основній реакції може спостерігатися частковий розпад клітин). Потім 5–10 мл сечі центрифугуємо при 3500 об/хв протягом 3 хв, після чого відсмоктуємо верхній шар, лишаючи разом з осадом 0,5–1,0 мл сечі. Осад добре перемішуємо і заповнюємо камеру Горяєва. Формені елементи (лейкоцити, еритроцити, циліндри) підраховуємо у 100 великих квадратах камери з перерахунком за формулою:
Х= у × 250,
де X – кількість формених елементів в 1 мл сечі; у – кількість клітин у 100 великих квадратах камери Горяєва;
250 – коефіцієнт співвідношення об'єму підрахованих квадратів до 1 мл сечі.
Нормальний аналіз: лейкоцитів – до 4000, еритроцитів – до 1000 в 1 мл сечі. Циліндри в більшості випадків відсутні.
Дослідження шлункової секреції. Досліджувати шлункову секрецію можна методом зондування або беззондовим методом. Існує одномоментний спосіб дослідження шлункового вмісту після пробного сніданку (він малоінформативний) і багатомоментний (фракційний).
При фракційному методі шлунковий вміст отримують тонким зондом із використанням різноманітних пробних сніданків (спиртового, кофеїнового, капустяного тощо) або специфічних стимуляторів шлункової секреції (пентагастрину, гістаміну). Найчастіше застосовують солянокислий гістамін – 0,008 мл на 1 кг маси тіла (субмаксимальний гістаміновий тест) або 0,02 мл на 1 кг маси тіла (максимальний гістаміновий тест за Кеєм). Для запобігання побічним реакціям (тахікардія, алергія, судинна недостатність) за 30 хв перед уведенням гістаміну призначають підшкірно димедрол або супрастин. Останніми роками використовують пентагастрин, який уводять підшкірно (0,025% розчин) із розрахунку 6 мкг на 1 кг маси тіла хворого. Розрізняють два періоди фракційного дослідження секреції: дослідження базальної і стимульованої секреції.
Фракційне дослідження шлункової секреції з використанням гістаміну. Зонд уводять у шлунок натще. За допомогою шприца відсмоктують увесь вміст шлунка, який переливають в окремий посуд. Потім кожні 15 хв протягом години відсмоктують вміст шлунка (базальна секреція). Після одержання останньої порції базальної секреції хворому підшкірно вводять гістамін і через 15, ЗО, 45 і 60 хв відсмоктують шлунковий вміст (стимульована секреція). Секреторна активність шлунка в обох фазах секреції характеризується годинним напруженням, тобто кількістю соку, що виділився за годину. Кислотоутворювальну здатність оцінюють за кількістю соляної кислоти – дебітом соляної кислоти, який розраховують за годину секреції. Дебіт соляної кислоти в міліеквівалентах обчислюють за формулою
D = (А х В)/100,
де D – дебіт соляної кислоти; А – кількість шлункового соку в порції (за 15 хв), мл; В – концентрація вільної соляної кислоти або загальна кислотність у титраційних одиницях.
Щоб визначити дебіт соляної кислоти за годину, сумують її вміст у кожній порції. Для обчислення дебіту кислоти в міліграмах її вміст у міліеквівалентах множать на 36,5 – відносну молекулярну масу HCl.
Кількісне визначення загальної та вільної соляної кислоти. Метод ґрунтується на зміні кольору індикаторів залежно від pH середовища. Фенолфталеїн (індикатор загальної кислотності) у кислому середовищі безбарв ний, в основному – забарвлюється в червоний колір. Диметиламідоазобензол за наявності вільної соляної кислоти забарвлюється в червоний колір, а її відсутність дає жовте забарвлення. Реактиви: 1) індикатор для шлункового соку (однакова кількість 1% розчину фенолфталеїну і 0,5% розчину диметиламідоазобензолу); 2) 0,1 н. розчин їдкого натру.
Методика визначення. 5 мл профільтрованого шлункового соку з кожної порції наливають у пеніцилінові флакончики, після чого додають 1–2 краплі реактиву №1 і титрують 0,1 н. розчином їдкого натру, постійно перемішуючи суміш. Відзначають перший рівень при переході червоного кольору в жовто-рожевий. Кількість витраченої при цьому основи множать на 20, що відповідає кількості вільної соляної кислоти. Другий рівень фіксують при подальшому додаванні 0,1 н. розчину їдкого натру при переході жовтого кольору в стійкий рожевий. Кількість затраченої основи від початку титрування до появи рожевого кольору множать на 20, що відповідає загальній кількості.
Беззондовим методом досліджують кислотоутворювальну функцію шлунка за допомогою набору «Ацидотест». При цьому барвник, адсорбований на іонообмінній смолі, у кислому середовищі шлунка звільняється від неї в кількості, прямо пропорційній ступеню кислотності, і виділяється із сечею. За концентрацією виділеного із сечею барвника судять про ступінь кислотності шлункового соку. Цей метод використовують, коли зондове дослідження шлункового соку або неможливо, або важко здійснити (невропатія, серцева недостатність, гіпертонічна хвороба, тяжкі захворювання печінки, нирок тощо).
Тепер шлункову секрецію досліджують інтрагастральною рН-метрією з комп'ютерним обробленням результатів.
Дослідження вмісту дванадцятипалої кишки. Отримання дуоденального вмісту. Стерильний зонд даємо проковтнути хворому (кінець з оливою). Для цього оливу просуваємо до кореня язика, хворий при цьому глибоко дихає через ніс. Коли олива опиниться на корені язика, хворий повинен зробити кілька ковтальних рухів, внаслідок чого олива потрапить у стравохід. Надалі хворий просуває зонд самостійно, обережно підштовхуючи його до відмітки 60 см. На це піде 5–20 хв.
Перша порція жовчі (порція А, або дуоденальна жовч) золотисто-жовтого кольору, прозора. її збираємо 10–15 хв. Після цього вводимо 20‑ЗО мл 33% розчину магнію сульфату для скорочення жовчного міхура. Через 5–25 хв починає виділятися порція В темно-оливкового кольору (із жовчного міхура), її збираємо 10–25 хв у кількості ЗО‑50 мл. Потім з'являється жовч золотисто-жовтого кольору – порція С (печінкова жовч). Отриману жовч необхідно швидко обстежити, оскільки клітинні елементи руйнуються під впливом ферментів.
Характеристика порцій. Порції жовчі А і С у нормі мають золотисто-жовте забарвлення, а порція В-темно-оливкове. У нормі всі три порції прозорі. Відносна щільність порції А становить 1,001–1,015, порції В – 1,016–1,032, порції С – 1,007–1,010. Реакція порції А слабкоосновна, порцій В і С – основна. При запальних процесах жовчного міхура реакція стає кислою (рН 4,0 – 4,5).
У деяких лікарнях, крім звичайного (класичного), застосовують також багатомоментне дуоденальне зондування.
Мікроскопічне дослідження жовчі. Пастерівською піпеткою вибираємо з жовчі грудочки слизу. Крім цього, жовч центрифугуємо і з осаду робимо препарати для мікроскопування. У нормі жовч не містить ніяких клітинних елементів. При патології виявляються клітини (лейкоцити, лейкоцитоїди, еритроцити, епітеліальні та круглі клітини), кристалічні утворення (кристали холестерину, кальцію білірубінату), паразити (яйця глистів, вегетативні форми лямблій).
Дослідження калу. Свіжовиділений кал доставляють у лабораторію в сухому чистому посуді. Не можна брати кал на дослідження після клізм, приймання препаратів заліза, вісмуту, барію, беладони, уведення свічок, рицинової або вазелінової олії. Для дослідження калу на яйця глистів та найпростіших організмів невелику кількість калу, взятого з різних ділянок, розтирають на предметному склі в краплі 50% розчину гліцерину. З краплі роблять тонкий мазок, який потім мікроскопують. Насамперед мазок досліджують при малому збільшенні мікроскопа (об'єктив 10х, окуляр 10х), щоб орієнтуватися в мазку, а також не пропустити великих найпростіших, яких можна не помітити при середньому збільшенні мікроскопа. При певних навичках у мазку легко виявляють вегетативні форми та цисти найпростіших організмів.
Для визначення амеб рекомендується трохи підігріти предметне скло. При пошуках кишкових найпростіших не слід обмежуватись одноразовим обстеженням. У людини, зараженої найпростішими, бувають періоди (1 – 15 днів), коли виявити паразити у фекаліях звичайними методами не вдається. Тому остаточний негативний результат можна отримати лише після 4–5‑разового обстеження калу з проміжками 2–3 дні.
Дослідження калу на скриту кров. Це дослідження проводять після триденної дієти, яка виключає м'ясо, хлорофільні рослини, помідори. При цьому не можна приймати медикаментів, що містять залізо, мідь та інші важкі метали. Якісна проба на кров ґрунтується на пероксидазній дії гемоглобіну. Останнім часом використовують бензидинову пробу, яка найбільш чутлива і частіше дає позитивний результат з розведенням крові 1: 100 000, 1: 250 000. У нормі реакція на скриту кров негативна.
Дослідження мокротиння. Свіжовиділене мокротиння збирають у сухий, чистий, знезаражений спеціальний посуд, який щільно закривають. Збирати його необхідно вранці перед сніданком. Знезаражують матеріал розчином хлораміну протягом 4 год.
Спочатку описують фізичні властивості мокротиння: колір, запах, особливості, консистенцію, пошаровий розподіл. Колір: сіруватий від слизу і гною; червонуватий або іржавий за наявності в ньому крові; сірий і чорний є ознакою забруднення повітря вугіллям та пилом.
Запах: гнильний при гангрені, розпаді пухлини; неприємний – при абсцесі легень. У інших випадках свіжовиділене мокротиння без запаху. Особливості мокротиння: слизисте, слизисто-гнійне, кров'янисте, кров'янисто-слизисте. Консистенція мокротиння: рідке, напіврідке, в'язке, напівв'язке.
Для мікроскопічного обстеження з різних місць мокротиння беруть слизові та кров'янисті грудочки. Отриманий матеріал змішують на предметному склі, накривають покривним скельцем і розглядають під мікроскопом.
У нормі в мокротинні знаходять лейкоцити, клітини плоского епітелію, альвеолярні макрофаги, поодинокі клітини війчастого епітелію, еритроцити. За різних патологічних станів знаходять велику кількість лейкоцитів, еритроцитів, еозинофілів, клітин війчастого епітелію, еластичних волокон, спіралей Куршмана. Із кристалічних утворень виявляють кристали Шарко–Лейдена, холестерину, гематоїдину. При застійних явищах у легенях, інфаркті легень, крововиливах знаходять альвеолярні макрофаги, що містять гемосидерин.
Дослідження мокротиння на мікобактерії туберкульозу. Методика фарбування за Цілем–Нільсеном. Беруть матеріал із гнійних ділянок мокротиння і готують тонкі мазки, які висушують на повітрі й фіксують над полум'ям пальника. Препарати кладуть на скляні містки, накривають фільтрувальним папером (розмір – менше від предметного скла) і поливають розчином карболового фуксину (1 г в 100 мл етилового спирту +100 мл 5% карболової кислоти). Препарат нагрівають над полум'ям пальника до утворення пари, дають йому охолонути, після чого фільтрувальний папір скидають і занурюють препарат у солянокислий спирт для знебарвлення. Промивають водою і дофарбовують 0,5% водним розчином метиленового синього протягом 20–30 с. Мікобактерії туберкульозу забарвлюються у червоний колір, а інші елементи мокротиння і бактерії – у синій.
Дослідження мокротиння на елементи астми. При бронхіальній астмі в мокротинні можна знайти спіралі Куршмана і кристали Шарко–Лейдена. Спіралі Куршмана щільні, закручені слизовими утвореннями, центральна частина яких різко заломлює світло і має вигляд блискучої спіралі. При мікроскопії мокротиння їх виявляють на темному фоні. Кристали Шарко–Лейдена мають вигляд витягнутих блискучих ромбів різної величини; їх утворення пов'язують із руйнуванням еозинофілів і часто знаходять у щільних товстуватих грудочках мокротиння. Для виявлення еозинофілів необхідно зі щільних жовтуватого кольору грудочок мокротиння приготувати тонкі мазки, які висушують і фарбують за Паппенгаймом, як і кров, і розглядають під імерсійним об'єктивом.
Усі згадані лабораторні методи обстеження хворого входять до професіограми медичної сестри.
Дата: 2019-05-29, просмотров: 296.