В лужному середовищі перманганат калію відновлюється до манганату К2MnO4, який в розчині самовільно розпадається на перманганат калію і той же нерозчинний осад двоокису марганцю. Титрування в слабокислих, нейтральних та лужних середовищах проводять лише з метою визначення марганцю (ІІ) та в деяких інших випадках.
№ 139
Розрахувати нормальність, молярність, титр розчину KMnO4, якщо на титрування 20 мл 0,0497 н розчину H2C2O4 витрачено 18,6 мл розчину KMnO4
З закону еквівалентів знайдемо:
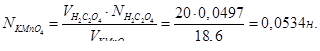
Дана реакція йде за рівнянням: MnO4‾ + 8H+ + 5e‾ = Mn2+ + 4H2O
Очевидно, що моль-еквівалент KMnO4 в даному випадку рівний 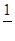 його молярної маси. Отже, шукана молярність буде
його молярної маси. Отже, шукана молярність буде 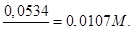
Титр обчислимо із співвідношення:
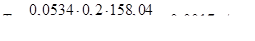
№ 140
Розрахувати нормальність, молярність, титр розчину щавлевої кислоти, одержаної розчиненням 1,7334 г кислоти в мірній колбі ємністю 250 мл. Скільки мл цього розчину піде на титрування 25,00 мл 0,0912 н розчину КMnO4?
Молекулярна формула кристалогідрату щавлевої кислоти H2С2O4∙2H2O. Молярна маса її становить
МH2C2O4∙2H2O = 2+12∙2+16∙4+2(2+16) = 126 г/моль.
Щавлева кислота є двоосновною, тому моль-еквівалент її рівний ½ моль, а еквівалентна маса становить
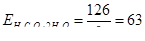 г/моль-екв.
г/моль-екв.
Кількість моль-еквівалентів щавлевої кислоти, що містяться в 1000 мл розчину:
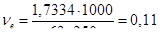 моль-екв.
моль-екв.
Отже, нормальність отриманого розчину NH2C2O4∙2H2O = 0,11н.
Кількість молей щавелевої кислоти, що містяться в 1000 мл розчину:
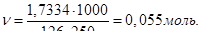
Тому, молярність розчину СМ = 0,055 М.
Титр розчину щавлевої кислоти знайдемо із співвідношення:
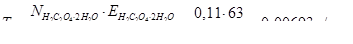
Об’єм розчину щавлевої кислоти, що піде на титрування 25,00 мл 0,0912 н розчину КMnO4 буде
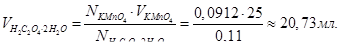
№ 141-142
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів:заліза (ІІ)
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу.
Залізо (ІІ) визначають методом перманганатометрії. Загальна характеристика: титрування робочим розчином перманганату калію, тобто розчином, нормальність якого була попередньо встановлена за щавелевою кислотою.
Метод застосовується головним чином для визначення заліза в рудах, силікатах і шлаках з великим вмістом заліза. Для переведення заліза в розчин ці матеріали безпосередньо оброблюють кислотами, а ті, що не розчиняються в кислотах, спочатку сплавляють з карбонатом натрію або іншими речовинами. Після такої обробки звичайно утворюється хлорид заліза(ІІІ). Тому перед титруванням розчином перманганату калію залізо (ІІІ) відновлюють до заліза (ІІ). Для відновлення застосовують гази, розчини відновників або тверді речовини. Відновлені іони заліза титрують робочим розчином перманганату калію. Після цього вміст заліза (ІІ) визначають за відповідною розрахунковою формулою.
№ 143
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: міді (ІІ)
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу.
Мідь (ІІ) визначають йодометрією . В основу йодометричного визначення міді (ІІ) покладено окислювальну дію іонів міді (ІІ) відносно іонів йоду.
При взаємодії солей міді з йодидом калію мідь (ІІ) відновлюється до міді (І) з утворенням нерозчинного йодиду міді і виділенням вільного йоду, який потім титрують розчином тіосульфату натрію:
2CuSO4 + 4KI → 2CuI↓ + 2K2SO4 + I2
I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
Після титрування вміст міді розраховують за відповідною формулою. Варто зазначити, що йодометричне визначення міді дуже точне.
№ 144
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: нітритів
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу.
Цей метод – перманганатометрія. Загальна характеристика: титрування робочим розчином перманганату калію, тобто розчином, нормальність якого була попередньо встановлена за щавлевою кислотою.
В основі кількісного визначення нітритів є реакція окислення останніх перманганатом калію у присутності сірчаної кислоти. Сірчана кислота, будучи сильною, витісняє слабшу азотисту кислоту, яка, будучи дуже нестійкою, розкладається на оксиди азоту. Побічні реакції виділення азотистої кислоти та її розкладання на оксиди азоту є причиною того, що пряме титрування розчинів нітритів в сірчанокислому середовищі не дає правильних результатів. Тому застосовується інша техніка.
До відміряної кількості робочого розчину перманганату калію добавляють розведену сірчану кислоту, суміш нагрівають і доливають до неї нейтральний розчин нітриту з таким розрахунком, щоб після повного окислення в розчині був ще певний надлишок KMnO4. За вказаних умов оксиди азоту не виділяються в повітря, бо в розчині весь час є великий надлишок KMnO4, який повністю окислює азотисту кислоту. Таким чином, реакція йде за рівнянням:
2KMnO4 + 5NaNO2 + 3H2SO4 → 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O.
Після вищезазначених процесів вміст нітритів обчислюють за відповідною формулою.
№ 145-146
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води грунтів або інших об’єктів: солей кальцію і магнію (тимчасової твердості води)
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу
Тимчасова твердість води зумовлена вмістом у воді бікарбонатів кальцію і магнію. Виявити, рівно як і позбутися її, можна процедурою кип’ятіння. При цьому йде реакція:
Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O
Після цього вміст бікарбонатів обчислюють за відповідною формулою.
№ 147
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: солей кальцію і магнію (постійної твердості води)
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу. Постійну твердість води визначають комплексонометрією. В основі комплексонометричного визначення постійної твердості води лежить титрування відміряного об’єму води 0,1 н розчином трилону Б в присутності індикатора хромогену чорного спеціального (ЕТ-00). Для визначення беруть таку кількість води, щоб загальний вміст солей кальцію і магнію, по можливості, не перевищував 0,5 мг-екв. Так як 1 мл 0,1 н розчину трилону Б відповідає 0,1 мг-екв, на титрування має витрачатись не більше 5 мл 0,1 н розчину трилону.
Пробу води розводять дистильованою водою приблизно до 100 мл, доливають 5 мл буферного розчину (суміш NH4Cl і NH4OH), після чого добавляють краплинами індикатор до утворення помітного винно-червоного забарвлення. Потім титрують розчином трилону Б до переходу забарвлення в синє із зеленуватим відтінком. І нарешті, обчислюють вміст солей кальцію і магнію (мг-екв) за формулою:
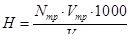
де Nтр – нормальність розчину трилону; Vтр – об’єм розчину трилону, витраченого на титрування води; Vводи – об’єм взятої для аналізу води.
№ 148
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: фосфору
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу
Фосфор визначають двома ваговими методами. Один з них – цитратний. Суть методу в тому, що фосфор осаджують у вигляді магній-амоній фосфату. Прожарюючи осад, дістають пірофосфат магнію, за масою якого знаходять вміст фосфору. Метод дістав свою назву від того, що іони металів утримують в розчині за допомогою цитратної кислоти.
Інший метод – молібдатний. Суть методу в тому, що фосфор осаджують у вигляді фосфорно-молібденовокислого амонію (NH4)3[P(Mo3O10)4]. Цей осад фільтрують крізь скляний фільтр, висушують і зважують.
Вміст фосфорного ангідриду обчислюють за відповідними розрахунковими формулами.
№ 149
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: оцтової кислоти. Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу
Оцтову кислоту визначають методом нейтралізації. Фактично відбувається титрування слабкої оцтової кислоти сильною основою NaOH. При цьому йде реакція:
CH3COOH + NaOH ↔ CH3COONa + H2O
Для визначення концентрації оцтової кислоти зважують бюкс з притертою кришкою, в який наливають 5–10 мл води. Потім у бюкс наливають 1–1,5 мл оцтової кислоти, закривають кришкою, знову зважують, розчин переносять у колбу об’ємом 250 мл, доводять до риски і перемішують. У конічній колбі на 150–200 мл піпеткою беруть по 25 мл титрованого розчину NaOH, добавляють по 1–2 краплинах фенолфталеїн і титрують приготовленим розчином оцтової кислоти. Нарешті, вміст оцтової кислоти розраховують за відповідною формулою.
№ 150
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: гідроксиду натрію. Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу
Застосовуваний метод має назву метод нейтралізації. Загальна характеристика: кислотно-основне титрування до досягнення точки еквівалентності, тобто моменту, коли кількості двох реагуючих речовин стануть еквівалентними.
Для визначення гідроксиду натрію у закритому бюксі зважують 0,8–1,2 г препарату, наважку переносять у вимірювальну колбу на 250 мл, розчиняють у воді, з якої видалено вуглекислоту, об’єм доводять до риски і добре перемішують. Беруть кілька проб по 250 мл, добавляють 1–2 краплі фенолфталеїну і титрують робочим розчином HCl (нормальність якого була попередньо встановлена за бурою) до знебарвлення розчину. Після цього вміст NaOH обчислюють за відповідною розрахунковою формулою.
Література
1) І.В. П’ятницький “Аналітична хімія”, Київ, Вища школа, 1969;
2) И. Шапиро, В. Шапиро “Аналитическая химия”, М.,Наука, 1978
Дата: 2019-05-29, просмотров: 313.