Кількісне визначення хімічними методами складається з трьох основних етапів. Перший етап – відмірювання певної кількості речовини для аналізу, для чого речовину зважують або вимірюють об’єм розчину. Другий етап – проведення реакції, внаслідок якої визначуваний компонент перетворюється в сполуку з певними хімічними та фізичними властивостями. Третій етап – вимірювання показника якоїсь фізичної властивості системи, за величиною якого роблять висновок про кількість визначуваної речовини.
Перша група методів кількісного хімічного аналізу включає методи, в основу яких покладено вимірювання показника властивості продукту реакції. До цієї групи відносять: а)ваговий аналіз; б)колориметричний аналіз.
У ваговому аналізі вимірюють вагу продукту реакції. На першому етапі відмірюють певну кількість речовини для аналізу зважуванням або вимірюванням об’єму розчину. Другий етап – за допомогою певних хімічних реактивів проводять реакцію осадження визначуваного компонента. Третій етап – відокремлення утвореного осаду від розчину і зважування осаду.
Колориметричний аналіз складається з двох стадій – утворення (руйнування) забарвленої сполуки і вимірювання інтенсивності утвореного забарвлення.
Друга група методів кількісного хімічного аналізу включає методи, в основу яких покладено вимірювання кількості реактиву, витраченого на взаємодію з визначуваним компонентом. До цієї групи належить об’ємний аналіз з його підрозділами.
За типом реакції розрізняють такі підрозділи об’ємного аналізу:
1) метод кислотно-основного титрування, в основі якого лежить реакція між іонами Н+ та OH– з утворенням малодисоційовних молекул H2O. Розчин кислоти титрують розчином основи або навпаки до точки еквівалентності, за якою обчислюють концентрацію, а значить і кількість визначуваної речовини;
2) метод осадження і комплексоутворення, основним етапом якого є переведення визначуваної речовини в осад або в комплексну сполуку;
3) метод окислення-відновлення, який налічує багато підметодів, проте суть єдина – на етапі проведення реакції змінюються ступені окислення реагуючих речовин.
Третя група методів кількісного хімічного аналізу ґрунтується на вимірюванні змін властивості самого визначуваного компонента, зумовлених зв’язуванням його реактивом у певну хімічну сполуку. До цієї групи відносять також газовий аналіз.
Прикладом є визначення кисню в повітрі. Відмірюють певний об’єм повітря і пропускають його через розчин пірогалолу, який вбирає кисень. Внаслідок вбирання кисню об’єм проби повітря зменшується. Вимірюють об’єм повітря, що залишилось після реакції. За різницею вказаних об’ємів обчислюють кількість речовини кисню у взятому об’ємі повітря, або об’ємний процентний його вміст.
№ 102
Розкрити суть гравіметричного аналізу
У гравіметричному аналізі визначуваний компонент зразка виділяють з розчину у вигляді осаду відомого хімічного складу, потім, знаючи масу отриманого осаду, обчислюють кількість даного компоненту аналізованої речовини.
№ 103
Викласти суть титрометричного аналізу
Основною операцією титрометричного аналізу є вимірювання об’єму робочого розчину, витраченого на взаємодію з розчином визначуваної речовини (об’єм розчину останньої має бути відомим).
Робочий розчин доливають до аналізованого розчину (титрують) до досягнення точки еквівалентності, тобто моменту, коли кількості двох реагуючих речовин стануть еквівалентними. Точку еквівалентності зручно встановлювати за кольоровими індикаторами.
Нормальність розчину визначуваної речовини знаходять за законом еквівалентів, а кількість речовини – з рівнянь реакцій та за допомогою відповідних розрахункових формул.
№ 104
Навести класифікацію методів титрометричного аналізу
За типом реакції розрізняють такі методи титрометричного аналізу:
1) метод нейтралізації;
2) метод осадження і комплексоутворення;
3) методи окислення-відновлення.
Третя група методів титрометричного аналізу має такі основні підгрупи:
а) перманганатометрія;
б) йодометрія;
в) хроматометрія.
Перша і друга групи методів теж мають свої підгрупи.
За способом встановлення точки еквівалентності методи об’ємного аналізу класифікують так:
а) визначення з кольоровими індикаторами;
б) потенціометрія;
в) кондуктометрія;
г) амперометрія.
№ 105
Дати обґрунтовану відповідь щодо вимог, які висуваються до хімічних реакцій у титрометричному аналізі
Основні вимоги наступні:
1) реакції мають йти до кінця і стехіометрично;
2) кінець реакції має бути добре помітним за зміною окраски розчину чи за зміною забарвлення індикатора;
3) концентрація стандартного розчину має бути відома з високою точністю (від цього майже цілком залежить точність визначення кількості аналізованої речовини);
4) інші речовини, які є в розчині, не повинні заважати основній реакції.
№ 106
Навести визначення та дати пояснення щодо основних понять і термінів титрометричного аналізу: робочі розчини, фіксанали (стандарт- титри)
Розчин реактиву відомої концентрації називають робочим або титрованим розчином.
Стандарт-титр або фіксанал – це точна наважка сухої вихідної речовини, або точно відмірений об’єм розчину відомої концентрації, запаяні в скляну ампулу.
№ 107
Навести визначення та дати пояснення щодо основних понять і термінів титрометричного аналізу: вихідні речовини та вимоги, яким вони повинні відповідати
Хімічні сполуки, придатні для приготування титрованих розчинів називають вихідними речовинами.
Вимоги до вихідних речовин:
1. Відповідність дійсного складу речовини її хімічній формулі, тобто чистота препарату. Це означає, що:
а) вихідні речовини мають бути класу чистоти не нижче ЧДА (чистий для аналізу);
б) вихідні речовини не повинні бути гігроскопічними (навіть під час зважування NaOH настільки енергійно вбирає воду, що це робить сам вказаний процес практично нездійсненним);
в) хоча допустимо, але небажано, щоб вихідні речовини містили кристалізаційну воду.
2. Розчини вихідних речовин мають бути стійкими і концентрація таких розчинів не повинна змінюватись під впливом зовнішніх умов.
№ 108
Навести визначення та дати пояснення щодо основних понять і термінів титрометричного аналізу: титрування, точка еквівалентності
Титрування – це поступове доливання робочого розчину до розчину визначуваної речовини до досягнення точки еквівалентності.
Точка еквівалентності – момент, коли кількості двох реагуючих між собою речовин стануть еквівалентними.
№ 109
Навести визначення та дати пояснення щодо основних понять і термінів титрометричного аналізу: індикатори, помилки титрування
Як відомо, у титрометричному аналізі до розчину одного компонента додають розчин другого компонента до досягнення точки еквівалентності. Для визначення кінця титрування використовують індикатори. Практично неможливо підібрати індикатор, який показував би кінець титрування в точці еквівалентності. Через це визначають так звану кінцеву точку титрування, тобто кінець титрування, визначений індикатором. Чим більше кінцева точка титрування і точка еквівалентності відрізняються між собою, тим більша помилка титрування.
Індикатори є слабкими органічними кислотами або основами, молекулярна форма яких має інше забарвлення, ніж іонна. Індикатори бувають одноколірні і двоколірні. Одноколірні індикатори безбарвні в молекулярній формі і забарвлені в іонній формі. Двоколірні – забарвлені в різні кольори як в молекулярній, так і в іонній формах.
Залежно від константи дисоціації КНIn індикатори поділяють на сильні, проміжні та слабкі.
Сильні індикатори характеризуються величиною КНIn > 10–7 і змінюють забарвлення в кислому середовищі при рН < 7. Типовий представник – метилоранж, забарвлення якого змінюється в межах 3,4 < pH < 4,3.
Проміжні індикатори змінюють забарвлення при рН ≈ 7. Типовим представником є лакмус, що змінює забарвлення при 6,8 < рН < 7,2.
Слабкі індикатори змінюють забарвлення в слабколужному середовищі. Типовий представник – фенолфталеїн, який безбарвний при рН < 8 і червоний при рН > 8.
Основними причинами помилок титрування є відхилення показника титрування рТ індикатора від рН точки еквівалентності і не досить різка зміна кольору індикатора біля точки еквівалентності.
Наприклад, при титруванні сильної основи сильною кислотою помилка титрування суть відношення об’єму витраченої на титрування кислоти до об’єму взятого розчину лугу.
При титруванні слабкої кислоти лугом помилка титрування є відношення концентрацій розчинів невідтитрованої і відтитрованої кислоти. Крім цього, в даному випадку помилку титрування можна виразити так:
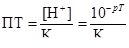 , де Kкисл – константа дисоціації кислоти.
, де Kкисл – константа дисоціації кислоти.
При титруванні солей слабких кислот
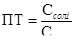 , де Ссолі і Скисл
, де Ссолі і Скисл
відповідно нормальні концентрації солі і кислоти.
№ 110
Навести визначення та дати пояснення щодо основних понять і термінів титрометричного аналізу: мірний посуд, який застосовують у титрометричному аналізі та правила користування ним
В титрометричному аналізі для точного вимірювання об’ємів рідини застосовують мірні колби, піпетки і бюретки.
Мірні колби застосовують для приготування розчинів і для відмірювання певного об’єму рідини. Колбу перед використанням добре миють. Розчини готують, висипаючи наважку реактиву в колбу, доливають розчинник приблизно до ½ її об’єму, дають реактиву розчинитись, потім доливають цей же розчинник до мітки. Певний об’єм рідини відмірюють аналогічно, заповнюючи колбу до мітки. Доводять об’єм рідини до мітки в обох випадках так, щоб нижній край меніску був на рівні мітки колби. Очі спостерігача теж мають бути на рівні мітки.
Піпетки використовують для відбору певного об’єму рідини. Звичайна піпетка – це скляна трубка з розширенням посередині. Нижній кінець витягнуто в капіляр. На верхньому кінці є мітка, до якої слід набирати рідину, яку відмірюють. Перед використанням піпетку добре миють хромовою сумішшю, споліскують спочатку дистильованою водою, потім розчином, яким будуть її наповнювати.
Бюретки застосовують для відмірювання точних об’ємів рідини. Бюретка являє собою вузьку циліндричну трубку. Є бюретки, оснащені затискачем, а є оснащені внизу краном.
Нульова мітка шкали розміщена вгорі трубки. Бюретки градуюють вниз від нульової мітки на десяті долі мілілітра. Перед використанням бюретку добре миють хромовою сумішшю, споліскують 2-3 рази дистильованою водою, потім розчином, яким будуть її наповнювати. В роботі бюретку закріплюють на штативі у вертикальному положенні і заповнюють потрібним розчином трохи вище нульової мітки. Потрібно слідкувати, щоб в капілярі крана, в гумовій трубці і в наконечнику не було повітря.
Відкривають кран або відпускають затискач. Об’єм рідини, що витекла з бюретки, відраховують по меніску, що рухатиметься вниз по шкалі. Темні і світлі рідини бажано відмірювати по різним краям меніска, проте в будь-якому разі відмірювання слід проводити по якомусь одному (верхньому або нижньому) краю. Очі спостерігача мають бути на рівні меніска. Відмірявши певний об’єм, закривають кран або затискач.
№ 111-112-113
Розкрити суть титрометричних визначень методом нейтралізації
Основною реакцією методу є реакція нейтралізації – взаємодія кислоти і основи: Н+ + ОН‾ → Н2О
Стандартними розчинами в розглядуваному методі є розчини кислот і основ. Фактично це титрування розчину кислоти розчином лугу або навпаки до досягнення точки еквівалентності – моменту, коли кількості добавленого і взятого компонентів стануть еквівалентними. Точку еквівалентності найзручніше визначати за кольоровими індикаторами. Нормальності розчинів встановлюють за законом еквівалентів. Кількість речовини визначають за рівняннями реакцій та за розрахунковими формулами.
Головним чином метод нейтралізації застосовують для кількісного визначення кислот і основ. Даним методом можна визначати, наприклад, жорсткість води, концентрацію солей амонію та солей слабких кислот.
№ 114-115-116
Розкрити суть перманганатометрії
Перманганатометрія – один з методів об’ємного аналізу (підгрупа методів окислення-відновлення), в якому речовину визначають титруванням розчином перманганату калію.
У кислому середовищі основна реакція методу йде за рівнянням:
MnO4‾ + 8H+ + 5e‾ → Mn2+ + 4H2O
У слабокислих або лужних розчинах перманганат відновлюється до Mn4+, який випадає у вигляді нерозчинного осаду двоокису марганцю:
MnO4‾ + 4H+ + 3e‾ → MnO2↓ + 2H2O
Метод застосовують для визначення багатьох відновників, серед них Fe2+, Sn2+, Mn2+, V4+, U4+.
При титруванні розчином перманганату калію звичайно не застосовують ніяких спеціальних індикаторів. Точку еквівалентності встановлюють за рожевим забарвленням, яке виникає від невеликого надлишку добавленого розчину KMnO4. Отже, індикатором є сам робочий розчин. Оскільки препарат KMnO4 не має властивостей вихідної речовини через значну кількість домішок двоокису марганцю, нормальність розчину перманганату калію встановлюють за щавлевою кислотою.
№ 117-118
Розкрити суть йодометрії
Йодометрія – один з методів об’ємного аналізу, в основі якого лежить вимірювання кількості йоду, що витрачається на окислення відновників або виділяється при взаємодії окисників з розчином йодиду калію.
Основна реакція методу йде за рівнянням:
I2 + 2е– ↔ 2I‾
Особливість даного методу – можливість досить точно встановити точку еквівалентності, що пов’язано з використанням чутливого специфічного індикатора – розчину крохмалю (вже 0,00001 н. розчини йоду утворюють з крохмалем помітно синє забарвлення).
№ 119-120
Розкрити суть комплексонометрії
Комплексонометрія – один з методів об’ємного аналізу, в якому речовину визначають титруванням трилоном Б (динатрієва сіль етилендиамінтетраоцтової кислоти). Характерними особливостями методу, можна сказати, його перевагами є те, що трилон Б реагує з катіонами дуже багатьох металів, в тім числі лужно-земельних, що дозволяє застосовувати даний метод для визначення постійної твердості води. Крім того, 1 г-іон комплексону завжди реагує з 1 г-іоном металу у випадку всіх дво- і тривалентних металів. Під час реакції не утворюється ніяких побічних продуктів, присутність яких ускладнює визначення.
№ 121
Дати загальну характеристику методу нейтралізації
Основною реакцією методу є реакція нейтралізації – взаємодія кислоти і основи: Н+ + ОН‾ → Н2О
Стандартними розчинами в розглядуваному методі є розчини кислот і основ. Фактично це титрування розчину кислоти розчином лугу або навпаки до досягнення точки еквівалентності – моменту, коли кількості добавленого і взятого компонентів стануть еквівалентними. Точку еквівалентності найзручніше визначати за кольоровими індикаторами. Нормальності розчинів встановлюють за законом еквівалентів. Кількість речовини визначають за рівняннями реакцій та за розрахунковими формулами.
Головним чином метод нейтралізації застосовують для кількісного визначення кислот і основ. Даним методом можна визначати, наприклад, жорсткість води, концентрацію солей амонію та солей слабких кислот.
№ 122
Навести приклади робочих розчинів методу нейтралізації. Які вихідні речовини застосовують для встановлення нормальності робочих розчинів?
Робочими розчинами методу нейтралізації є розчини кислот і основ. Переважно застосовуються розчини соляної, сірчаної та азотної кислот, розчини гідроксиду натрію і гідроксиду калію.
Методи встановлення нормальності робочих розчинів приведу для HCl і NaOH: нормальність розчину соляної кислоти встановлюють за бурою, а нормальність розчину гідроксиду натрію встановлюють за щавелевою кислотою.
№ 123
Дати обґрунтовану відповідь, чи можна приготувати титрований робочий розчин гідроксиду натрію, виходячи з точної наважки речовини NaOH
Не можна. Тому що, по-перше, луги дуже важко дістати в чистому вигляді. При їх виготовленні (а особливо при зберіганні) завжди утворюється певна кількість соди в результаті поглинання CO2 з повітря. По-друге, луги містять воду та інші домішки.
У нашому випадку препарат NaOH надзвичайно гігроскопічний. Вже під час зважування на аналітичних терезах їдкий натр настільки сильно поглинає воду, що це робить сам процес зважування практично неможливим, не говорячи вже про приготування титрованого розчину.
№ 124
Дати обґрунтовану відповідь, чи можна приготувати титрований робочий розчин соляної кислоти, виходячи з точного об’єму розчину HCl відомої концентрації
Не можна. Тому що, по-перше, точна концентрація кислот звичайно невідома. По-друге, концентрована соляна кислота дуже легко втрачає хлороводень у вигляді газу (випаровується), а це означає, що її концентрація змінюється.
№ 125
Описати основні етапи визначення концентрації робочих розчинів у методі нейтралізації. Скласти рівняння реакцій, які відбуваються при визначенні концентрації НCl
Для встановлення нормальності розчинів сильних кислот найчастіше використовують буру, а для встановлення нормальності розчину лугу – щавлеву кислоту. Основні етапи визначення концентрації робочих розчинів наступні.
1. Перекристалізація бури і щавлевої кислоти. При зберіганні ці препарати втрачають певну кількість води, тому їх треба перекристалізовувати навіть тоді, коли за чистотою вони цілком придатні для роботи.
2. Приготування робочого розчину сильної кислоти або лугу. Звичайно готують 1 л 0,1 н розчину, нормальність якого відома приблизно.
3. Приготування розчину вихідної речовини. Це розчин бури у випадку встановлення нормальності розчину сильної кислоти і розчин щавлевої кислоти у випадку встановлення нормальності розчину лугу.
4. Проведення реакції титрування. У нашому випадку при визначенні концентрації розчину НCl йде реакція:
Na2В4O7 + 2НCl + 5H2O → 4Н3ВО3 + 2NaCl
5. Визначення нормальності розчину кислоти за формулою:
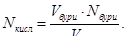
№ 126
Описати основні етапи визначення концентрації робочих розчинів у методі нейтралізації. Скласти рівняння реакцій, які відбуваються при визначенні концентрації NaOH
Для встановлення нормальності розчинів сильних кислот найчастіше використовують буру, а для встановлення нормальності розчину лугу – щавлеву кислоту. Основні етапи визначення концентрації робочих розчинів наступні.
1. Перекристалізація бури і щавлевої кислоти. При зберіганні ці препарати втрачають певну кількість води, тому їх треба перекристалізовувати навіть тоді, коли за чистотою вони цілком придатні для роботи.
2. Приготування робочого розчину сильної кислоти або лугу. Звичайно готують 1 л 0,1 н розчину, нормальність якого відома приблизно.
3. Приготування розчину вихідної речовини. Це розчин бури у випадку встановлення нормальності розчину сильної кислоти і розчин щавелевої кислоти у випадку встановлення нормальності розчину лугу.
4. Проведення реакції титрування. У нашому випадку при визначенні концентрації розчину NaOH йде реакція:
H2С2O4 + 2NaOH → Na2С2O4 + 2H2O
Проте, цей метод встановлення нормальності розчину лугу можна застосовувати лише у випадках коли в останньому немає карбонатів. Якщо в розчині лугу присутні карбонати, то іони С2O42– осаджують хлоридом кальцію. Соляну кислоту, яка при цьому звільняється, титрують лугом у присутності метилоранжу:
Na2С2O4 + СаCl2 ↔ СаС2O4↓ + 2NaCl
H2С2O4 + СаCl2 ↔ СаС2O4↓ + 2НCl
НCl + NaOH → NaCl + H2O
2НCl + Na2CO3 → 2NaCl + CO2↑ + H2O
Проводять 3–4 титрування і за середнім значенням обчислюють нормальність розчину лугу. Крім того, для встановлення нормальності розчину лугу можна використати титрований розчин НCl. Тоді нормальність лугу обчислюють за формулою:
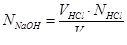
Однак, точність в даному випадку буде нижча.
№ 127
Розрахувати нормальність, молярність, титр розчину HCl, якщо на титрування 25 мл 0,0936 н розчину бури витрачено 21,4 мл розчину HCl
Реакція йде за рівнянням:
2HCl + Na2B4O7 + 5H2O → 4H3BO3 + 2NaCl
Зі співвідношення закону еквівалентів
Vбури∙Nбури = VHCl∙NHCl
знайдемо нормальність соляної кислоти:
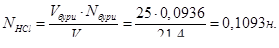
В даному випадку моль-еквівалент соляної кислоти рівний 1 молю, отже, молярність HCl становить
СМ = 0,1093 М.
Титр знайдемо із співвідношення
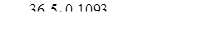
№ 128
Зазначити основні індикатори методу нейтралізації. Пояснити, що таке інтервал переходу та показник титрування індикатора
Основні індикатори методу показник нейтралізації:
Титрування (рТ)
метиловий фіолетовий (І перехід) 1
тимоловий синій (І перехід) 2
метиловий фіолетовий (ІІ перехід) 2,5
метилоранж 4
бромфенол синій 4
метиловий червоний 5
лакмус 7
нейтральний червоний 7
феноловий червоний 8
тимоловий синій (ІІ перехід) 9
фенолфталеїн 9
тимолфталеїн 10
Інтервал рН, в межах якого відбувається помітна для людського ока зміна забарвлення індикатора, називають інтервалом переходу індикатора.
У межах інтервалу переходу індикатора є значення рН, при якому спостерігається найбільш помітна для людського ока зміна кольору індикатора. Це значення рН називають показникомтитрування індикатора (позначають рТ).
№ 129
Дати мотивовану відповідь, для чого застосовують індикатори та як їх вибирають
Індикатори в титрометричному аналізі і в його підрозділі – методі нейтралізації використовують для встановлення точки еквівалентності за різкою зміною кольору індикатора, яка повинна спостерігатись поблизу точки еквівалентності і в самій цій точці. Однак, таким методом встановити точку еквівалентності можна лише з певною точністю, так як, по-перше, показник титрування рТ вибраного індикатора і рН розчину в точці еквівалентності можуть суттєво відрізнятись; по-друге, не всякий індикатор різко змінює колір у вказаній точці.
Умовою правильного вибору індикатора, а значить, і умовою найбільш точного визначення точки еквівалентності, є те, щоб різниця значень рТ індикатора і рН розчину в точці еквівалентності була якнайменшою. При цьому показник титрування індикатора знаходять з довідників, а рН розчину в точці еквівалентності обчислюють за рівнянням реакції.
№ 130
За допомогою кривих титрування дати обґрунтовану відповідь, де точність титрування буде найвищою:
а) при титруванні сильної кислоти лугом;
б) при титруванні слабкої кислоти лугом?
Чи можна титрувати слабку кислоту слабкою основою?
а) поглянемо на криву титрування сильної кислоти лугом
(0,1 н розчин HCl 0,1 н розчином NaOH):
 | |||
 | |||
 рН 14
рН 14
 7
7

 0
0
0 40 80 120 160 200
об’єм NaOH, мл
З малюнка видно, що при титруванні сильної кислоти лугом біля точки еквівалентності спостерігається різка зміна рН розчину. Помилка титрування в даному випадку становить 0,1%.
б) тепер поглянемо на криву титрування слабкої кислоти лугом
(0,1 н розчину оцтової кислоти 0,1 н розчином NaOH):


 рН 14
рН 14
 7
7
 0
0
Об’єм NaOH , мл
Характер кривої показує, що при титруванні слабкої кислоти лугом немає різкої зміни рН біля точки еквівалентності. У цьому випадку помилка титрування може сягати 10%.
Таким чином, точність титрування буде найвищою у випадку титрування сильної кислоти сильною основою.
Титрувати слабку кислоту слабкою основою практично неможливо тому що при зміні рН на ± 1 кислота буде недотитрована приблизно на 10%, потім приблизно на стільки ж буде перетитрована.
№ 131
Дати загальну характеристику методу перманганатометрії
Перманганатометрія – один з методів об’ємного аналізу (підгрупа методів окислення-відновлення), в якому речовину визначають титруванням розчином перманганату калію.
У кислому середовищі основна реакція методу йде за рівнянням:
MnO4‾ + 8H+ + 5e‾ → Mn2+ + 4H2O.
У слабокислих або лужних розчинах перманганат відновлюється до Mn4+, який випадає у вигляді нерозчинного осаду двоокису марганцю:
MnO4‾ + 4H+ + 3e‾ → MnO2↓ + 2H2O
Метод застосовують для визначення багатьох відновників, серед них
Fe2+, Sn2+, Mn2+, V4+, U4+.
При титруванні розчином перманганату калію звичайно не застосовують ніяких спеціальних індикаторів. Точку еквівалентності встановлюють за рожевим забарвленням, яке виникає від невеликого надлишку добавленого розчину перманганату. Отже, індикатором є сам робочий розчин.
Оскільки препарат KMnO4 не має властивостей вихідної речовини через значну кількість домішок двоокису марганцю, нормальність розчину перманганату калію встановлюють за щавлевою кислотою.
№ 132
Титровані розчини методу перманганатометрії. У чому полягає різниця приготування робочого титрованого розчину КMnO4 та стандартного розчину щавлевої кислоти?
Робочим розчином методу перманганатометрії є розчин перманганату калію. Після встановлення нормальності цього розчину за щавлевою кислотою він має назву титрований робочий розчин. Різниця приготування титрованого робочого розчину КMnO4 та стандартного розчину щавлевої кислоти полягає в тому, що, по-перше, препарат перманганату калію, на відміну від препарату щавлевої кислоти, не містить кристалізаційної води (яку останній з часом втрачає), отже його не треба перекристалізовувати перед розчиненням; по-друге, приготувавши стандартний розчин щавлевої кислоти, ми будемо знати його нормальність з достатньою точністю, тоді як нормальність приготовленого робочого розчину КMnO4 відома лише приблизно і встановити її буде необхідно за тим же розчином щавлевої кислоти.
№ 133
Дати мотивовану відповідь, чи можна приготувати титрований розчин KMnO4, виходячи з точної наважки, без встановлення його концентрації за вихідною речовиною
НЕ МОЖНА. Тому, що KMnO4 не має властивостей вихідної речовини. Препарат завжди має більшу або меншу кількість домішок двоокису марганцю, позбутися яких важко. Крім того, концентрація розчину KMnO4 з часом змінюється внаслідок відновлення під впливом світла, невеликих кількостей органічних речовин, які потрапляють у розчин з пилом, тощо.
Точну концентрацію розчину KMnO4 можна встановити за щавелевою кислотою.
№ 134
Розрахувати наважку КMnO4, необхідну для приготування 1,0 л 0,05 н розчину. Зазначити основні етапи приготування розчину КMnO4
Зрівняння реакції
MnO4‾ + 8Н+ + 5е– → Mn2+ + 4H2O
бачимо, що еквівалент КMnO4 рівний 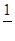 його молярної маси. Отже, для того, щоб приготувати 1 л 0,05 н розчину, треба відважити на технічних терезах
його молярної маси. Отже, для того, щоб приготувати 1 л 0,05 н розчину, треба відважити на технічних терезах
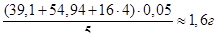 препарату КMnO4.
препарату КMnO4.
Наважку переносять у вимірювальну колбу і заливають приблизно на ½ дистильованою водою, старанно перемішують до повного розчинення кристалів. Слідкують, щоб кристали КMnO4 розчинились повністю, оскільки процес дуже повільний. Потім доводять об’єм розчину до 1 л. Не раніше, як через 10–12 діб нормальність отриманого розчину встановлюють за щавлевою кислотою.
№ 135
Скласти рівняння реакції, яка відбувається при встановленні нормальності робочого розчину КMnO4 за вихідною речовиною. Зазначити хід та умови цього визначення
Рівняння реакції:
2КMnO4 + 5H2С2O4 + 3H2SO4 → К2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
2 MnO4‾ + 8H+ + 5е– → Mn2+ + 4H2O
5  C2O42– → 2е– + 2CO2↑
C2O42– → 2е– + 2CO2↑
2MnO4‾ + 5C2O42– + 16H+ → 2Mn2+ + 10CO2↑ + 8H2O
Хід визначення: піпеткою відбирають 20 або 25 мл 0,1 н розчину щавлевої кислоти і переносять у конічну колбу ємністю 200 мл. Добавляють 15–20 мл розчину сірчаної кислоти (1:4) і нагрівають до температури 80–90°С. При цьому стежать, щоб стінки колби вище рівня рідини не перегрівались, оскільки це може призвести до термічного розкладу щавлевої кислоти:
t°
H2С2O4 → CO2↑ + CO↑ + H2O
До гарячого розчину щавлевої кислоти з бюретки добавляють кілька крапель розчину перманганату калію і чекають, доки зникне рожеве забарвлення. Потім додають наступні порції розчину перманганату, щоразу чекаючи зникнення рожевого забарвлення. Після додавання 2–3 мл розчину перманганату титрування йде швидше і робочий розчин можна добавляти більшими порціями. Ознакою кінця титрування є забарвлення розчину в рожевий колір, який не зникає тривалий час. Визначення треба повторити з новими порціями розчину щавлевої кислоти ще 2–3 рази, при цьому розходження в об’ємах між окремими паралельними пробами не має перевищувати 0,02–0,03 мл. Відлічувати об’єм розчину перманганату, витраченого на титрування, зручно за верхнім меніском на бюретці. Нормальність розчину перманганату обчислюють за формулою:
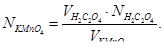
№ 136
Як прискорити реакцію, що є основою визначення концентрації розчину KMnO4? Що є каталізатором?
Реакція між KMnO4 і щавлевою кислотою безпосередньо не йде або йде дуже повільно. Навпаки, швидкість реакції між KMnO4 і іонами марганцю(ІІ), в результаті якої утворюється двоокис марганцю, досить велика. Найшвидше взаємодіють MnO2 та H2C2O4.
Досліди показують, що каталізатором в даній реакції є іони марганцю(ІІ). Збільшення їх концентрації значно прискорює реакцію.
№ 137
Чому не потрібен індикатор при перманганатометричних визначеннях? Як встановлюють точку еквівалентності при титруванні розчином перманганату калію?
Тому що в даному випадку індикатором є сам робочийрозчин KMnO 4. Точку еквівалентності встановлюють за рожевим забарвленням, яке виникає від невеликого надлишку добавленого розчину KMnO4. Помилку титрування при такому способі визначення точки еквівалентності легко встановити за допомогою сліпої проби.
№ 138
Дата: 2019-05-29, просмотров: 321.