Ферменты — биологические катализаторы, белковой природы, обладающие высокой активностью и специфичностью действия. Их применение значительно увеличивает скорость химических превращений, что позволяет сократить продолжительность многих технологических процессов. С помощью ферментов может быть обеспечена также определенная направленность процессов при получении ценных компонентов продуктов питания.
Гидролиз лактозы. Ферментативный гидролиз лактозы в молочной выворотке достаточно подробно изучен как в нашей стране, так и за рубежом. В качестве фермента применяют лактозу (0-галактозидазу), полученную на основе микробного синтеза из дрожжей и плесневых грибов. В результате гидролиза плохо растворимый и несладкий молочный сахар (лактоза) превращается в более сладкую и хорошо растворимую смесь моносахаров (глюкозы и галактозы), что позволяет широко использовать фермент для производства пищевых и кормовых продуктов. В общем виде уравнение гидролиза лактозы можно представить так:
С12Н22О11+Н2О = С6Н12О6+С16Н12О6
лактоза глюкоза галактоза
Степень гидролиза лактозы Y (в %) в зависимости от температуры X1 (в °С), продолжительности процесса Х2 (ч), концентрации фермента Х3 (ед. на 1 г лактозы) и рН X4 описывается следующим уравнением регрессии, полученным на основе обработки экспериментальных данных на ЭВМ:
Y = - 636,2 + 28,156 Х1, - 0,230Х 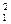 +26,713Х
+26,713Х 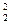 -0,671 Х
-0,671 Х 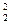 - 8,384Х3 – 103,8Х4 + 12,44Х
- 8,384Х3 – 103,8Х4 + 12,44Х 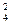 - 0,264Х1Х2 +0,165 Х1Х3.
- 0,264Х1Х2 +0,165 Х1Х3.
Оптимальными технологическими параметрами для обеспечения гидролиза 50% лактозы являются: Х1 = 35 оС; Х2 = 4,52 ч; Х3= 4 ед. на 1 г лактозы; Х4 = 6,7.
В результате гидролиза в моносахара превращается до 50— 70% лактозы, увеличиваются сладость и усвояемость готового продукта. Во многих странах пользуются популярностью кисломолочные продукты и напитки, вырабатываемые из молока с гидролизованной лактозой. Проводятся исследования по производству сыра из гидролизованного молока. Сыр по сравнению с контрольными образцами отличается более высокими вкусовыми качествами и ускоренным процессом созревания.
Особый интерес представляет возможность выработки продуктов и полуфабрикатов из молочной сыворотки с гидролизованной лактозой. Такие полуфабрикаты можно широко использовать для приготовления различных напитков, пищевых сиропов и подслащающих веществ для кондитерской промышленности. Использование этих полуфабрикатов в хлебопечении позволяет добиться хорошей сбраживаемости хлебопекарными дрожжами, улучшения cTBa хлеба.
В гидролизованной молочной сыворотке явно проявляются пики содержания глюкозы и галактозы (рис. 2.36.) увеличивается примерно в два раза содержание летучих жирных кислот (рис. 2.37.) накапливаются ароматические соединения (табл. 2.24.)
Рисунок 2.36.
Рисунок 2.36. - Хроматографическая идентификация углеводов гидролизованной сыворотки: а - стандартный раствор смеси углеводов; б - подсырная сыворотка гидролизованная; в - творожная сыворотка гидролизованная; 1 - лактоза; 2 – глюкоза; 3 – галактоза.
Рисунок 2.37.
Рисунок 2.37. – Хроматограмма летучих жирных кислот молочной сыворотки: а — стандартная смесь кислот; б — творожная сыворотка натуральная; в — творожная сыворотка гидролизованная; г - подсырная сыворотка натуральная; д - подсырная сыворотка гидролизованная; 1— муравьиная кислота; 2 — уксусная кислота; 3 - пропионовая кислота; 4 - масляная кислота
Таблица 2.24.
| Сыворотка | Содержание ароматических соединений, мл 0,1 н. йода на 100 г сухого вещества в молочной сыворотке | |
| подсырной | творожной | |
| Натуральная | 29 | 30,6 |
| Пастеризованная | 39,6 | 36,8 |
| Гидролизованная в течение 0,5 ч | 57,2 | 47,2 |
Следует отметить, что натуральная молочная сыворотка содержит значительное количество ароматических соединений. Технологическая обработка и гидролиз увеличивают их количество, что благоприятно отражается на возможности ее использования в хлебопечении, производстве безалкогольных напитков и других пищевых продуктов.
В последнее время в нашей стране и за рубежом проводятся работы по созданию и использованию иммобилизованных ферментов. Иммобилизованные ферменты представляют собой нерастворимые вещества, в которых фермент связан с каким-либо носителем силами адсорбции или ковалентными связями либо заключен в матрицы или микрокапсулы. Иммобилизованные ферменты сохраняют свою специфичность и активность, могут быть легко удалены из конечного продукта, то есть могут быть использованы многократно. Кроме того, иммобилизация повышает стабильность фермента, позволяет проводить гидролиз в течение продолжительного времени, при более низкой стоимости и без добавления чужеродных материалов в готовый продукт.
При использовании иммобилизованной достигается принципиальное изменение технологической схемы гидролиза молочной сыворотки
Лабораторные исследования по испытанию иммобилизованной β-галактозидазы "Галактосил" позволили установить зависимость процесса от рН (рис. 2.38.) и температуры (рис. 2.39.).
Максимальная активность гидролиза (90%) наблюдается при рН 3-4, при рН 5 она снижается (до 70%), а при рН 6 составляет только половину максимальной. Следовательно, необходимо подкисление среды.
Оптимальной температурой, обеспечивающей максимальную степень гидролиза (90 %), является 50 °С Повышение температуры приводит к инактивации фермента, а некоторое снижение (до 30 °С) создает предпосылки для обеспечения необходимой степени гидролиза на уровне 80 %
Необходимая скорость протекания субстрата через колонку, установленная экспериментально, соответствует 1,4 т лактазы на 1 г фермента в 1 ч.
Рисунок 2.38.
Рисунок 2.38. – Влияние рН субстрата на степень гидролиза лактозы, иммобилизованной β-галактозидазой «Галактосил»: 1 – фильтрат подсырной сыворотки; 2 – раствор лактозы 5 %-ной концентрации.
Рисунок 2.39.
Рисунок 2 .39. – Влияние температуры субстрата на степень гидролиза лактозы, иммобилизованной β-галактозидазой «Галактосил»: 1 – фильтрат подсырной сыворотки; 2 – раствор лактозы 5 %-ной концентрации.
Исследования, проведенные с лактазой, иммобилизованной на аминосилохроме С-80 при помощи гассипола, показали, что время полураспада при работе на субстрате с концентрацией лактазы 20% составляет: чистый раствор лактозы - 93 дня, творожная сыворотка – 85, ее ультрафильтрат - 71 день. Степень гидролиза в зависимости от вида и дозы фермента, условий его работы колеблется от 39 до 100%, Эффективность использования ферментных препаратов для гидролиза лактазы можно повысить с помощью ультрафильтрации.
Проведенные исследования показали, что в качестве фильтрующего элемента целесообразно использовать полупроницаемые ацетатцеллюлозные мембраны УАМ-150 М. Снижение активности фермента (3-галактозидазы и степени гидролиза лактазы по циклам процесса (термоинактивация + ультрафильтрация) приведено Табл. 2.25.
Таблица 2.25.
| Показатель | Номер цикла | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Активность фермента ед. на 1 г | 1325 | 1320 | 1160 | 1075 | 1025 |
| Степень гидролиза, % | 95 | 93 | 90 | 89 | 88 |
Расчетный показатель инактивации составляет 0,0029 ч-1, период полураспада 238,96 ч. Следовательно, в течение десяти дней эксплуатации фермента его активность снизится примерно наполовину
Гидролизованная молочная сыворотка и ее концентраты (глюкозо-галактозные сиропы) могут быть широко использованы в пищевой промышленности в качестве наполнителей и обогатителей продуктов питания, а также в сельском хозяйстве для обогащения кормов.
Гидролиз сывороточных белков. Гидролиз белков молочной сыворотки до пептидов и аминокислот осуществляют для повышения биологической ценности вырабатываемых продуктов или из-за требований технологического процесса. Так, вполне обоснован гидролиз белков при изготовлении напитков из сыворотки. При этом кроме повышения их питательной и биологической ценности (обогащение аминокислотами) улучшается качество (прозрачность и отсутствие осадка) готовых продуктов.
Эффективность гидролиза белков молочной сыворотки различными протеолитическими ферментами приведена в табл. 2.26. и показана на рис. 2.40.
Рисунок 2.40.
Рисунок 2.40. – Денситограммы белков молочной сыворотки в процессе гидролиза: 1 - исходная сыворотка; 2 – сыворотка после выдержки в термостате в течение 24 ч при 60 °С; 3 — сыворотка гидролизованная Thermoactinoinyces vulgaris; 4 - сыворотка, гидролизованная Actinomyces vulgaris; 5 - сыворотка, гидролизованная трипсином; 6 - сыворотка, гидролизованная протомезентерином; 7 -сыворотка, гидролизованная медицинским панкреатином; 8 — сыворотка, гидролизованная техническим панкреатином; 9 — сыворотка, гидролизованная куриным пепсином; 10 - сыворотка, гидролизованная протофрадином; 11 - сыворотка, гидролизованная протоальбином; 12 - сыворотка, гидролизованная проторизином
Таблица 2.26
| Содержание в сыворотке, % | Контроль | После термообработки | Гидролиз протеолитическими ферментами | |||||||||
| Протоальбин | Проторизин | Протолецентрин | Протофрадин | Панкреатин (технический) | Панкреатин (медицинский) | Куриный пепсин | Трипсин | Thermoactinomyces vulgaris | Actinomices thermovulgaris | |||
| Белок | 0,787 | 0,624 | 0,544 | 0,531 | 0,527 | 0,498 | 0,489 | 0,473 | 0,462 | 0,457 | 0,268 | 0,262 |
| Полипептиды | 0,039 | 0,051 | 0,119 | 0,114 | 0,103 | 0,116 | 0,116 | 0,112 | 0,131 | 0,138 | 0,098 | 0,114 |
| Аминокислоты | 0,029 | 0,023 | 0,151 | 0,119 | 0,167 | 0,186 | 0,153 | 0,129 | 0,136 | 0,183 | 0,287 | 0,252 |
Таблица 2.27.
| Аминокислота | Контроль | Контроль после термообработки | Thermoactinomyces vulgaris | Actinomices thermovulgaris | Трипсин | Панкреатин (медицинский) | Панкреатин (технический) | Протомезентрин | Протофрадин | Протоальбин | Куриный пепсин (рН 2) | Куриный пепсин (рН 4) | Куриный пепсин (рН 6) | Проторизин |
| Цистин | Следы | 0,034 | 0,814 | 0,128 | 0,373 | Следы | 0,084 | 0,282 | 0,735 | 0,32 | Следы | Следы | 0,126 | Следы |
| Лизин | 0,151 | 0,108 | 0,934 | 0,302 | 1,256 | 0,187 | 2,794 | 2,666 | 0,503 | 0,296 | 0,238 | 0,332 | 0,159 | 1,136 |
| Гистидин | Следы | Следы | 0,898 | 0,289 | 0,23 | 0,297 | 2,36 | 0,755 | 0,654 | 0,098 | 0,336 | 0,502 | 0,11 | 1,186 |
| Аргинин | " | 0,004 | 0,275 | 0,135 | 0,121 | Следы | 0,157 | 0,115 | 3,629 | 0,046 | 0,116 | Следы | 0,046 | 0,04 |
| Аспарагиновая кислота | " | Следы | 1,232 | 0,389 | 0,353 | 0,068 | 1,04 | 0,794 | 6,725 | 0,538 | 0,47 | 0,122 | 0,523 | 0,478 |
| Серин | 0,039 | " | 0,328 | 0,346 | 0,075 | 0,003 | 0,26 | 0,25 | 0,162 | 0,111 | 0,112 | 0,163 | 0,137 | 0,156 |
| Глицин | 0,209 | " | 0,345 | 0,325 | 0,154 | 0,009 | 0,359 | 0,142 | 0,37 | 0,111 | 0,086 | 0,165 | 0,107 | 0,284 |
| Глутаминовая кислота | 0,908 | 0,399 | 5,47 | 2,254 | 0,568 | 0,039 | 3,512 | 2,677 | 3,032 | 1,898 | 1,552 | 1,289 | 3,003 | 1,778 |
| Треонин | Следы | Следы | 0,281 | 0,547 | 0,114 | 0,032 | 0,34 | 0,234 | 0,506 | 0,145 | 0,014 | 0,099 | 0,09 | 0,15 |
| Аланин | " | " | 1,122 | 0,567 | 0,12 | 0,109 | 0,965 | 0,789 | 0,81 | 0,15 | 0,216 | 0,226 | 0,1 | 0,193 |
| Пролин | " | " | 0,153 | 0,177 | 0,037 | Следы | 0,034 | 0,096 | 0,166 | 0,048 | 0,173 | 0,152 | 0,009 | 0,314 |
| Тирозин | - | - | 1,296 | 3,124 | 0,037 | " | - | - | - | Следы | - | 1,666 | Следы | - |
| Метионин | Следы | Следы | 1,214 | 0,528 | 0,126 | " | 0,503 | 1,619 | 2,285 | 0,139 | Следы | Следы | 0,052 | - |
| Валин | " | " | 0,542 | 0,455 | 0,108 | 0,218 | 0,83 | 0,6 | 0,618 | 0,036 | 0,088 | 0,068 | 0,378 | 0,223 |
| Фенилаланин | " | " | 1,296 | 0,12 | 0,107 | Следы | 0,747 | 0,281 | 0,676 | 0,088 | Следы | Следы | 0,026 | 0,175 |
| Лейцин | " | " | 8,062 | 12,936 | 3,888 | 3,09 | 5,272 | 10,151 | 5,07 | 0,235 | 0,228 | 0,802 | 2,249 | 1,66 |
По эффективности гидролиза белков молочной сыворотки протео-литические ферменты можно расположить в следующий ряд (% гидролиза):
| Actinomyces thermovulgaris | 88,9 |
| Thermoactinomyces vulgaris | 88,3 |
| Трипсин | 76,5 |
| Протофрадин | 67,8 |
| Панкреатин (медицинский) | 67 |
| Проторизин | 63,5 |
| Куриный пепсин | 54 |
| Протомезентрин | 52,8 |
| Протоальбин | 46,9 |
В процессе гидролиза под действием протеолитических ферментов в молочной сыворотке изменяется количество аминокислот (табл.2.27.)
В гидролизованной протеолитическими ферментами молочной сыворотке содержится весь набор аминокислот, заметно увеличивается их содержание в сравнении с исходной сывороткой, особенно лейцина и глутаминовой кислоты. Появляются оксиаминокислоты (серии и треонин), двухосновные (гистилин, аргинин), а также ароматические и серосодержащие аминокислоты.
Из молочной сыворотки после гидролиза белков можно готовить сгущенные и сухие обогащенные концентраты.
В последние годы разработаны эффективные способы гидролиза концентратов сывороточных белков, выделенных из молочной сыворотки тепловой денатурацией и ультрафильтрацией. За рубежом на этой основе готовят сухой быстрорастворимый продукт с фирменным названием "Сан-Бол".
В производстве молочного сахара гидролиз белков позволяет улучшить его качество и стабилизировать технологический процесс.
На основе ферментации молочной сыворотки можно приготовить белковые гидролизаты для микробиологических исследований.
Дата: 2019-05-29, просмотров: 492.