Получение серной кислоты из сероводорода (мокрый катализ) на Пермском нефтеперерабатывающем заводе является малотоннажным производством (65тыс. тонн в год). В основном, это производство создано для того, чтобы снизить выбросы серосодержащих газов и максимально перерабатывать сырье, которое в данном случае является отходом процесса гидроочистки нефти.
Помимо использования сероводорода, в процессе получения серной кислоты протекают 3 реакции:
Н2S + 1,5О2 = SО2 + Н2О
SО2 + 0,5О2 <=> SО3
SО3 + Н2О <=> Н2SО4
Эти три реакции протекают с выделением значительного количества тепла, которое используется для различных нужд цеха производства серной кислоты и в различных целях предприятия: получение пара, который используется в данном производстве, получение пара высокого давления, который используют другие установки, подогрев воздуха, поступающий в котлы для сжигания сероводорода и в контактный аппарат.
Преимущество получения серной кислоты из сероводорода заключается в том, что данный процесс максимально использует и сероводород, и диоксид серы, что в значительной мере снижает выбросы в атмосферу, при проведении процесса, состоящего из 3 реакций, используются невысокие температуры и атмосферное давление, что значительно снижает энергозатраты по сравнению со схемой, которая применяет высокое давление. С учетом того, что в результате технологического процесса выделяется большое количество тепла, процесс, благодаря этому, протекает автотермично.
Стадии и химизм процесса
Процесс получения серной кислоты методом "мокрого" катализа состоит из следующих основных стадий.
1. Получение сернистого ангидрида (SO2) путем сжигания сероводородсодержащего газа по следующей реакции:
2H2S + 3O2 = 2SO2 + 2 H2O
2. Охлаждение дымовых газов и утилизация тепла реакции горения сероводорода в котле-утилизаторе с получением водяного пара.
3. Окисление сернистого ангидрида до серного ангидрида (SO3) на ванадиевом катализаторе в контактном аппарате (конвертере) R-104 по следующей реакции:
2SO2 + O3 = 2 SO3
4. Получение серной кислоты (H2SO4) путем конденсации в конденсаторе WSA У-109 по реакции:
SO3 + H2O = H2SO4
5. Для получения улучшенной серной кислоты (содержание окислов азота N2O3 менее 0,5 ppm) предусмотрена схема подачи гидразингидрата в поток серной кислоты, поступающей на участок концентрирования серной кислоты.
Гидразинсульфат, полученный при добавлении гидразина к серной кислоте, взаимодействует с нитрозилсернистой кислотой, обуславливающей содержание N2О3 в продуктовой кислоте:
 4NOSO3H + N2H4· H2SO4 3N2 + 5H2SO4
4NOSO3H + N2H4· H2SO4 3N2 + 5H2SO4
Избыток гидразина окисляется с образованием элементарного азота:
 N2H4·H2SO4 + O2 N2 +2H2O + H2SO4
N2H4·H2SO4 + O2 N2 +2H2O + H2SO4
Химический состав серной кислоты выражается формулой H2SO4. Структурная формула серной кислоты выглядит следующим образом:
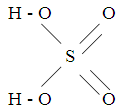
Относительная молекулярная масса серной кислоты - 98,08 кг/кмоль.
Безводная серная кислота содержит 100 % H2SO4 или 81,63 % SO3 и 18,37 % мас. H2O. Это бесцветная маслянистая жидкость не имеющая запаха с температурой кристаллизации 10,37 ºС. Температура кипения безводной серной кислоты при давлении 1,01·105 Па (760 мм рт.ст.) составляет 298,2 ºС. Плотность при 20 ºС составляет 1830,5 кг/м3.
С водой и сернистым ангидридом серная кислота смешивается в любых пропорциях.
В процессе производства серной кислоты для окисления сернистого ангидрида в серный применяются ванадиевый катализатор. Он представляет собой пористое вещество, на которое нанесено активное комплексное соединение, содержащее пятиокись ванадия V2O5.
В данном случае применяется катализатор марки VK-WSA фирмы "Хальдор Топсе".
Температура зажигания катализатора 400-430 ºС. При температуре выше 620 ºС активность катализатора быстро снижается, т.к. при этом распадается активный комплекс, содержащий пятиокись ванадия (V2O5), а также разрушается структура носителя, что приводит к разрушению катализатора и образованию пыли.
Срок службы катализатора не менее 4 лет.
Термодинамический анализ
Расчет теплового эффекта реакции окисления SO 2 в SO 3 :
2SO2 + O2 = 2 SO3
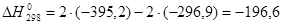 кДж
кДж
Q=-ΔН=196,6 кДж
Реакция экзотермическая – протекает с выделением тепла.
ΔS= 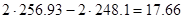
ΔG=ΔH-TΔS=-196,6-298*17,66=-5459,28
Энергия Гиббса значительно меньше нуля. Это значит, что реакция термодинамически возможна.
Расчет теплового эффекта реакции конденсации SO 3 :
SO3 + H2O = H2SO4
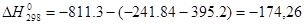 кДж
кДж
Q=-ΔН=174,26 кДж
Реакция экзотермическая- протекает с выделением тепла.
ΔS= 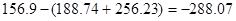 Дж
Дж
ΔG=ΔH-TΔS=-174,26-298*-288,07=-86019,12
Энергия Гиббса значительно меньше нуля. Это значит, что реакция термодинамически возможна.
Таблица 1
Значения термодинамических величин
| 2SO2 + O2 = 2 SO3 | |
| ΔН | -196,6 кДж |
| ΔS | 17,66 |
| Q | 196,6 |
| ΔG | -5459,28 |
Таблица 2
Значения Кр для реакции окисления SO2 при различных температурах
| Температура, 0С | Температура, К | Константа равновесия, Кр |
| 400 | 673 | 539,4 |
| 450 | 723 | 158,0 |
| 500 | 773 | 55,5 |
| 550 | 823 | 22,2 |
| 600 | 873 | 9,8 |
Вывод: реакция окисления SO2 наиболее полно протекает при невысоких температурах. Из этого следует, реакцию окисления SO2 целесообразно проводить при невысоких температурах. Повышение давления, по принципу Ле-Шателье, влияет положительно.
Дата: 2019-05-29, просмотров: 323.