Процесс перехода из жидкого или газообразного состояния в твердое, в результате чего образуется кристаллическая решетка и возникают кристаллы, называется кристаллизацией.
Чем объясняется существование при одних температурах жидкого, а при других температурах твердого состояния и почему превращение происходит при строго определенных температурах?
В природе все самопроизвольно протекающие превращения, а следовательно, кристаллизация и плавление обусловлены тем, что новое состояние в новых условиях является энергетически более устойчивым, обладает меньшим запасом энергии.
Энергетическое состояние системы, имеющей огромное число охваченных тепловым движением частиц (атомов, молекул), характеризуется особой термодинамической функцией (F ), называемой свободной энергией, которая определяется:
F= U – TS,
где U – внутренняя энергия системы;
Т - абсолютная температура;
S - энтропия
Можно сказать, что чем больше свободная энергия системы, тем система менее устойчива, и если имеется возможность, то система переходит в состояние, где свободная энергия меньше.
С изменением внешних условий, например температуры, свободная энергия системы изменяется по сложному закону, но различно для жидкого и твердого состояний (рис. 3.1).
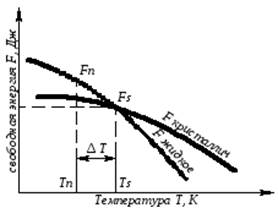
Рис. 3.1. Изменение свободной энергии жидкого и кристаллического состояний в зависимости от температуры
Выше температуры Тs меньшей свободной энергией обладает вещество в жидком состоянии, ниже Ts – вещество в твердом состоянии. Следовательно, выше Ts вещество должно находиться в жидком состоянии, а ниже Ts – в твердом, кристаллическом.
Очевидно, что при температуре, равной Ts свободные энергии жидкого и твердого состояний равны, металл в обоих состояниях находится в равновесии. Эта температура Ts и есть равновесная или теоретическаятемпература кристаллизации. Однако, при Ts Fж = Fкр, и процесс кристаллизации (плавления) не может идти, так как при равенстве свободных энергий обеих фаз плавление (кристаллизация) не будут сопровождаться уменьшением свободной энергии.
Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Их кривых (рис. 3.1) видно, что это возможно только тогда, когда жидкость будет охлаждена ниже точки Ts.
Температура, при которой практически начинается кристаллизация, может быть названа фактической температурой кристаллизации.
Охлаждение жидкости ниже температуры кристаллизации называется переохлаждением.
Обратное превращение из кристаллического состояния в жидкое может произойти только выше температуры Ts, это явление называется перенагреванием.
Величиной или степенью переохлаждения называют разность между теоретической и фактической температурами кристаллизации T = Ts - Tф.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура (рис. 3.2).
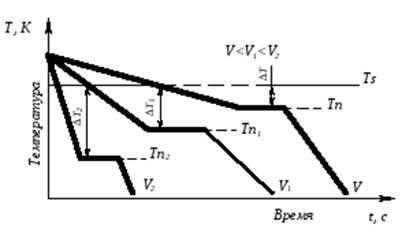
Рис. 3.2. Кривые охлаждения, полученные при кристаллизации металла
Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и может быть названо простым охлаждением, так как при этом нет качественного изменения состояния. При достижении температур кристаллизации на кривой температура – время появляются горизонтальные площадки (рис.3.2), так как отвод тепла компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации.
3.2. Механизм процесса кристаллизации
Процесс кристаллизации состоит из двух элементарных процессов. Первый процесс заключается в зарождении мельчайших частиц кристаллов, которые называются зародышами или центрами кристаллизации. Второй процесс состоит в росте кристаллов из этих центров.
Модель кристаллизации металла в первые 7 секунд охлаждения представлена схемой процесса кристаллизации (рис.3.3) и кинетической кривой кристаллизации (рис.3.4).
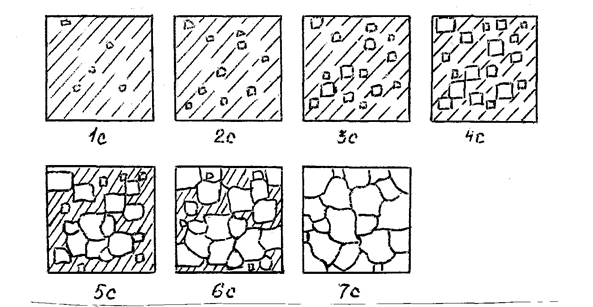
Рис. 3.3. Схема процесса кристаллизации
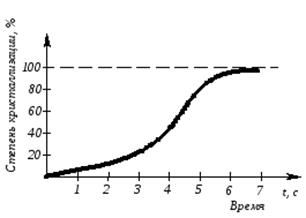
Рис. 3.4. Кинетическая кривая кристаллизации
По мере развития кристаллизации в нем участвуют все большее и большее число кристаллов. Поэтому процесс вначале ускоряется, пока в какой-то момент взаимное столкновение растущих кристаллов начинает заметно препятствовать их росту. Рост кристаллов замедляется еще и потому, что количество жидкости, в которой образуются новые кристаллы, становится все меньше. В процессе кристаллизации, пока кристалл окружен жидкостью, он часто имеет правильную форму, но при столкновении и срастании кристаллов их правильная форма нарушается. Внешняя форма кристалла оказывается зависимой от условий соприкосновения растущих кристаллов. Вот почему кристаллы металла - зерна (кристаллиты) не имеют правильной формы.
Скорость всего процесса кристаллизации количественно определяется двумя величинами: скоростью зарождения центров кристаллизации и скоростью роста кристаллов (рис.3.5).
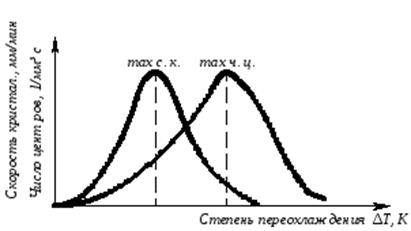
Рис. 3.5. Зависимость скорости кристаллизации (СК) и скорости зарождения центров кристаллизации (ЧЦ) от степени переохлаждения
Величины оптимального переохлаждения до достижения максимальной скорости кристаллизации (СК) и до образования максимального числа центров кристаллизации (ЧЦ) не совпадают.
Размер образовавшихся кристаллов зависит от соотношения СК и ЧЦ. При большом значении СК и малом значении ЧЦ образуется мало крупных кристаллов. При малых значениях СК и больших ЧЦ образуется большое число мелких кристаллов.
Минимальный размер способного к росту зародыша называется критическим размером зародыша.
Основы теории сплавов
Металлическими сплавами называют сочетания двух или более металлов и неметаллов, у которых сохраняются металлические свойства. Большинство сплавов получают в жидком состоянии (сплавлением); однако они могут быть получены также путем спекания, электролиза, конденсации из парообразного состояния.
Компонентами называют химические элементы или их соединения в составе сплава.
По числу компонентов сплавы делят на двойные, тройные и т.д. В зависимости от природы компонентов различают:
1. сплав - механическая смесь компонентов;
2. сплав - твердый раствор компонентов;
3. сплав - химическое соединение компонентов.
Сплавы - механические смеси неоднородны и представляют собой мельчайшую смесь кристаллов компонентов.
Сплавы твердые растворы и сплавы - химические соединения однородны, причем первые могут образовываться при различном соотношении компонентов, а вторые - только при строго определенном весовом соотношении.
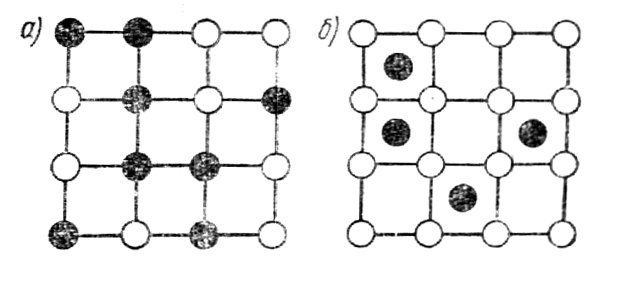
Рис.30. Схема распределения атомов в решетках твердых растворов:
а-решетка замещения, б-решетка внедрения
В сплавах - твердых растворах атомы растворимого вещества замещают атомы растворителя в кристаллической решетке (рис.30,а) или внедряются в нее (рис.30,б); сплавы - химические соединения - образуют особую кристаллическую решетку.
Системойназывают совокупность веществ в твердом, жидком и газообразном состояниях. Системы бывают простые и сложные. Простая система состоит из одного компонента. Сложная система включает несколько компонентов и представляет все возможные количественные сочетания их при различных температурах.
Фазой называют однородную часть системы, отделенную от других составляющих (фаз) поверхностью раздела. Следовательно, фазами могут быть химические элементы, твердые и жидкие растворы, и химические соединения. В жидком состоянии система состоит из одной фазы, при затвердевании всегда имеются две фазы - жидкая и твердая. После затвердевания образуется или одна фаза (химический элемент, химическое соединение, твердый раствор), или сплав, содержащий смесь фаз.
Диаграммы состояния
Диаграммы состоянияхарактеризуют процессы затвердевания и структурного изменения сплавов различных систем и дают представление о фазах в любом сплаве данной системы. По диаграмме состояния можно судить о свойствах всех сплавов данной системы. Она позволяет выбирать условия термической обработки сплавов, их ковки, сварки. Различают несколько типов диаграмм состояния, основными из которых являются.
Диаграммы состояния 1типа характеризуют системы, компоненты которых в жидком состоянии полностью взаимно растворяются, а в твердом состоянии образуют механическую смесь кристаллов обоих компонентов (пример, сплав свинец - сурьма).
Диаграммы состояния 2 типахарактеризуют системы, компоненты которых полностью растворяются как в жидком, так и в твердом состоянии, примером служит система медь - никель.
Диаграмма состояния системы железо - углерод.Наличие небольшого количества обычных примесей в стали не влияет существенно на положение критических точек и характер линий диаграммы, поэтому сталь рассматривают как двойной сплав железо - углерод.
Углерод с железом образует химическое соединение (цементит) или может находиться в сплаве в свободном состоянии в виде графита. Соответственно существуют две диаграммы сплавов «железо - углерод»: цементитная и графитная.
На рис.31приведен упрощенный вид цементитной диаграммы состояния системы «железо - углерод».
Наибольшая доля углерода, по диаграмме 6.67%, отвечает содержанию углерода в химическом соединении - цементите. Следовательно, компонентами, составляющими сплавы этой системы, будут, с одной стороны, чистое железо Fe, с другой - цементитFe3C.
Превращение из жидкого состояния в твердое(первичная кристаллизация). ЛинияACD - ликвидус, а линия AECF - солидус. Форма этих линий показывает, что перед нами сложная диаграмма, представляющая сочетание диаграммы2 типа( от точки Адо точкиЕ) и диаграммы1типа(от точкиЕдо точкиF).
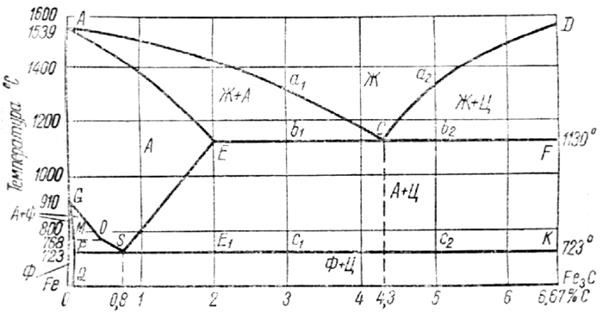
Рис.31. Диаграмма состояния системы «железо - углерод»
Выше линии ACD сплавы системы находятся в жидком состоянии (Ж). По линииАС из жидкого раствора начинают выпадать кристаллы твердого раствора углерода вg -железе, называемогоаустенитом (А). Следовательно, в областиАСЕ будет находиться смесь двух фаз - жидкого раствора (Ж) и аустенита (А). По линииCD из жидкого раствора начинают выпадать кристаллы цементита (Ц); в области диаграммыCFD находится смесь двух фаз - жидкого раствора (Ж) и цементита (Ц). В точкеС при содержании 4.3% углерода и при температуре 11300С происходит одновременно кристаллизация аустенита и цементита и образуется их тонкая механическая смесь -эвтектика, называемая в этой системе ледебуритом. Ледебурит присутствует во всех сплавах, содержащих от 2.0 до 6.67 % углерода. Эти сплавы относятся к группе чугуна.
Точка Е соответствует предельному насыщению железа углеродом (2.0 %). Сплавы, лежащие левее этой точки, после полного затвердевания представляют собой аустенит. Эти сплавы относятся к группе стали.
Превращение в твердом состоянии(вторичная кристаллизация). ЛинииGSE, PSK иGPQ показывают, что в сплавах системы в твердом состоянии происходит изменение структуры.
Превращение в твердом состоянии происходят вследствие перехода железа из одной модификации в другую, а также в связи с изменением растворимости углерода в железе.
В области диаграммы AGSE находится аустенит (А). При охлаждении сплавов аустенит распадается с выделением по линииGSферрита (Ф) - твердого раствора углерода вa -железе,а по линии SE - цементита (Ц) , выпадающего из твердого раствора, называемоговторичным. В областиGSP находится смесь двух фаз - феррита (Ф) и распадающегося аустенита (А), а в областиSEE1 - смесь вторичного цементита и распадающегося аустенита. В точкеS при содержании 0.8 % С (точнее 0.83%) и при температуре 7230С весь аустенит распадается и одновременно кристаллизируется тонкая механическая смесь феррита и цементита - эвтектоид(т.е. подобный эвтектике), который в этой системе называетсяперлитом. Сталь, содержащая 0.8%С, называетсяэвтектоидной, менее 0.8%С -доэвтектоидной,от 0.8 до 2.0%С заэвтектоидной.
По линии PSK происходит распад всего аустенита, оставшегося в любом сплаве системы, с образованием перлита; поэтому линияPSKназывается линиейперлитного(эвтектоидного) превращения.
Дата: 2019-05-28, просмотров: 352.