Свойства молочной кислоты. Молочная кислота является наиболее доступным и практически важным представителем оксикислот. Как известно, она образуется при скисании молока (в результате молочнокислого брожения лактозы), в процессе изготовления разнообразных молочнокислых продуктов, при силосовании кормов.
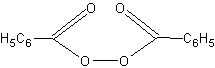
При нагревании с серной кислотой молочная кислота разлагается на уксусный ангидрид и муравьиную кислоту. Последняя в условиях опыта может разлагаться с образованием оксида углерода (II), который нетрудно обнаружить по характеру горения:
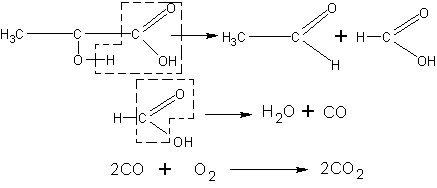
В пробирку наливают 1 мл молочной кислоты и двойное количество концентрированной серной кислоты. Пробирку закрывают пробкой с оттянутой на конце стеклянной трубкой. Нагревают смесь веществ (в вытяжном шкафу!) до кипения и поджигают выделяющийся газ. Он горит характерным для угарного газа синеватым пламенем.
При отсутствии нагревания выделение оксида углерода (II) прекращается.
Опыты с салициловой кислотой. Салициловая кислота представляет собой ортооксибензойную кислоту.
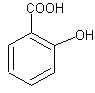
Знакомство с салициловой кислотой как веществом с двумя функциональными группами представляет значительный интерес.
а) Убеждаются в действии на лакмус водного раствора салициловой кислоты (получаемого при нагревании).
б) К раствору кислоты добавляют несколько капель раствора хлорида железа (III). Как и в случае фенола, образуется фиолетовая окраска.
в) При значительном нагревании кислота, подобно другим карбоновым кислотам, разлагается, выделяя углекислый газ:
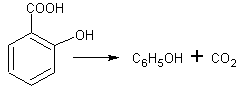
Нагревают в пробирке с отводной трубкой кристаллы салициловой кислоты. Выделяющийся газ пропускают через известковую воду, образуется муть. Остаток в пробирке обладает резким запахом фенола.
г) Подобно бензойной кислоте, салициловая кислота возгоняется. В небольшую пробирку помещают 3—4 кристаллика салициловой кислоты, При нагревании на стенках пробирки быстро образуется белый налет кислоты, который при дальнейшем нагревании постепенно перемещается вверх, как при возгонке йода.
ГЛАВА VIII
СЛОЖНЫЕ ЭФИРЫ. ЖИРЫ
Основное содержание эксперимента по данной теме составляют реакции этерификации и омыления. Сравнительная ограниченность опытов объясняется тем, что из способов получения сложных эфиров в школе рассматривается только реакция между кислотой и спиртом, а из химических свойств — только гидролиз.
СЛОЖНЫЕ ЭФИРЫ
При демонстрации способа получении сложных эфиров образующийся продукт обычно собирается в виде слоя над жидкостью, что трудно наблюдать учащимся на расстоянии. Наиболее убедительный признак образования эфира — появление характерного запаха. Поэтому первое ознакомление с получением эфиров лучше всего провести в виде лабораторного опыта.
Чтобы иметь возможность познакомить учащихся с получением различных эфиров и сделать заключение о том, что реакция этерификации является общей для образования веществ данного класса, можно одновременно дать учащимся синтез разных эфиров (например, метилового, этилового эфиров уксусной кислоты, этилового эфира муравьиной кислоты и др.).
Синтез этилового эфира уксусной кислоты (этилацетата). Опыт можно поставить так, чтобы одновременно показать влияние катализатора (серной кислоты) на скорость процесса.
1. В пробирку наливают 0.5 мл концентрированной уксусной кислоты (эссенции) и равный объем этанола. Запах эфира не обнаруживается даже при подогревании смеси.
После этого в пробирку добавляют 0,5—1 мл концентрированной серной кислоты. Появляется запах эфира, усиливающийся при дальнейшем нагревании.
2. В широкую пробирку (колбочку) наливают по 3 мл спирта, уксусной кислоты и концентрированной серной кислоты. Пробирку закрывают пробкой с обратным холодильником для конденсации паров спирта и эфира и нагревают в стакане с кипящей водой в течение 3—5 мин. Затем выливают жидкость в пробирку с насыщенным раствором поваренной соли. Серная кислота, а также не прореагировавшие спирт и уксусная кислота растворяются, эфир же высаливается и образует верхний слой, при этом ощущается сильный запах. Переливают смесь в делительную воронку и отделяют эфирный слой.
3. В небольшую колбу с отводной трубкой наливают по 10 мл этанола и уксусной кислоты и 5 мл концентрированной серной кислоты. Соединяют колбу с нисходящим холодильником (желательно водяным, так как точка кипения эфира 77°С) и отгоняют на кипящей водяной бане образующийся сложный эфир (до уменьшения объема в колбе наполовину).
Реакция этерификации обратима, но в этих условиях равновесие сдвигается вправо вследствие улетучивания эфира.
СН3СООН + НОС2Н5 à СН3СООС2Н5 + Н2O
Вместе с эфиром частично перегоняется спирт и в некоторой степени уксусная кислота (обычно спирт для реакции берут в избытке по сравнению с теоретически рассчитанным количеством).
Добавляют немного воды к дистилляту и смесь взбалтывают. Кислота и спирт растворяются в воде, эфир собирается слоем сверху. Демонстрируют продукт в таком виде или после отделения от водного слоя с помощью делительной воронки.
. Получающийся эфир содержит еще некоторое количество спирта, кислоты и воды. Однако дальнейшая очистка его в условиях демонстрационного опыта нецелесообразна.
4. Чтобы убедительно показать учащимся отщепление воды oт молекул спирта и кислоты при этерификации, можно провести реакцию, взяв в качестве катализатора безводный сульфат меди. Посинение последнего укажет на образование воды в ходе реак-
 ции. Некоторая сложность проведения опыта связана с тем, что для реакции требуются безводные реагенты (кислота и спирт).
ции. Некоторая сложность проведения опыта связана с тем, что для реакции требуются безводные реагенты (кислота и спирт).
В колбочку (рис. 34) наливают равные объемы спирта и кислоты и помещают 1—2 г безводного сульфата меди. К колбе присоединяют обратный холодильник с хлоркальциевой трубкой для защиты от атмосферной влаги. При встряхивании колбы уже без нагревания начинается постепенное посинение сульфата меди, что указывает на начало реакции. При нагревании смеси на водяной бане в течение 10 мин соль довольно быстро синеет и образуется значительное количество эфира. Запах становится очень сильным при выливании смеси в насыщенный раствор хлорида натрия.
5. С целью получения чистого образца этилацетата опыт ставят следующим образом (рис. 35).
В круглодонную колбу с капельной воронкой и отводной трубкой наливают 10 мл спирта и 10 мл концентрированной серной кислоты. Колбу нагревают через асбестированную сетку, чтобы термометр, опущенный в жидкость, показывал примерно 120°С, и добавляют из капельной воронки смесь 20 мл спирта и 20 мл уксусной кислоты с той же скоростью, с какой отгоняется эфир.

Чтобы освободить дистиллят от примеси уксусной кислоты, его нейтрализуют, добавляя постепенно насыщенный раствор карбоната натрия, контролируя с помощью лакмусовой бумажки рН среды. Смесь при этом пенится, особенно вначале, от выделяющегося углекислого газа. Отделяют эфир от водного слоя с помощью делительной воронки, взбалтывают с 10—15 мл 50-процентного водного раствора хлорида кальция. Хлорид кальция образует со спиртом молекулярное соединение и тем самым очищает эфир. Снова на делительной воронке отделяют эфир, добавляют к нему безводный сульфат натрия для связывания воды и перегоняют на водяной бане при температуре 77°С.
Получение этилового эфира бензойной кислоты (этилбензоата). В данном случае процесс этерификации протекает согласно следующему уравнению реакции:
С6Н5СООН + НОС2Н5 Û С6Н5СООС2Н5 + Н2О
В пробирке растворяют 1 г бензойной кислоты в 3-4 мл спирта и добавляют 7—8 капель концентрированной серной кислоты. При нагревании ощущается мятный запах эфира. При выливании в воду эфир всплывает наверх.
Синтез аспирина. Уксусный ангидрид является сильным ацилирующим средством и часто используется для получения сложных эфиров.
Ацилируя им салициловую кислоту (по фенольному гидроксилу), можно получить широко известное лекарственное средство — аспирин:
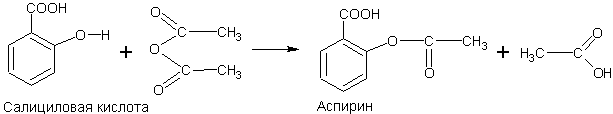
Как видно из формулы, аспирин одновременно является и ароматической кислотой, и сложным эфиром.
Для опыта взвешивают 1,3 г салициловой кислоты и 1,2 г уксусного ангидрида. Помещают вещества в небольшую колбочку, прибавляют к ним каплю концентрированной серной кислоты, за-
крывают колбу пробкой с обратным холодильником и нагревают смесь на водяной бане при 60°С в течение часа. Затем продолжают нагревание еще в течение часа при 90°С. После этого смесь в колбе охлаждают; отфильтровывают кристаллы аспирина (лучше это сделать на воронке Бюхнера) и промывают осадок ледяной водой. Для получения более чистого препарата необходимо дополнительно промыть его небольшим количеством холодного толуола. Сухой осадок взвешивают и определяют выход продукта по сравнению с теоретическим.
С аспирином можно проделать ряд опытов, но, разумеется, из-за недостаточной чистоты нельзя принимать его в качестве лекарства.
Гидролиз сложных эфиров. Опыты по гидролизу сложных эфиров расширяют общие представления учащихся о химической реакции, так как в весьма наглядной форме дополняют их сведениями об обратимости реакций и роли катализаторов.
Как известно, гидролиз катализируется минеральными кислотами, которые служат катализаторами и в реакции этерификации:
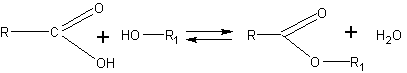
Не сдвигая равновесия в ту или другую сторону, минеральные кислоты значительно ускоряют наступление равновесия. Гидролиз эфиров в очень сильной степени ускоряется в присутствии щелочей, так как они связывают (превращают в соль, т.е. омыляют) образующуюся кислоту, вследствие чего реакция идет до конца в сторону разложения эфира.
а) В три пробирки помешают по нескольку капель этилацетата. В одну пробирку приливают воду в таком количестве, чтобы эфир только растворился в ней, в другую пробирку приливают раствор щелочи, в третью — раствор серной кислоты. Пробирки встряхивают и оставляют стоять или нагревают на водяной бане (в стакане с горячей водой). Через некоторое время убеждаются, что в пробирке со щелочью запах эфира быстро исчезает, в пробирке с кислотой он ослабевает, а в пробирке с водой остается без изменений.
В пробирке с кислотой удается обнаружить нары уксусной кислоты с помощью влажной лакмусовой бумажки (серная кислота нелетуча). В пробирке с водой не удается обнаружить кислоту даже в растворе (если препарат эфира был чистым).
б) В две пробирки помещают по 2 мл этилового эфира бензой-
ной кислоты. В одну пробирку приливают около 8 мл раствора серной кислоты (1 : 1), в другую — такой же объем воды. Нагревают пробирки в течение нескольких минут в пламени спиртовки. При охлаждении в первой пробирке выпадает осадок — кристаллы бензойной кислоты, во второй пробирке осадок не образуется, так как гидролиз не прошел.
в) В колбочку наливают 1 мл этилацетата и растворяют его в воде (около 20 мл). Убеждаются, что раствор (в отдельной пробе) не изменяет окраски лакмуса. Добавляют к раствору в колбе 2—3 капли фенолфталеина и очень немного раствора гидроксида натрия, чтобы только появилось не исчезающее при взбалтывании розовое окрашивание. Закрывают колбу пробкой с обратным холодильником и нагревают смесь в пламени горелки до кипения, после чего дают смеси остыть. Окраска фенолфталеина исчезает, так как щелочь нейтрализуется образующейся при гидролизе кислотой. Добавляют еще несколько капель щелочи и снова нагревают смесь до исчезновения окраски,
Прибавляя к образующемуся нейтральному раствору раствор хлорида железа (III), убеждаются в появлении уксусной кислоты при гидролизе эфира.
г) При длительном омылении эфира щелочью можно провести глубокий гидролиз и не только обнаружить, но и выделить образующиеся продукты.
Опыт можно дать для самостоятельной разработки учащимися.
Идея его такова. Если эфир кипятить со щелочью (25—30-процентной), взяв ее с некоторым избытком против количества, необходимого для нейтрализации образующейся кислоты, то через некоторое время эфирный слой вследствие гидролиза совершенно исчезнет. Чтобы эфир и спирт при этом не улетучивались (уксусная кислота будет в виде соли), кипячение следует вести в колбе с обратным холодильником. Пары спирта после окончания опыта .могут быть обнаружены по их горению. Кроме того, спирт можно отогнать и обнаружить иодоформной реакцией. Раствор ацетата натрия со щелочью можно обработать концентрированной серной кислотой, после чего отогнать уксусную кислоту.
Гидролиз аспирина. По месту сложноэфирной группировки аспирин может подвергаться гидролизу с образованием салициловой и уксусной кислот:
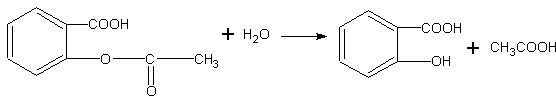
Салициловая кислота, содержащая в молекуле фенольный гидроксил, может быть обнаружена при помощи раствора хлорида железа (III).
Очень небольшое количество аспирина (примерно 0,1 г) растворяют в 4—5 мл воды. Часть раствора испытывают 1—2 каплями раствора хлорида железа. Характерной для фенолов окраски не наблюдается.
Другую часть раствора аспирина кипятят 2—3 мин и после охлаждения также испытывают хлоридом железа. В данном случае наблюдается характерное окрашивание, свидетельствующее о появлении в растворе салициловой кислоты (фенольного гидроксила).
Получение метилового эфира метакриловой кислоты (метилметакрилата) из органического стекла. Органическое стекло (плексиглас) широко применяется сейчас в технике и для изготовления многих предметов повседневного обихода (чернильницы, ручки, шкатулки, мундштуки, пуговицы и т.п.). Оно представляет собой полимер метилового эфира метилакриловой (метакриловой) кислоты
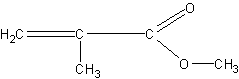
Строение полимера можно изобразить в виде следующей схемы:
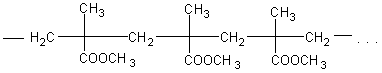
В предыдущих темах учащиеся познакомились со свойствами высокомолекулярных веществ и с их получением путем полимеризации и поликонденсации. На примере данного эфира можно их познакомить с разложением (деполимеризацией) высокомолекулярного продукта.
Опыт очень легко осуществляется и производит большое впечатление на учащихся.
В пробирку или колбочку с отводной трубкой и нисходящим воздушным холодильником насыпают стружки или мелкие кусочки органического стекла. Нагревая колбу через асбестовую сетку или на голом пламени, деполимеризуют органическое стекло и перегоняют образующийся при этом эфир. Перегонку можно производить без контроля термометром. До полного разложения всего органического стекла опыт лучше не доводить, так как продукт начинает обугливаться и колбу после опыта бывает трудно отмыть. В
приемнике собирается прозрачная, бесцветная жидкость с эфирным запахом — метилметакрилат.
Если эфир имеет слегка желтую окраску, его повторно перегоняют. отбирая фракцию в интервале 97-103°С (чистый эфир кипит при 100°С).
Получение полиметилметакрилата. Превращение метилового эфира метакриловой кислоты в высокомолекулярный продукт — полиметилметакрилат — наиболее доступный для школы пример реакции полимеризации.
Наливают в пробирку около 10 мл очищенного метилметакрилата. добавляют очень немного сухой перекиси бензоила (0,05 г) и встряхивают до растворения.
Затем реакционную смесь нагревают на водяной бане при 80— 85°С. Через 15-20 мин замечается увеличение вязкости жидкости. При дальнейшем нагревании жидкость постепенно превращается в твердую стекловидную массу. Пробирку разбивают и извлекают стерженек образовавшегося полимера. Можно получить окрашенный образец, если к исходному мономеру добавить небольшое количество органического красителя. Иногда полимеризацию метилового эфира метакриловой кислоты удастся наблюдать без применения катализатора при длительном стоянии жидкости.
Опыты с полиметилметакрилатом. Кроме деполимеризации с полиметилметакрилатом можно провести следующие опыты.
а) Нагревают над пламенем горелки или на асбестовой сетке пластинку из органического стекла, затем сгибают ее. Убеждаются, что полимер обладает свойством термопластичности.
б) Поджигают кусочек полиметилметакрилата. Он горит голубым некоптящим пламенем с характерным потрескиванием; ощущается эфирный запах.
ЖИРЫ
Школьные опыты по разделу жиров немногочисленны. Но так как жиры играют исключительную роль в жизни человека и учащиеся повседневно имеют с ними дело, следует стремиться к тому, чтобы на внеклассных занятиях и в виде домашних работ был поставлен с жирами целый комплекс работ практического значения.
Растворимость жиров. В 4 пробирки наливают по 1 мл воды, спирта, бензина и эфира и помещают примерно по одинаковому кусочку жира или по нескольку капель растительного масла. Про-
бирки встряхивают и наблюдают, что жир лучше всего растворяется в эфире. Пробирки, где растворение идет плохо, подогревают на горелке. Убеждаются, что в воде жир не растворяется даже при нагревании.
Несколько капель раствора жира в эфире и бензине наносят на фильтровальную бумагу. Наблюдают образование жирных пятен на бумаге после испарения растворителя.
Экстрагирование жиров и масел. Растворимостью жиров и масел в органических растворителях пользуются для извлечения их из отходов скотобоен, из семян, а также для удаления жировых пятен с одежды и т.д. В качестве растворителей используются, кроме указанных выше веществ, дихлорэтан С2Н4СI2, четыреххлористый углерод ССI4 и др.
а) В небольшую колбочку насыпают 5 г предварительно измельченных в ступке сухих семян льна или подсолнечника и наливают 10—15 мл бензина, дихлорэтана или четыреххлористого углерода.
Измельчение семян должно быть по возможности тщательным. С этой целью растирание можно производить, смешав семена с чистым речным песком. Колбу закрывают пробкой с обратным холодильником и кипятят на горелке через асбестовую сетку в течение 10—15 мин. Затем отфильтровывают раствор жира и наблюдают жировое пятно на бумаге после испарения растворителя. Образование небольшого количества масла можно наблюдать и при осторожном выпаривании из фарфоровой чашки.
б) Довольно простой способ извлечения масла состоит в следующем: 2-3 г тонко измельченных в ступке семян подсолнечника или льна помещают в колбу, приливают 25—30 мл диэтилового эфира и закрывают колбу корковой пробкой. Встряхивают колбу время от времени в течение часа. Полученный раствор масла в эфире фильтруют (при погашенных горелках). Остаток семян в колбе промывают дважды небольшими порциями эфира, которые затем также фильтруют и присоединяют к основному раствору. Эфир отгоняют из раствора на водяной бане.
Учащимся может быть предложено произвести необходимые взвешивания при проведении опыта и вычислить содержание масла в семенах.
в) В лаборатории для извлечения масел из семян часто пользуются специальными приборами — экстракторами. Экстрактор (рис. 36) состоит из трех частей: колбы, где нагревается растворитель, экстрактора, где происходит процесс растворения, и обратного холодильника, предназначенного для улавливания паров растворителя.
 Измельченные семена или другой материал, подвергающийся экстракции, помещают в гильзу из фильтровальной бумаги. Гильзу готовят, свертывая полоску фильтровальной бумаги в трубку и загибая края на одном конце внутрь трубки. В такую гильзу сначала помещают немного ваты, затем на нее насыпают материал, подвергаемый экстракции, снова кладут немного ваты и загибают внутрь верхние края гильзы. Гильзу помещают в экстрактор, а в колбу наливают растворитель (диэтиловый эфир) и герметично соединяют части аппарата. Нагревают колбу на водяной бане. Пары растворителя поднимаются в холодильник (обязательно заполненный водой) и конденсируются в нем. Жидкость из холодильника стекает в экстрактор, растворяет вещество и, заполнив экстрактор до определенного уровня, переливается по зигзагообразной сифонной трубке в колбу. За час кипячения растворителя может произойти 6—8 заполнений экстрактора и возвращений жидкости в колбу. Концентрация экстрагируемого вещества в колбе при этом все время возрастает. После отгонки растворителя получают нужный продукт.
Измельченные семена или другой материал, подвергающийся экстракции, помещают в гильзу из фильтровальной бумаги. Гильзу готовят, свертывая полоску фильтровальной бумаги в трубку и загибая края на одном конце внутрь трубки. В такую гильзу сначала помещают немного ваты, затем на нее насыпают материал, подвергаемый экстракции, снова кладут немного ваты и загибают внутрь верхние края гильзы. Гильзу помещают в экстрактор, а в колбу наливают растворитель (диэтиловый эфир) и герметично соединяют части аппарата. Нагревают колбу на водяной бане. Пары растворителя поднимаются в холодильник (обязательно заполненный водой) и конденсируются в нем. Жидкость из холодильника стекает в экстрактор, растворяет вещество и, заполнив экстрактор до определенного уровня, переливается по зигзагообразной сифонной трубке в колбу. За час кипячения растворителя может произойти 6—8 заполнений экстрактора и возвращений жидкости в колбу. Концентрация экстрагируемого вещества в колбе при этом все время возрастает. После отгонки растворителя получают нужный продукт.
Плавление и затвердевание жиров. Жиры представляют собой смесь различных веществ, преимущественно эфиров глицерина. Поэтому они, как и нефть, не имеют постоянной температуры кипения и плавления. Температурой плавления жира считается та конечная температура, при которой плавящийся жир превращается в прозрачную жидкость. Температурой застывания считается та максимальная температура, при которой происходит затвердевание жира.
Определение температуры плавления и затвердевания жира может быть выполнено в приборе, изображенном на рис. 37.
В пробирку помешают 2—5 г жира и закрывают пробкой с двумя отверстиями. Через одно отверстие проходит термометр, шарик которого находится в жире. Другое отверстие служит для выхода воздуха. Нагревают пробирку с жиром в стакане с водой. Наблюдают начало плавления жира, но в качестве температуры плавления отмечают ту температуру, при которой жир становится прозрачным.
Для определения температуры затвердевания в пробирку наливают растительное масло и охлаждают снегом или смесью снега с солью (в зависимости от сорта масла).
Чтобы охлаждение его было более равномерным, масло необходимо постоянно помешивать.
 Когда масло начнет затвердевать, понижение столбика ртути вначале прекращается, затем уровень ртути немного повышается, после чего снова начинает падать. Максимальную температуру отмечают как температуру застывания масла.
Когда масло начнет затвердевать, понижение столбика ртути вначале прекращается, затем уровень ртути немного повышается, после чего снова начинает падать. Максимальную температуру отмечают как температуру застывания масла.
Реакции непредельных жиров (масел). Растительные масла в своем составе содержат глицсриды непредельных кислот, таких как, олеиновая, линоленовая и др. Известно, что эти кислоты способны обесцвечивать бромную воду и раствор перманганата калия. Отметим, что аналогичным образом они ведут себя и в связанном состоянии, в виде жира.
а) В демонстрационную пробирку
наливают 5 мл жидкого масла (льняное, подсолнечное и др.) и концентрированную бромную воду (насыщенный раствор). При встряхивании пробирки бром обесцвечивается (белый фон!), образуется твердый продукт присоединения брома к глицериду. Таким же способом можно провести реакцию с раствором перманганата калия и испытать на непредельность другие масла (оливковое, кокосовое, рыбий жир).
Испытание различных масел с помощью перманганата калия может быть дано в качестве домашнего задания.
б) Кроме брома к непредельным жирам по месту двойной связи присоединяются хлор и иод. К 3—5 мл растительного масла добавляют 5 капель спиртового раствора йода. Встряхивают смесь и прибавляют к ней раствор крахмала. Синее окрашивание не образуется, так как иод вступил в реакцию с жиром. В контрольном опыте наблюдают синее окрашивание.
Реакцию с йодом используют на практике для характеристики жиров, так как по количеству расходуемого йода на насыщение двойных связей, по так называемому йодному числу, можно судить о степени непредельности жира.
Определение степени непредельности жиров. В непредельных углеводородных радикалах жиров может содержаться различное количество двойных связей. О степени непредельности жиров можно судить по количеству обесцвечиваемой ими бромной воды.
В пробирки помещают по 2-3 капли различных жиров (твердые жиры предварительно растапливают): свиного сала, коровьего масла, подсолнечного масла и др. Приливают к жирам по 1 мл четыреххлористого углерода или другого органического растворителя. Затем из бюретки добавляют в пробирки раствор брома до тех пор. пока окраска его не будет исчезать.
Сравнивают количество бромной воды, пошедшей на реакцию с разными жирами, и располагают жиры в ряд по возрастающей степени непредельности.
Определение содержания кислот в жирах. В жирах обычно всегда содержится некоторое количество свободных жирных кислот. Количество кислот возрастает при длительном хранении жиров вследствие частичного их разложения. С разложением жиров связано их прогоркание. О количестве кислот в жире можно сулить по количеству щелочи, идущей на нейтрализацию их в определенной навеске жира: по так называемому числу кислотности. Можно поставить два параллельных опыта: определение числа кислотности в свежем и прогорклом масле.
В конической колбочке растворяют 2 г животного масла в смеси 5 мл спирта и 5 мл эфира. К раствору добавляют 2 капли фенолфталеина и титруют 0,1 М раствором щелочи (добавляя его из бюретки по каплям) до появления розовой окраски, остающейся после встряхивания.
Вычисляют, сколько миллилитров раствора щелочи расходуется в том и другом случае на нейтрализацию 100 г жира. Убеждаются, что кислотное число прогорклого масла выше, чем свежего.
Омыление жиров. Получение мыла из жиров может быть выполнено в различных вариантах. Эти варианты отличаются друг от друга как по степени полноты гидролиза жира, так и по тому, в водной или спиртовой среде производится омыление. Производственный процесс осуществляется, как известно, в водной среде, но так как он идет довольно медленно, то на уроке омыление можно провести в спиртовом растворе. Спирт, обладающий свойством растворять не только щелочь, но и жир, создает гомогенную среду, что значительно ускоряет реакцию.
а) К 4—5 г топленого свиного сала или коровьего масла в колбочке приливают смесь 10 мл спирта, 5 мл воды и 2—3 г едкого кали. Колбочку закрывают пробкой с воздушным обратным холодильником (для конденсации паров спирта) и нагревают на горелке, время от времени перемешивая жидкость. Примерно через 10 мин кипячения омыление заканчивается, так как проба целиком растворяется в горячей дистиллированной воде (отсутствие жира). Часть полученного раствора выливают в стаканчик с 20—25 мл насыщен-
ного раствора поваренной соли. На поверхности выделяется (высаливается) мыло, которое собирают, отжимают в тряпке и используют для опытов (растворение в воде, образование пены, выделение жирных кислот при действии на него минеральных кислот). К другой части раствора прибавляют соляную кислоту. Выделяются нерастворимые в воде жирные кислоты.
б) В большой фарфоровой чашке расплавляют 10 г свиного или говяжьего жира и прибавляют 30 мл 30—35-процентного водного раствора щелочи. Смесь кипятят в пламени горелки, помешивая стеклянной палочкой, остерегаясь разбрызгивания. По мере выкипания в чашку добавляют воду. Минут через 10-15 пипеткой отбирают немного жидкости в пробирку с горячей водой. При взбалтывании получается непрозрачный раствор (эмульсия), так как часть жира к этому времени еще не разложится. Нагревание продолжают до тех пор, пока проба будет полностью растворяться в воде, образуя обильную пену. Это наступает примерно через час или более. После этого раствор упаривают минут 10 до образования густой массы (клеевого мыла) и охлаждают.
Часть полученного раствора выливают в стакан с насыщенным раствором хлорида натрия. Мыло всплывает в виде хлопьев (высаливается). Его собирают, отмывают, если нужно, водой от щелочи, а затем сплавляют в однородную массу. Пробуют мыть им руки и выполняют опыты, описанные ранее (с. 126).
Часть раствора обрабатывают соляной кислотой до выделения слоя жирных кислот. Если жидкость охладилась, кислоты выделяются в виде твердого слоя. Отфильтровывают осадок кислот, а фильтрат нейтрализуют осторожно содой и выпаривают медленно на водяной бане (не на голом огне, так как при сильном нагревании глицерин улетучивается с парами воды). Получают сиропообразный раствор глицерина. До полного удаления воды процесс можно не доводить.
Неудовлетворительные результаты опыта бывают иногда из-за того, что у учащихся не хватает терпения провести гидролиз до конца, и поэтому вместо мыла они иногда извлекают неразложившееся сало и, конечно, получают совершенно отрицательный результат при попытке вымыть этим продуктом руки.
В качестве классной демонстрации этот опыт может быть осуществлен в следующих вариантах:
1. Готовят смесь веществ для опыта, как сказано выше, и начинают ее нагревать. После этого сразу же переходят к опыту, начатому учащимися на внеклассных занятиях, в котором омыление жира доведено почти до конца. Заканчивают омыление, как указано выше, извлекают полученные продукты, устанавливают их природу.
2. Если урок химии двухчасовой, то начинают опыт, как указано выше, и поручают вести его подготовленному для этой цели ученику. Пока опыт идет, в классе разбираются следующие вопросы урока (например, получение стеарина, мыла и глицерина в промышленности, гидрогенизация жиров, проблема синтеза жиров и т.п.). Когда гидролиз в опыте закончится, внимание учащихся снова привлекается к нему, и последующие операции по выделению и исследованию продуктов служат одновременно средством повторения и закрепления материала.
ГЛАВА IX
УГЛЕВОДЫ
Тема «Углеводы» по насыщенности экспериментом занимает одно из первых мест в курсе органической химии. Здесь могут быть ярко показаны свойства веществ, играющих исключительную роль в жизни человека; здесь находят практическое использование ранее полученные учащимися знания (распознавание многоатомных спиртов, альдегидов и т.п.), дополняется экспериментальный материал предыдущих тем (получение спирта из полисахаридов), раскрываются важные процессы современной химической промышленности (гидролиз древесины, получение искусственного шелка и др.).
ГЛЮКОЗА
При изучении глюкозы преимущественное значение имеют опыты, иллюстрирующие ее химические свойства и обосновывающие ее строение. На примере глюкозы впервые дается вывод структурной формулы полифункционального соединения.
Если при изучении спиртов не демонстрировалось брожение глюкозы или сахарозы, этот опыт ставится в данном разделе.
Получение глюкозы гидролизом полисахаридов целесообразно рассмотреть позднее в связи с изучением химических свойств крахмала и клетчатки, когда процесс может быть лучше понят учащимися.
Физические свойства глюкозы. Учащиеся предварительно знакомятся с внешним видом и вкусом глюкозы.
а) Растворяют глюкозу в пробирке с водой до получения насыщенного раствора. Затем растворяют дополнительное количество ее при нагревании. Отмечают, сильно ли влияет нагревание на изменение растворимости глюкозы.
б) В двух пробирках растворяют в равных объемах воды по 5 г глюкозы и обыкновенного сахара (сахарозы). Убеждаются, что раствор сахарозы имеет более сладкий вкус.
Реакции спиртовых групп глюкозы. При ознакомлении с молекулярной формулой глюкозы С6Н12О6 внимание учащихся может быть обращено на значительное содержание кислорода в этом веществе. Учащимся уже известен ряд кислородсодержащих органических веществ (спирты, альдегиды, кислоты и др.). Поэтому может быть поставлен вопрос: не содержит ли глюкоза ранее изученные функциональные группировки атомов? Испытывая раствор глюкозы лакмусом, убеждаются, что глюкоза не является кислотой.
Исходя из наличия большого количества атомов кислорода в молекуле, можно высказать предположение о принадлежности глюкозы к многоатомным спиртам и проверить это предположение реакцией с гидроксидом меди (II), известной учащимся по многоатомному спирту — глицерину.
Так как гидроксид натрия в этой реакции должен быть в избытке (с. 90), то опыт лучше продемонстрировать в следующем порядке.
В демонстрационной пробирке или в стакане к 50 мл 10-процентного раствора глюкозы приливают около 10 мл раствора едкого натра и по каплям добавляют раствор сульфата меди. При взбалтывании смеси наблюдают образование темно-синей окраски — результат взаимодействия гидроксида меди (II) с глюкозой. Чтобы учащиеся сознательно отнеслись к этому опыту, следует с ними вспомнить предварительно образование глицерата меди.
Дальнейшим шагом в изучении строения глюкозы было бы определение числа гидроксильных групп в молекуле. Однако экспериментальное решение этого вопроса в школьных условиях затруднительно. Поэтому учитель лишь сообщает, что число гидроксильных групп в молекуле глюкозы может быть выяснено на основе изучения реакции этерификации. Известен, например, пентауксусный эфир глюкозы*. Поскольку уксусная кислота одноосновна, то очевидно, что в молекуле глюкозы содержится пять гидроксильных групп. Так как гидроксильные группы (что известно учащимся) могут находиться лишь у разных атомов углерода, то делается заключение о том, что с ними связано 5 углеродных атомов в молекуле глюкозы.
Дальнейшая задача будет заключаться в том, чтобы установить, какая еще функциональная группа находится у шестого атома углерода. Поскольку это не гидроксильная (спиртовая) и не карбоксильная (кислотная) группа, то можно предположить: не является ли она альдегидной?
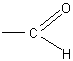
Реакция альдегидной группы. Учащимся известна характерная реакция альдегидов — реакция серебряного зеркала. Этой реакцией и пользуются, чтобы проверить, не является ли глюкоза альдегидом, одновременно с принадлежностью ее к многоатомным спиртам.
а) В хорошо вымытую (щелочью, а затем хромовой смесью и водой) колбочку наливают 20 мл аммиачного раствора гидроксида серебра и прибавляют 10 мл 10-процентного раствора глюкозы. Смесь слегка нагревают, держа колбочку над пламенем горелки или поместив ее в стакан с горячей водой. Быстро образуется ровный блестящий слой серебра. При добавлении раствора глюкозы к аммиачному раствору гилроксида серебра вначале образуется темный осадок. Он не помешает появлению зеркала при нагревании смеси.
Опыт с несомненностью устанавливает наличие альдегидной группы атомов в молекуле глюкозы.
Если принять теперь во внимание, что атомы углерода составляют прямую цепь, то расшифрованную часть молекулы можно будет изобразить в таком виде:
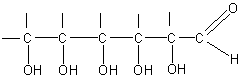
Оставшиеся 6 атомов водорода присоединены, очевидно, за счет неиспользованных валентностей атомов углерода.
б). Реакция с гидроксидом меди (II). Если со второй характерной реакцией альдегидов — восстановлением гидроксида меди — учащиеся ранее не были ознакомлены (с. 101), то ее необходимо рассмотреть здесь. Она потребуется в дальнейшем при определении продуктов гидролиза полисахаридов. При нагревании альдегидов с гидроксидом меди (11) прежде всего образуется желтый осадок гидроксида меди (I), который при дальнейшем нагревании превращается в красный оксид меди (I).
В демонстрационной пробирке к 10—15 мл 10-процентного раствора глюкозы приливают равный объем разбавленной щелочи и 1 мл разбавленного раствора сульфата меди (II). Нагревают в пламени спиртовки образовавшийся темно-синий раствор. Наблюдают образование желтого, а затем красного осадка.
Чтобы образование красного осадка было отчетливым, не следует пользоваться концентрированными растворами щелочи и медного купороса и нельзя приливать сульфата меди слишком много (должен быть избыток щелочи). При несоблюдении этих условий вместо красного осадка иногда образуется желтый или бурый осадок (вследствие частичного образования черного оксида меди (II)).
Доказательство принадлежности глюкозы одновременно к многоатомным спиртам и альдегидам может быть проведено в одном опыте. Такой опыт требует очень немного времени и уместен при обобщающих ответах учащихся и на практических занятиях.
К раствору глюкозы приливают раствор щелочи и, как было описано выше, очень немного раствора сульфата меди. Появляется темно-синее окрашивание, что свидетельствует о принадлежности глюкозы к многоатомным спиртам. При нагревании раствора сначала образуется желтый, а затем красным осадок оксида меди (I), что указывает на наличие в глюкозе и альдегидной группы.
Обнаружение глюкозы во фруктах и ягодах. С помощью реакции восстановления гидроксидом меди Сu(ОН)2 проверяют наличие глюкозы в виноградном соке, цветах клевера, меде, соке малины, в спелых яблоках и т.п.
Брожение глюкозы. Демонстрация брожения глюкозы необходима в том случае, если соответствующий опыт не ставился при изучении спиртов. Опыт выполняют, пользуясь приведенным ранее описанием (с. 82).
САХАРОЗА
Изменение сахара при нагревании. Опыты нагревания сахара могут быть поставлены как в виде демонстрации, так и в виде домашней работы учащихся.
Нагревают в пробирке или фарфоровой чашке толченый сахар до плавления (160°С). Выливают часть расплава на бумагу. По мере остывании образуется леденец.
При более сильном нагревании (до 200°С и выше) сахар окрашивается в желтый цвет, при этом образуется карамель. Если са
хар нагревают далее, он еще более темнеет и наконец обугливается, выделяя белый дым: сухая перегонка. Выделяющиеся газообразные продукты можно поджечь. Легко можно составить коллекцию разнообразных продуктов, образующихся при нагревании сахара. При всяком изменении окраски часть расплава отливают в маленькую пробирочку, где он и застывает. Пробирочки монтируют на щитке в порядке углубления окраски сахара.
Обугливание сахара концентрированной серной кислотой. Серная кислота, отнимая у сахара молекулы воды и частично окисляя его, освобождает чистый углерод.
В небольшом химическом стакане смачивают водой 10 г толченого сахара и прибавляют равный объем концентрированной серной кислоты. Через непродолжительное время сахар начинает обугливаться и сильно вспучиваться за счет выделения газов (СО2 и SO2). Если черная масса станет выходить из стакана, его следует поставить в кристаллизатор.
Обнаружение гидроксильных групп в сахаре. С гидроксидами металлов сахар как вещество, богатое гидроксильными группами, дает сахараты.
а) Взаимодействие с гидроксидом меди (II). В демонстрационной пробирке или химическом стакане получают небольшое количество гидроксида меди (II) взаимодействием растворов медного купороса и едкого натра. Приливают к осадку раствор сахарозы. Образуется синий раствор сахарата меди.
б) Взаимодействие с гидроксидом кальция. С гидроксидом кальция сахароза образует растворимые в воде сахараты (например, С12Н22О11• СаО), дающие при нагревании осадок трисахарата С12Н22О11 • ЗСаО и разрушающиеся при пропускании углекислого газа. Образование растворимых сахаратов и разрушение их углекислым газом лежат в основе технического извлечения сахара из свеклы.
К 20-процентному раствору сахара прибавляют постепенно известковое молоко (не известковую воду!), постоянно перемешивая жидкость. Гидроксид кальция при этом растворяется.
Чтобы показать, что растворение извести происходит вследствие образования сахарата, ставят параллельный опыт: приливают такое же примерно количество известкового молока к воде того же объема, что и взятый раствор сахара. Заметного растворения мути в этом случае не наблюдается.
После того как растворение извести в растворе сахара прекратится, сливают прозрачный раствор (при необходимости фильтруют) и делят его на две части.
Одну часть нагревают до кипения: образующийся трехкальцие-вый сахарат выпадает в осадок
Во вторую часть раствора пропускают углекислый газ и наблюдают образование осадка карбоната кальция.
Опыт можно провести более быстро, если к раствору сахара сразу прилить избыток известкового молока, отфильтровать раствор сахарата, разделить его на 2 части и затем поступить, как указано выше.
Отношение сахарозы к раствору оксида серебра и гидроксида меди ( II). К аммиачному раствору оксида серебра прибавляют раствор сахарозы и поступают, как указано для альдегидов. Восстановление серебра не наблюдается.
К раствору сахарозы прибавляют половинный объем раствора едкого натра и затем немного раствори сульфата меди (II). При нагревании смеси красный осадок оксида меди (I) не образуется.
Гидролиз сахарозы. Известно, что в обычных условиях гидролиз сахарозы идет очень медленно. Скорость его сильно возрастает при действии катализаторов (энзимов или кислот). Продуктами гидролиза сахарозы являются глюкоза и фруктоза:
С12Н22О11 + Н2О à С6Н12O6 + С6Н12O6
а) В две демонстрационные пробирки помещают по кусочку пиленого сахара, растворяют сахар в равных объемах воды (примерно в 15 мл). В одну из пробирок добавляют 1 мл раствора соляной кислоты. Содержимое обеих пробирок кипятят в течение 3-5 мин. После этого нейтрализуют кислоту щелочью и оба раствора испытывают на реакцию восстановления гидроксида меди (II).
Раствор, где кипячение производилось в присутствии кислоты, восстанавливает Сu(ОН)2 в Сu2О. В нем. следовательно, прошел гидролиз с образованием моносахаридов. Кипячение же без катализатора оказалось недостаточным для гидролиза.
б) Гидролизом сахарозы с кислотой можно получить искусственный мед, так как мед представляет собой в основном смесь тех же продуктов (глюкозы и фруктозы), которые образуются при гидролизе сахарозы.
Пять кусочков пиленого сахара растворяют в небольшом количестве воды, добавляют 0,5-1 мл разбавленной химически чистой серной кислоты и нагревают на водяной бане в течение часа. Затем раствор охлаждают, нейтрализуют кислоту мелом (при нейтрализации щелочью в растворе осталась бы соль), добавляя порошок его мелкими порциями, пока не перестанет выделяться углекислый газ, и отфильтровывают осадок сульфата кальция. Раствор упаривают на водяной бане до состояния сиропа, не давая ему при этом подгорать, и пробуют на вкус.
В опыте не следует брать много кислоты, так как каталитичес-
кое действие ее от этого почти не изменяется, а избыток ее разрушает фруктозу.
в) Получение искусственного меда можно упростить, если в качестве катализатора воспользоваться кислотой, не требующей дальнейшей нейтрализации и фильтрования.
К 100 мл водного раствора сахара, имеющего вид негустого сиропа, прибавляют примерно 1 г лимонной кислоты и нагревают раствор на водяной бане в течение 30-40 мин. Получающаяся смесь глюкозы и фруктозы напоминает по вкусу мед. Для придания ей аромата можно прибавить немного натурального меда.
Получение сахара из свеклы. Как показывает практика, учащиеся с большим желанием ставят работу по извлечению сахара из свеклы, несмотря на трудоемкость этого опыта. Их привлекает здесь возможность копировать в миниатюре все важнейшие процессы промышленного способа получения сахара. В процессе работы может быть сконструирована установка той или иной степени сложности, которая может быть показана в классе при рассмотрении основных этапов технологии производства сахара.
а) 400—500 г сахарной свеклы хорошо промывают и нарезают в виде мелкой стружки или истирают на терке. Свеклу помещают в большой химический стакан, добавляют к ней равное количество горячей воды и смесь нагревают полчаса при 70—80"С. Полученный раствор сливают, а к свекле добавляют новую порцию горячей воды и снова нагревают. Через тот же промежуток времени образовавшийся раствор прибавляют к ранее полученному и ту же операцию проделывают в третий раз. Так, применяя всякий раз чистую воду, удается полнее извлечь сахар из свеклы, чем при однократной обработке свеклы большим количеством воды.
Полученный сок фильтруют от посторонних примесей через ткань. Готовят известковое молоко из 15 г оксида кальция и добавляют его к свекловичному соку. Смесь нагревают в течение 15 — 20 мин (на водяной бане). При этом под действием извести происходит осаждение органических кислот, белковых и других органических веществ, а сахар остается в виде сахарата в растворе.
Далее раствор фильтруют в другую колбу и пропускают в него углекислый газ. При этом сахарат разлагается: известь в виде карбоната выпадает в осадок, а сахар в свободном виде остается в растворе. Пропускание углекислого газа продолжают с таким расчетом, чтобы раствор остался слабощелочным (при нанесении капли раствора на фильтровальную бумажку, смоченную фенолфталеином, бумажка должна окраситься в бледно-розовый цвет). Это дает гарантию, что несахаристые вещества, находящиеся в соединении с известью, при этом не будут разложены.
Полученный раствор, содержащий иногда до 10% сахара, имеет желтоватый цвет. Обесцвечивают его фильтрованием через свежепрокаленный уголь.
Пробу раствора подвергают гидролизу (кипячение с небольшим количеством H2SО4) и открывают глюкозу реакцией с гидроксидом меди (II).
После этого раствор упаривают на водяной бане (желательно в вакууме, чтобы не было подгорания сахара) до уменьшения объема примерно в 5 раз и оставляют кристаллизоваться. Для затравки можно бросить в раствор несколько крупинок сахарного песка.
Чтобы получить наиболее чистый продукт, выделившийся сахар следует перекристаллизовать. Для этого его отделяют от патоки, кристаллы растворяют в очень небольшом количестве горячей воды и оставляют в кристаллизаторе до следующего занятия или осторожно выпаривают до образования кристаллов, не доводя при этом раствор до полного обезвоживания.
Принцип конструирования учащимися «производственной установки» заключается в том, чтобы не переливать в работе растворы из одной колбы в другую, а последовательно соединить ряд колб, чтобы растворы можно было перекачивать из одного сосуда в другой с помощью пульверизационной груши (пуская их в случае необходимости предварительно на фильтр).
б) Получение сахара из свеклы можно осуществить проще, если процесс извлечения его водой вести при обычной температуре. В таком случае несахаристые вещества в значительной степени удерживаются волокнами клеток и очистка сока упрощается.
500 г промытой свеклы протирают на терке и затем еще растирают в фарфоровой ступке до состояния пасты. Переносят пасту в большую колбу и приливают к ней 500 мл 15-процентного взмученного известкового молока. Закрыв колбу пробкой, встряхивают содержимое время от времени в течение нескольких часов. При этом происходит одновременно извлечение сахара из свеклы. Затем отжимают свеклу через ткань, собирая сок в стакан. Выжимки с ткани переносят в ту же колбу, добавляют 300 г воды и через некоторое время вновь отжимают. Обе порции сока соединяют и пропускают в него углекислый газ до полного осаждения извести. Сначала сок фильтруют на установке под вакуумом, а затем, если он имеет желтоватый вид, через слой активированного угля. Этот сок упаривают на водяной бане до уменьшения объема раствора примерно в 5—7 раз и оставляют кристаллизоваться. В качестве затравки в раствор можно поместить несколько крупинок сахарного песка.
КРАХМАЛ
Учащиеся должны познакомиться со свойствами крахмала, так как он является важнейшим углеводом в питании человека. Доступность этого вещества для школьной лаборатории позволяет осуществить с ним богатую серию опытов.
Приготовление крахмального клейстера. Учащиеся знакомятся вначале с цветом крахмала, с характерным хрустом его при растирании между пальцами, а затем испытывают растворимость его в холодной воде. Для этого очень небольшое количество крахмала взбалтывают с водой в пробирке. Крахмал оседает на дно пробирки.
Для растворения крахмала в горячей воде неудобно нагревать полученную в предыдущем опыте смесь его с водой, так как оседающий на дно плотный слой крахмала вызывает перегрев стекла, вследствие чего пробирка может лопнуть. Поэтому опыт ставят по одному из следующих вариантов:
1. В ступке или фарфоровой чашке растирают немного крахмала с небольшим количеством воды, переносят смесь в пробирку, разбавляют водой и нагревают до кипения при постоянном перемешивании.
2. В 4—5 мл воды взмучивают небольшую щепотку крахмала и образующуюся суспензию понемногу выливают в другую пробирку или стаканчик с кипящей водой. Образующийся раствор при этом постоянно перемешивают. Убеждаются, что в обоих случаях крахмал не осаждается на дно пробирки, а образует коллоидный раствор, который называется крахмальным клейстером.
Реакция крахмала с йодом. Крахмал дает с раствором йода характерное синее окрашивание. С помощью йода удается открывать самые незначительные количества крахмала.
Так как иод почти нерастворим в воде, то для опытов используют спиртовой раствор или водный, но с иодидом калия (с которым иод дает комплексное соединение). В первом случае можно воспользоваться йодной тинктурой (приобретенной в аптеке), разбавив ее водой примерно в 20 раз (иод в присутствии спирта останется в растворе). Во втором случае готовят раствор из расчета 100 мл воды, 2—3 г иодида калия и 1 г йода.
1. В демонстрационный цилиндр наливают 3—5 мл полученного в предыдущем опыте клейстера, разбавляют его водой (1 : 20) и добавляют немного раствора йода. Наблюдается появление синей окраски (белый фон!).
Часть синего раствора наливают в другую демонстрационную пробирку и нагревают. При нагревании синяя окраска исчезает, так как образующееся соединение крахмала с йодом неустойчиво. При охлаждении раствора синяя окраска вновь появляется.
2. Учащимся может быть дано задание определить порог чувствительности данной реакции. Для этого они из навески промытого водой на фильтре и высушенного крахмала готовят крахмальный клейстер. Вычисляют, сколько крахмала содержится в каждом миллилитре клейстера. Отбирая пробы клейстера и разбавляя их разными объемами воды, вычисляют, при какой концентрации крахмала синяя окраска становится едва уловимой.
Исследование различных продуктов на присутствие крахмала. Реакцию с йодом учащиеся могут применить для открытия крахмала в различных продуктах. Частично эта работа может быть выполнена в классе. С успехом она может быть также проведена в виде домашнего практического занятия.
На присутствие крахмала могут быть проверены: картофельная мука, картофель (сырой в тонком срезе и вареный), обычная мука, белый хлеб, зеленое яблоко, пудра, рис и т.д.
Гидролиз крахмала. Демонстрация гидролиза крахмала прежде всего существенна в теоретическом отношении, так как устанавливает (по продуктам гидролиза) принадлежность крахмала к классу углеводов. Она знакомит учащихся также с химическими основами гидролизных производств и готовит их к практическому получению из крахмала различных продуктов в процессе внеклассной работы. Наконец, она показывает частично те превращения, которые претерпевает крахмал в организме человека.
Поэтому демонстрация гидролиза должна быть проведена по крайней мере в двух вариантах: с помощью минерального катализатора {серной кислоты) и с помощью ферментов.
В том, что крахмал подвергается гидролизу, можно убедиться как по исчезновению крахмала (отсутствие синего окрашивания с йодом), тик и по появлению глюкозы (восстановление гидроксида меди).
Гидролиз крахмала идет через образование целого ряда промежуточных продуктов. Конечным продуктом гидролиза крахмала является глюкоза. Учащимся дается только итоговое уравнение реакции:
(С6Н12O6)n + nH2O à С6Н12O6
Чтобы дли обнаружения глюкозы не получать каждый раз гидроксид меди (II), пользуются раствором Фелинга.
Кратко разъясняем учащимся, что фелингова жидкость представляет собой в основном гидроксид меди (II), но он находится здесь благодаря присутствию сегнетовой соли в растворенном состоянии, вследствие чего при нагревании не образуется оксид меди (II), загрязняющий осадок.
Уравнение реакции раствора Фелинга с альдегидами пишется, как и для гидроксида меди (II), согласно схеме:
Cu(OH)2 à CuOH à Сu2О
Приготовление фелинговой жидкости: а) в 100 мл воды растворяют 3,5 г медного купороса (крист); б) в 100 мл воды растворяют 17,3 г сегнетовой соли (крист.) и 6 г едкого натра. Растворы хранят отдельно. Перед уроком получают нужное количество жидкости, смешивая равные объемы растворов.
Чтобы в дальнейших опытах раствор крахмала до гидролиза не дал реакции с фелинговой жидкостью, крахмал предварительно следует промыть на фильтре водой.
а) В химическом стаканчике разбавляют 5—8 мл крахмального клейстера тройным объемом воды и прибавляют 1—2 мл раствора серной кислоты.
На небольших пробах убеждаются, что раствор содержит крахмал (реакция с йодом) и не содержит глюкозы (отсутствие реакции с фелинговой жидкостью после нейтрализации кислоты щелочью).
Кипятят раствор в стаканчике в течение 5 мин, затем отбирают пробу, нейтрализуют ее щелочью и нагревают с раствором Фелинга. Образование красного оксида меди (I) указывает на появление глюкозы. Реакцией с йодом проверяют, прошел ли полностью гидролиз крахмала. Если крахмал обнаруживается, то продолжают кипятить раствор до тех пор, пока проба его не перестанет давать синюю окраску с йодом. Чтобы не тратить времени на охлаждение каждой пробы, можно несколько капель его вносить в значительный объем раствора йода.
б) Споласкивают рот 2—3 раза водой. Раствор слюны каждый раз переносят в небольшой стаканчик. Приливают туда же равный объем крахмального клейстера, добавляют фелингову жидкость и смесь нагревают. Образуется красный оксид меди (I). Параллельно можно убедиться, что ни крахмал, ни слюна при нагревании с фелинговым раствором в отдельности оксида меди (I) не образуют.
Строго говоря, при действии фермента слюны (амилазы) крахмал гидролизуется не до глюкозы, а до дисахарида мальтозы. Однако нет необходимости фиксировать внимание учащихся на этой детали, тем более что мальтоза, подобно глюкозе, восстанавливает гидроксид меди (II).
в) В штатив помещают 6 пробирок с раствором йода. В химическом стакане готовят смесь крахмального клейстера, воды и серной кислоты, как указано выше. Две-три капли смеси переносят пипеткой в первую пробирку с раствором йода. Затем начинают
кипятить смесь в стаканчике и отбирают пробы через каждые две-три минуты, внося их в следующие пробирки. В пробирках образуется гамма окрасок: синяя, фиолетовая, красно-бурая; в последней пробирке (или в последних) окраска раствора не изменяется. Полученные окраски соответствуют различным декстринам, образующимся в процессе постепенного гидролиза крахмала. Наиболее простые декстрины, так же как мальтоза и глюкоза, вовсе не окрашиваются йодом.
С помощью раствора Фелинга убеждаются, что жидкость, остающаяся после отбора вышеуказанных проб, содержит глюкозу.
г) Подобным же способом можно проследить последовательность гидролиза крахмала под действием амилазы слюны. В химическом стаканчике смешивают немного слюны с крахмальным клейстером и через каждые 1-2 мин (без нагревания) вносят пробы этой смеси в раствор йода. Наблюдают аналогичный результат.
Получение патоки и глюкозы из крахмала. Эта работа состоит как бы из двух частей: из гидролиза крахмала, что отработано по существу в предыдущих опытах, и из извлечения образующейся глюкозы в виде патоки или кристаллического продукта, что в предыдущих опытах не ставилось из-за недостатка времени на уроке. Предлагаемый опыт довольно полно воспроизводит классическую работу адъюнкта Российской Академии наук Константина Кирхгофа, открывшего гидролиз крахмала еще в 1811 г., а кроме того, иллюстрирует промышленный способ получения патоки и глюкозы.
В круглодонную колбу емкостью 500—1000 мл наливают 100 мл воды и 2 мл концентрированной серной кислоты. Нагревают раствор кислоты до кипения и к нему очень медленно, следя за тем, чтобы не прерывалось кипячение, приливают взмученную смесь 25 г крахмала с небольшим количеством воды. В колбе образуется крахмальный клейстер. Колбу закрывают пробкой с обратным воздушным холодильником и кипятят около часа. После того как проба жидкости из колбы перестанет давать окраску с раствором йода, процесс гидролиза можно считать законченным.
Чтобы выделить глюкозу из раствора, следует предварительно удалить примесь серной кислоты. Для этого к охлажденному раствору добавляют небольшими порциями тонко измельченный мел (карбонат кальция) до прекращения выделения углекислого газа, сильно взбалтывая всякий раз реакционную смесь. Когда при добавлении новой порции мела не будет слышно характерного шипения, серная кислота оказывается нейтрализованной. Для нейтрализации кислоты можно воспользоваться также известковым молоком. Затем отделяют осадок сульфата кальция фильтрованием через складчатый фильтр или на воронке Бюхнера и упаривают раствор глюко-
зы в фарфоровой чашке на водяной бане. При концентрировании раствора может снова выпасть осадок гипса. Осадок снова отфильтровывают и продолжают упаривание раствора до густоты сиропа. Образовавшийся густой сироп (патоку) можно попробовать на вкус и испытать фелинговым раствором и раствором йода.
Патоку оставляют стоять в течение нескольких дней. При этом выкристаллизовывается глюкоза. Более быструю кристаллизацию можно наблюдать, если капли патоки нанести на стеклянные пластинки и поместить в них затравку - крупинки глюкозы.
Полученную глюкозу можно подвергнуть брожению.
При проведении опыта необходимо учитывать следующие обстоятельства:
· кислоты в качестве катализатора нельзя брать слишком много, иначе долго не будет достигнут момент нейтрализации и обильный осадок гипса вызовет потерю глюкозы;
· следует по возможности точно уловить момент нейтрализации (контроль лакмусовой бумажкой), чтобы по тем же соображениям избежать избытка мела;
· Упаривать раствор надо осторожно, чтобы не вызвать разложения сахара.
Если хотят получить патоку, а не глюкозу, гидролиз не доводят до конца: патока - это смесь простых декстринов с глюкозой
Получение крахмала из картофеля. Несколько клубней картофеля тщательно моют, очищают от кожицы (необязательно) и истирают на терке. При истирании картофеля зерна крахмала освобождаются от заключающих их клеточных оболочек. Образовавшуюся кашицу тщательно перемешивают с двойным объемом воды и процеживают через тонкое сито или марлю. Крахмальные зерна в виде «крахмального молока» при этом отделяются от оболочек клеток и других веществ. Остаток на сите или в марле промывают водой до тех пор, пока не начнет проходить почти чистая вода.
Из «крахмального молока» примерно в течение часа отстаивается осадок крахмала. Декантируют с осадка водный раствор и крахмал дважды промывают чистой водой, всякий раз тщательно перемешивая и давая осесть крахмалу.
Промывку крахмала следует делать потому, что остающиеся в нем примеси темнеют на воздухе и окрашивают его в грязный цвет.
Наконец крахмал отделяют от воды (декантацией или фильтрованием) и сушат на воздухе. Проверяют его на хруст, растирая между пальцами, готовят немного крахмального клейстера и испытывают раствором йода.
Подобную работу в большем масштабе учащиеся могут с пользой выполнить в домашних условиях.
КЛЕТЧАТКА (ЦЕЛЛЮЛОЗА)
Основная идея опытов по данному разделу — показать разнообразные применения клетчатки, основанные на использовании ее химических свойств. В связи с этим опыты подразделяются па три основные группы: а) гидролиз клетчатки, вскрывающий принадлежность ее к классу углеводов и иллюстрирующий основной процесс современной гидролизной промышленности; б) нитрование клетчатки, показывающее использование ее для производства взрывчатых веществ.
Из сказанного видно, что материал данного раздела имеет существенное значение для практического ознакомления учащихся с научными основами современных химических производств.
Гидролиз клетчатки до глюкозы. Одним из характерных и практически важных свойств клетчатки как представителя полисахаридов является ее гидролиз до более простых продуктов.
Конечным продуктом гидролиза клетчатки, как и крахмала, является глюкоза:
(С6Н12O6)n + nH2O à С6Н12O6
Гидролиз клетчатки также катализируется минеральными кислотами.
В настоящее время в промышленности гидролизом клетчатки (преимущественно древесины) и последующим сбраживанием образующейся глюкозы получают этиловый спирт и другие продукты.
Опыты по гидролизу могут ставиться с различной полнотой: от констатации наличия глюкозы в гидролизате до извлечения глюкозы в твердом виде.
а) В ступке смачивают кусочек чистой фильтровальной бумаги или ваты концентрированной серной кислотой и растирают пестиком. Полученный раствор переносят в демонстрационную пробирку или химический стакан с небольшим количеством воды (2-3 мл) и кипятят в течение 5 мин. После этого часть раствора нейтрализуют щелочью и нагревают с фелинговой жидкостью. Образование красного оксида меди (I) указывает на появление глюкозы.
Параллельно можно провести контрольный опыт: кипятить столько же времени фильтровальную бумагу или вату с водой без кислоты. При последующем нагревании этой жидкости с фелинговым раствором осадок оксида меди (I) не образуется.
б) Для демонстрации процесса гидролиза клетчатки можно воспользоваться древесными опилками. Этот опыт будет поучительнее предыдущего, так как с большим приближением иллюстрирует современное гидролизное производство.
1—2 г древесных опилок смачивают в химическом стакане водой, прибавляют 2—3 мл концентрированной серной кислоты, затем 30—50 мл воды и кипятят 8—10 мин. После этого часть еще горячего раствора фильтруют через складчатый фильтр, фильтрат нейтрализуют щелочью и нагревают с фелинговым раствором. Образуется красный оксид меди (1).
Параллельно может быть поставлен опыт нагревания опилок с водой без кислоты. Получающийся в этом случае раствор не дает с фелинговой жидкостью оксид меди (I).
Время, в течение которого идет кипячение смеси опилок с кислотой, может быть использовано для разъяснения учащимся сущности гидролизного производства и его значения.
в) Предыдущие опыты дают представление о реакции гидролиза клетчатки и о получаемом продукте, но еще не знакомят с основными стадиями гидролизного производства. Как показала практика, в школьных условиях можно поставить опыт, более полно отражающий промышленный способ осахаривания древесины.
Ввиду длительного времени некоторые операции опыта (нейтрализация кислоты и фильтрование) можно выполнить вне урока.
Наиболее распространенный в промышленности способ осахаривания древесины состоит в нагревании ее с очень разбавленной серной кислотой (0,5%) под давлением до 10 ат. В школе, естественно, нельзя поставить опыт с применением автоклава, да в этом и нет особой необходимости, так как не ставится задача получения максимально возможного выхода глюкозы. Зато можно несколько повысить концентрацию серной кислоты, чтобы ускорить процесс.
К 1-1,5 г древесных опилок в колбе прибавляют 14 мл серной кислоты (6 мл воды и 8 мл концентрированной серной кислоты). Смесь встряхивают примерно в течение 10 мин, одновременно прогревая ее немного в пламени спиртовки. Затем к ней приливают 150—200 мл воды, закрывают колбу пробкой с обратным холодильником и кипятят в течение 10-15 мин.
Раствор фильтруют в большую коническую колбу. К фильтрату добавляют небольшими порциями тонко измельченный мел, все время энергично круговыми движениями перемешивая смесь до тех пор, пока не прекратится выделение углекислого газа (шипение) и лакмусовая бумажка не покажет, что серная кислота нейтрализована:
СаСО3 + H2SO4 à- CaSO4 + Н2О + СО2
Вместо мела можно применить известковое молоко или баритовую воду.
Раствор фильтруют от обильного осадка сульфата кальция. С помощью фелингова раствора убеждаются в наличии глюкозы в фильтрате. Упаривают раствор в фарфоровой чашке на водяной бане до небольшого объема жидкости.
Так как фильтрование и упаривание занимают много времени, то эта часть опыта может быть поставлена в двух вариантах: учащимся сообщается, что эти операции будут выполнены после урока и на следующем занятии из концентрированного раствора будет извлечен сахар, или же берется упаренный раствор, заранее подготовленный учащимися в кружке. Второй путь более удобный, так как не нарушает логической стройности урока и ведет к лучшим результатам. Последнее объясняется тем, что в процессе внеклассной работы учащиеся могут продолжительное время обрабатывать опилки слабо разбавленной кислотой (от 2 ч до суток) и длительное время кипятить их с сильно разбавленной кислотой (до 2 ч), что приведет к большему выходу продукта.
Сконцентрированный раствор глюкозы выпаривают в фарфоровой чашке на водяной бане. При этом следят за тем, чтобы выделяющийся сахар по возможности не подгорал. На дне чашки по мере испарения воды образуется немного глюкозы, обычно светло-желтого цвета (вследствие частичного разложения органических примесей). Полученный продукт можно испробовать на вкус — учащиеся убеждаются в его сладком вкусе. В классе ощущается запах горелого сахара, так как при выпаривании без вакуума не удается избежать частичного разложения. Растворив полученный продукт в воде и добавив дрожжей, в соответствующих условиях можно наблюдать реакцию брожения (по выделению углекислого газа), что подтверждает образование сахара из древесины.
Нитрование клетчатки и опыты с нитроклетчаткой. В зависимости от концентрации применяемой азотной кислоты и времени нитрования получаются, как известно, различные продукты. Для полного нитрования клетчатки в соответствии с уравнением нужна дымящая азотная кислота (уд. вес 1,52), которой обычно школы не располагают.
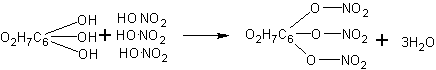
В случае применения азотной кислоты удельного веса 1,4 нитрование обычно не доходит до образования тринитроклетчатки. Однако с полученным продуктом удается проделать все необходимые опыты, иллюстрирующие свойства нитроклетчатки.
В химическом стаканчике готовят смесь 5 мл концентрирован-
ной азотной кислоты (уд. вес 1,4) и 10 мл концентрированной серной кислоты (уд. вес 1,84). После того как смесь примет комнатную температуру, в нее погружают минут на 10—15 комочек ваты, перемешивая его с кислотами стеклянной палочкой. Затем вату промывают водой в большом химическом стакане и в струе под водопроводным краном. После этого нитроклетчатку отжимают и высушивают в листах фильтровальной бумаги, неоднократно меняя их и разрыхляя каждый раз вату.
Полного высушивания нитрованной ваты на уроке не достичь; однако дальнейшие опыты удаются и со слегка влажной нитроклетчаткой. Можно также взять для опытов ранее заготовленную нитроклетчатку.
а) Горение нитроклетчатки. В пламени спиртовки поджигают одновременно небольшой комочек ваты и полученного нитропродукта (взятые в щипцы). Первый образец горит медленно, второй сгорает моментально.
Головку одной спички обертывают ватой, другой спички — нитроклетчаткой. Вату и нитроклетчатку поджигают. Вслед за горением ваты спичка вспыхивает, нитроклетчатка же сгорает настолько быстро, что спичка не успевает воспламениться.
б) Получение бездымного пороха. Немного нитроклетчатки в стакане смачивают этилацетатом или ацетоном до образования студенистой массы. После высыхания образуется бездымный порох. Извлекают часть его и поджигают. Горение происходит менее интенсивно, чем у нитроклетчатки.
ГЛАВА X
АМИНЫ. КРАСИТЕЛИ
Изучению аминов в курсе органической химии предшествует изучение нитросоединений. Оно проводится преимущественно в плане обобщения, так как с отдельными представителями этого класса веществ учащиеся знакомились ранее. В связи с этим опыты для изучения нитробензола, пикриновой кислоты и других нитросоединений описаны в предыдущих главах и здесь не приводятся.
Опыты с алифатическими (жирными) аминами ниже даны сравнительно в небольшом количестве, так как эти соединения совершенно не рассматриваются в курсе химии или о них сообщаются лишь краткие сведения.
Красители, даже самые простейшие, обычно не изучаются в школе. Однако, учитывая большое образовательное значение знакомства с ними и высокий интерес учащихся к синтетической химии, ниже мы даем серию опытов для внеклассной работы
ЖИРНЫЕ АМИНЫ
Основная идея опытов с жирными аминами заключается в том чтобы представить амины как органические основания
В соответствии с этим наиболее важными Являются опыты окрашивания лакмуса водным раствором аминов; реакция солеобразования с кислотами; реакция выделения аминов из солей действием щелочей. Уяснение этих явлений позволит учащимся понять в дальнейшем свойства важнейшего представителя ароматических аминов — анилина.
Методическая сложность проведения опытов заключается в том, что начинать их приходится с получения аминов, чтобы иметь возможность далее демонстрировать их свойства Реакция же получения аминов действием щелочей на их соли не может быть понята учащимися до тех пор, пока они не познакомятся со свойствами этих соединений.
Поэтому при получении аминов на уроке тем или иным способом химизм образования их не рассматривают, а сразу переходят к изучению свойств. Возвращаются же к химизму лишь тогда, когда будет показано, что амины образуют с кислотами coли (например CH3NH2 + HCI à CH3NH3CI) и могут быть выделены из последних щелочами (CН3NH2•HCI + NaOH à СН3 NH + NaCI + Н2О)
Получение аминов из селедочного рассола. В селедочном рассоле содержится значительное количество аминов, преимущественно диметиламина (CH3)2NH и триметиламина (СН3)3N. Их присутствием и обусловливается характерный запах рассола
При отсутствии хлористоводородной соли метиламина вполне можно воспользоваться селедочным рассолом для практического ознакомления со свойствами жирных аминов
а) В большую круглодонную колбу с отводной трубкой наливают 15-20 мл селедочного рассола, добавляют 6-7 мл концентрированного раствора гидроксида натрия (раствор должен быть сильно щелочным), нагревают и отгоняют амины в пробирку с водой, охлаждаемую снегом или льдом. Через несколько минут образуется раствор, с которым можно проделать следующие опыты иллюстрирующие основные свойства аминов.
К части раствора приливают нейтральный раствор лакмуса или раствор фенолфталеина. Лакмус синеет, фенол-фталеин становится
малиновым. Делается вывод о том, что продукт соединения аминов с водой (рассматривать можно на примере метиламина) обладает щелочными свойствами, подобно раствору аммиака:
NН3 + НОН à NH4OH
CH3NH2 + НОН à CH3NH3OH
К части раствора приливают раствор хлорида железа (III). Параллельно ставят опыт взаимодействия хлорида железа (III) с раствором аммиака. Наблюдают образование одинаковых осадков, что подтверждает основные свойства водного раствора амина:
FeCI3 + 3NH4OH à Fe(OH)3 + 3NH4CI
FeCl3 + 3CH3NH3OH à Fe(OH)3 + 3CH3NH3CI
Кипятят в пробирке немного полученного раствора с добавкой щелочи и к выделяющимся парам подносят лучинку, смоченную концентрированной соляной кислотой. Образуется белый дым хлорида метиламмония (черный фон!).
Предыдущие опыты показывают большое сходство аминов с аммиаком. Для установления отличия их от аммиака и принадлежности к органическим соединениям демонстрируют горючесть аминов. Кипятят раствор амина и поджигают пары его у отверстия пробирки.
Последние два опыта получаются лишь в том случае, если, пользуясь селедочным рассолом, удается получить не слишком слабый раствор аминов.
б) Нагревают в колбе смесь селедочного рассола со щелочью, как было указано выше. К отводной трубке колбы подносят влажную лакмусовую бумажку, бумажка синеет. Подносят стеклянную палочку, смоченную концентрированной НСI, образуется белое облачко хлоридов аминов. Поджигают пары аминов у отводной трубки, они горят бледным пламенем. Пропускают пары в раствор хлорида железа (III), образуется осадок гидроксида железа (III).
Получение метиламина из хлористоводородной соли и опыты с ним. Предварительно учащиеся знакомятся с запахом метиламина. Для этого в пробирке или на стекле к небольшой щепотке хлорида метиламина они прибавляют 5—7 капель концентрированного раствора щелочи. Отмечают сходство запаха выделяющегося метиламина с запахом аммиака.
Для демонстрации опытов с метиламином в небольшую колбочку с отводной трубкой и капельной воронкой помещают 2—3 г соли, в капельную воронку наливают концентрированный раствор щелочи. Метиламин получают, прибавляя понемногу из воронки щелочь. С метиламином проделывают следующие опыты:
а) Пропускают выделяющийся газ в воду, подкрашенную фиолетовым или красным лакмусом. Лакмус синеет. Делают заключение о том, что не только по запаху метиламин имеет сходство с аммиаком, но и по химическим свойствам (щелочные свойства водного раствора). Составляется уравнение.
б) Получают снова раствор метиламина, пропуская газ в воду (без лакмуса), и проводят реакцию с раствором хлорного железа, как было указано выше. Подтверждаются щелочные свойства гидроксида метиламмония.
в) К отводной трубке колбы подносят открытую склянку с концентрированной соляной кислотой или палочку, смоченную кислотой. Образуется густое облако дыма хлористоводородной соли (черный фон!). Параллельно ставят опыт с аммиаком. Составляют уравнение реакции солеобразования и, проводя далее аналогию с аммиаком и солями аммония, объясняют реакцию получения амина из соли (см. выше).
г) Чтобы показать отличие метиламина от аммиака, демонстрируют горючесть метиламина, поджигая газ у отводной трубки колбы. Учащиеся знают, что аммиак на воздухе не горит. Для большей убедительности над пламенем горящего метиламина помещают стакан, сполоснутый известковой или баритовой водой. Появление мути на стенках свидетельствует о наличии углерода в горящем веществе (чего нет в аммиаке) и о принадлежности его к органическим соединениям.
АНИЛИН
Опыты с анилином должны показать, что это вещество принадлежит к классу аминов, имеет свойства основания и в то же время отличается от алифатических (жирных) аминов по степени проявления основных свойств. Большое внимание также должно быть уделено получению анилина из нитробензола ввиду особого исторического значения этой реакции и ее роли в современной промышленности.
Постановка опыта получения анилина из нитробензола с выделением продукта требует длительного времени. Поэтому он может быть поставлен или с помощью приемов, рекомендуемых для демонстрации длительных опытов, или без выделения продукта. При этом ограничиваются констатацией появления нового вещества с помощью качественной реакции. Более полный опыт с извлечением анилина переносится на практические занятия.
Ввиду ядовитости паров анилина при работе с ним должны соблюдаться меры предосторожности. Опыты по возможности следует проводить в вытяжном шкафу.
Отношение анилина к индикаторам. После ознакомления с физическими свойствами, составом и строением анилина, естественно, встает вопрос о том, что это вещество должно иметь химические свойства, сходные со свойствами рассмотренных ранее жирных аминов. С целью проверки этого предположения исследуют отношение анилина к индикаторам.
К 100 мл воды прибавляют 1 мл анилина и взбалтывают смесь стеклянной палочкой. Половину раствора отливают в другой стакан и прибавляют в один из них фенолфталеин, а в другой — лакмус. Окраска индикаторов не изменяется.
Взаимодействие анилина с кислотами. После того как показано, что анилин не действует на индикаторы, т.е. не обладает основными свойствами, возникает вопрос, способен ли он к солеобразованию.
а) В пробирку с 5 мл воды учащиеся наливают около 0,3 мл анилина. Смесь взбалтывают. Убеждаются, что анилин почти не растворился в воде. Добавляют по каплям концентрированную соляную кислоту. Анилин растворяется. Составляют уравнение реакции образования соли.
К. раствору соли анилина добавляют по каплям концентрированный раствор щелочи. Снова выделяется анилин в виде маслянистой жидкости. Составляют уравнение реакции.
При проведении опыта следует пользоваться концентрированными растворами кислоты и щелочи с той целью, чтобы не вводить большого количества воды, иначе из-за частичной растворимости анилина (1 г анилина растворяется в 30 мл воды) выделение его будет малозаметно.
б) В демонстрационную пробирку наливают 5 мл анилина и затем примерно такой же объем концентрированной соляной кислоты или 50-процентной серной кислоты. Дают некоторым учащимся убедиться, что проходит экзотермическая реакция. Охлаждают пробирку в струе холодной воды. Выделяются кристаллы соли. Растворяют соль по возможности в небольшом количестве воды (воду добавляют небольшими порциями и пробирку встряхивают). Если остался непрореагировавший анилин, отфильтровывают от него раствор, а к раствору соли добавляют концентрированный раствор щелочи. Выделяется свободный анилин.
Тем или другим из этих опытов устанавливается, что анилин является основанием; отсутствие же действия его на индикаторы говорит о том, что он основание более слабое, чем жирные амины.
Так как по составу молекул жирные амины и анилин отличаются тем, что вместо предельного радикала здесь имеется бен-
зольное ядро, то очевидно, что ослабление основных свойств аминогруппы обусловлено влиянием ароматического кольца.
Взаимодействие анилина с бромной водой. Как известно, влияние атомов друг на друга в молекуле взаимно. Если бензольное кольцо влияет на аминогруппу в анилине, ослабляя проявление се свойств основания, то можно ожидать, что и бензольное ядро под влиянием этой группы будет обладать свойствами, отличными от свойств бензола. С подобным изменением свойств ядра учащиеся уже встречались на примере фенола.
Встает вопрос, не ослабляет ли аминогруппа связь атомов водорода с ядром, подобно тому как эту связь ослабляет гидроксильная группа в феноле, и не будет ли анилин реагировать с бромной водой, как реагирует с ней фенол.
В колбе или демонстрационной пробирке растворяют при встряхивании и 10 мл воды I мл анилина. К полученному раствору (эмульсии) добавляют бромную воду до образования белого осадка.
Осадок представляет собой триброманилин:
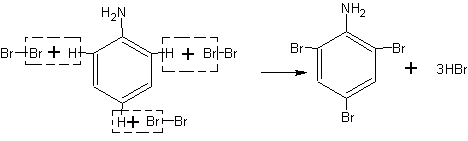
Для успеха опыта необходимо, чтобы растворы анилина и брома были достаточно концентрированными. Вместо раствора анилина можно воспользоваться раствором его соли.
Окисление анилина. Анилин сравнительно легко окисляется в разнообразные продукты. Окислением анилина, в частности, объясняется потемнение его при хранении в плохо закрываемых склянках. При окислении анилина хромовой смесью и некоторыми другими сильными окислителями образуется так называемый черный анилин, применяемый для окраски в черный цвет тканей, дерева, кожи.
а) В демонстрационной пробирке к 3-4 мл водной эмульсии анилина приливают 10—12 мл хромовой смеси. Жидкость взбалтывают и подогревают. Вначале она приобретает зеленую окраску. затем синеет, при дальнейшем нагревании образуется осадок черного анилина. Характер осадка выявляется при сильном взбалтывании смеси в пробирке.
б) В 100 мл воды растворяют 2 г двухромовокислого калия К2Сг2О7 и 1 мл концентрированной серной кислоты. К полученному раствору добавляют 2 г хлорида анилина или по 1 мл анили-
на и концентрированной соляной кислоты. Смесь перемешивают стеклянной палочкой. В образующийся раствор быстро вносят кусок хлопчатобумажной ткани. Краситель с тканью нагревают, затем ткань достают, отжимают валиком на гладкой поверхности и развешивают на стеклянных палочках.
в) Готовят раствор хлорида анилина, приливая к 50 мл воды 2 мл анилина и 3 мл концентрированной соляной кислоты. Затем к реакционной смеси добавляют еще 1 г хлорида аммония. Полученный раствор наносят кисточкой на гладкую поверхность доски.
После того как раствор впитается, таким же способом покрывают дерево вторым раствором, приготовляемым растворением 4 г бертолетовой соли и 6 г медного купороса в 50 мл воды. Бертолетова соль окисляет анилин, и поверхность доски постепенно приобретает черную окраску. Хлорид аммония и сульфат меди способствуют ускорению процесса окисления и получению плотной и прочной окраски. После высыхания поверхности на нее еще несколько раз наносят попеременно первый и второй растворы.
Получение анилина. Производство анилина долгое время было основано только на восстановлении нитробензола. Эта реакция была открыта знаменитым русским ученым Н.И.Зиминым.
В промышленном способе производства для восстановления нитробензола используются соляная кислота и железные или чугунные опилки. Все эти вещества загружаются в реактор, образующийся водород в момент выделения энергично восстанавливает нитробензол в анилин.
В школьных опытах получения анилина для ускорения реакции вместо железа используют обычно олово или цинк. Соображения экономического характера при таких незначительных масштабах здесь не играют роли. Опыт с железом может быть перенесен на практические занятия или в химический кружок и поставлен там не только для иллюстрации основной химической реакции, но и с целью отражения важнейших производственных операций.
а) В колбочку емкостью 100 мл вносят 2-3 капли нитробензола, приливают 1—2 мл концентрированной соляной кислоты и вносят 2-3 маленьких кусочка цинка (или олова). Если реакция пойдет слишком бурно, колбочку охлаждают в струе холодной воды или в стакане с водой. Когда запах нитробензола исчезнет или почти исчезнет, в колбу приливают концентрированный раствор щелочи (30-40-процентной) до тех пор, пока образующийся вначале осадок гидроксида цинка Zn(OH)2 ввиду своей амфотерности не растворится при дальнейшем прибавлении щелочи:
Zn(OH)2 + 2NaOH à Na2ZnO2 + 2H2O
Это будет гарантией того, что щелочь выделит анилин из соли.
Чтобы констатировать образование анилина, присоединяют к колбе холодильник и отгоняют около 0,5-1 мл жидкости. Анилин гонится вместе с парами воды в виде белой эмульсии. Затем дистиллят разбавляют водой, чтобы анилин растворился, и открывают его с помощью бромной воды. Одновременно убеждаются, что нитробензол не взаимодействует с бромной водой.
б) Препарат анилина для классных занятий может быть получен в опыте, более точно воспроизводящем промышленный способ, чем предыдущие.
В заводской практике для восстановления нитробензола берут значительно меньше соляной кислоты, чем соответствует уравнению
С6Н5NО2 + 6Н à C6H5NH2 + 2Н2О,
так как образующийся хлорид железа катализирует реакцию:
С6Н5NO2 + 2Fe + 4Н2O à 2Fe(OH)3 + C6H5NH2
В условиях школьного опыта, при работе с меньшими массами веществ, лучше брать количества, близкие к теоретическим.
В большую круглодонную колбу помещают 15—20 г нитробензола, 50 г железных опилок или мелких стружек и приливают небольшими порциями (сначала по 3-5 мл) 80—100 мл концентрированной соляной кислоты. После каждой добавки кислоты колбу закрывают пробкой с обратным воздушным холодильником для конденсации паров нитробензола и встряхивают. В случае слишком бурного течения реакции колбу непродолжительное время охлаждают в холодной воде. После того как будет введена вся кислота и реакция через некоторое время начнет затихать, колбу в течение 20—30 мин подогревают на асбестовой сетке. По исчезновению в колбе запаха нитробензола судят о полном восстановлении. Этот процесс требует обычно не менее часа.
Для выделения анилина из соли жидкость переливают в колбу для перегонки, добавляют к раствору понемногу концентрированной щелочи. При этом образуется осадок гидроксида железа (III). Прибавлять щелочь следует до сильнощелочной реакции (проба лакмусовой бумажкой), тогда избыток щелочи выделит анилин из соли.
Собирают прибор для перегонки с водяным паром (рис. 38).
Чтобы вода в парообразователе кипела без толчков, его снабжают предохранительной трубкой, доходящей до дна. Одновременно с парообразователем нагревают и колбу с анилином, чтобы поступающие пары воды в ней не конденсировались. Отгоняющийся анилин образует в приемнике водную эмульсию и частично соби-
рается в виде маслянистого слоя. Перегонку ведут до тех пор, пока в приемник не начнут падать капли совершенно прозрачной жидкости, что свидетельствует о том, что перегоняется чистая вода.
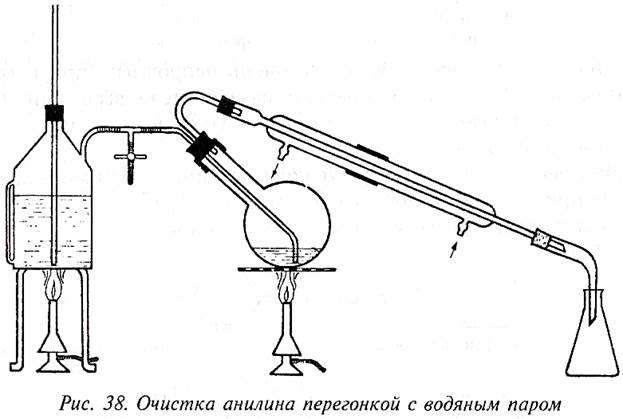
Дистиллят насыщают поваренной солью. Анилин нерастворим в насыщенном растворе хлорида натрия, поэтому жидкость расслаивается. Анилин отделяют с помощью делительной воронки, сушат небольшим количеством твердого гидроксида натрия или калия и перегоняют из небольшой колбочки с воздушным холодильником (темп. кип. 184°С).
Собирается довольно чистый продукт, в дальнейшем изменяющий окраску под действием кислорода воздуха. Полученного количества анилина вполне достаточно для постановки опытов с ним в нескольких классах.
КРАСИТЕЛИ
С интересным и важным разделом органической химии — синтезом красителей — учащиеся могут быть ознакомлены лишь на внеклассных занятиях. Причем это знакомство по необходимости ограничивается простейшими представителями класса азокрасителей.
При синтезе красителей учащиеся знакомятся с двумя новыми реакциями — диазотированием и азосочетанием.
Здесь нецелесообразно излагать теорию красящих веществ, поэтому мы ограничимся лишь следующими указаниями.
При действии азотистой кислоты на соли первичных аминов
образуются так называемые диазосоединения. Соответствующая реакция называется реакцией диазотирования, например
C6H5NH2· HCI + HNO2 à C6H5N2CI + 2Н2O
гидрохлорид хлорид
анилина фенилдиазония
Диазосоединения — вещества очень непрочные: при нагревании выше 3— 5°С они, как правило, разлагаются с выделением азота; поэтому получают их обычно в растворах и реакцию диазотирования ведут при охлаждении.
Диазосоединения легко вступают в реакции с другими веществами, например с аминами и фенолами. Так образуются азокрасители, а сама реакция называется азосочетанием.
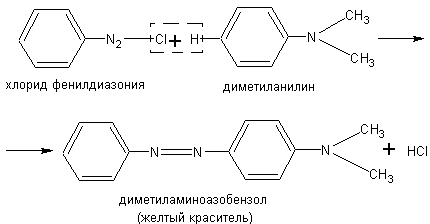
Синтез диметиламиноазобензола. Судя по приведенной структурной формуле желтого красителя, он должен получаться в результате азосочетания хлорида фенилдиазония C6H5N2CI с диметиланилином C6H5N(CH3)2:
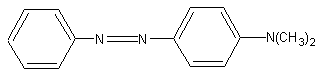
Хлорид фенилдиазония, как указывалось выше, может быть получен действием азотистой кислоты на анилин. Практически вместо азотистой кислоты берут смесь соляной кислоты и нитрита натрия, при взаимодействии которых и образуется азотистая кислота.
Процесс выражается следующими уравнениями:
C6H5NH2 + HCI à C6H5NH2 · HCI
NaNO2 + HCI à HNO2 + NaCI
C6H5NH2HCI + HNO2 à C6H5N2CI + H2O
или суммарно:
C6H5NH2 + NaNO2 +2HCI à C6H5N2CI + NaCI + 2H2O
Из уравнения следует, что для успешного протекания данной реакции на 1 моль анилина требуется 1 моль нитрита натрия и 2 моля HCI.
Для нашего опыта количество веществ можно уменьшить, например, в двадцать раз, т.е. можно взять 5 г анилина, 4 г соли и такое количество соляной кислоты, в котором содержится 3,6 г хлороводорода.
В химическом стакане смешивают взятое количество анилина с 50 мл соляной кислоты, содержащей 3,6 г НС1 (для этого кислоту, уд. вес 1,19, предварительно разбавляют тремя объемами воды). Добавляют в стакан несколько кусочков льда, а сам стакан ставят в воду со льдом. После того как полученный раствор охладится (температура его должна быть около 5°С), к нему при тщательном размешивании добавляют понемногу из капельной воронки указанное выше количество нитрита натрия в виде концентрированного водного раствора (предварительно также охлажденного). Нитрит натрия с избытком соляной кислоты дает азотистую кислоту, которая и диазотирует анилин. В растворе образуется хлорид фенилдиазония.
Полноту диазотирования анилина можно проверить иодокрах-мальной бумажкой: если анилин продиазотирован весь, то избыток азотистой кислоты выделит (окислит) иод из иодида калия и бумажка посинеет. Пробы производят через 2—3 мин после прибавления нитрита натрия. Если бумажка не синеет, добавляют еще немного раствора соли.
Для получения красителя к приготовленному раствору хлорида фенилдиазония приливают теоретическое количество диметилани-лина. Образуется краситель желтого цвета. Его отделяют от раствора и оформляют для коллекции.
Синтез гелиантина (метилоранжа). Чтобы азокрасители лучше растворялись в воде, их получают часто не из анилина, а из сульфаниловой кислоты
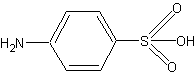
В первой стации синтеза данного красителя диазотируют сульфаниловую кислоту, а на второй стадии проводят азосочетание полученного вещества с диметиланилином. При этом образуется хорошо известный индикатор метилоранж
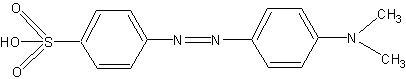
По аналогии с предыдущим нетрудно видеть, что сульфаниловая кислота, нитрит натрия и диметиланилин реагируют в эквимолекулярных отношениях. Если для опыта взять по 0,05 моля веществ и притом учесть, что сульфаниловая кислота кристаллизуется с двумя молекулами воды, то потребуется 10,5 г сульфаниловой кислоты, 4 г нитрита натрия и 6 г диметиланилина.
Навеску сульфаниловой кислоты растворяют в 25 мл 2 М раствора гидроксида натрия {2 г NaOH в 25 мл раствора). В этом же растворе затем растворяют навеску нитрита натрия. После этого раствор охлаждают льдом и приливают к 25 мл 2 М раствора соляной кислоты, охлаждаемого льдом (кроме наружного охлаждения кусочки льда могут быть помещены в раствор).
Рассчитанное количество диметиланилина растворяют в 5 мл 1 М соляной кислоты, охлаждают льдом и к охлажденному раствору приливают полученный выше раствор диазобензолсульфокислоты. Происходит образование красителя. Приливают еще раствор гидроксида натрия до сильнощелочной реакции. Из раствора выделяется натриевая соль красителя в виде оранжево-коричневых лепесткообразных кристалликов. Через несколько часов краситель отфильтровывают, промывают на воронке 25 мл воды, тщательно отжимают на фильтровальной бумаге и сушат в фарфоровой чашке на водяной бане.
Гелиантином можно окрасить образец шерсти или шелка. В химический стакан наливают раствор гелиантина, прибавляют несколько капель соляной кислоты, погружают в раствор окрашиваемый образец и кипятят жидкость, помешивая палочкой. Затем окрашиваемый материал промывают водой и сушат.
Гелиантин под именем метилоранжа известен как индикатор. В кислой среде он окрашивается в розовый цвет, в нейтральной и щелочной — в желтый. Изменение окраски легко заметить, если немного красителя растворить в подкисленной воде и затем нейтрализовать раствор щелочью.
ГЛАВА XI
АМИДЫ КИСЛОТ
Изучение амидов включено в школьную программу органической химии в целях ознакомления учащихся с важнейшим представителем этого класса соединений — карбамидом (мочевиной), на-
ходящим все более широкое применение в сельском хозяйстве (в качестве азотного удобрения, для скармливания жвачным животным) и в промышленном органическом синтезе (получение полимеров). Общие сведения о данном классе соединений ограничиваются почти исключительно рассмотрением строения амидов как аминопроизводных карбоновых кислот. Весь фактический экспериментальный материал темы относится полностью к карбамиду.
КАРБАМИД
Гидролиз карбамида. При нагревании с растворами кислот или щелочей карбамид подвергается гидролизу. При этом образуются аммиак и углекислый газ:
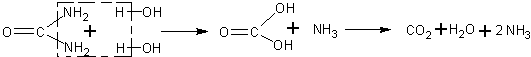
а) В колбу с 30 мл воды помещают 5 г карбамида и приливают половинный объем концентрированного раствора гидроксида натрия. Смесь нагревают, а выделяющийся аммиак обнаруживают при помощи палочки, смоченной концентрированной соляной кислотой.
б) Растворяют 0,5 г карбамида в 2—3 мл воды (в пробирке), добавляют двойной объем прозрачной баритовой воды и смесь кипятят. Влажной лакмусовой бумажкой и по запаху обнаруживают выделяющийся аммиак. Наблюдают образование осадка карбоната бария в результате взаимодействия угольной кислоты со щелочью.
Взаимодействие карбамида с азотной кислотой. Несмотря на наличие аминогруппы в молекуле, амиды кислот, как правило, не проявляют основных свойств. В этом сказывается влияние карбонила на аминогруппу. В связи с тем что в молекуле карбамида содержатся две аминогруппы, он проявляет свойства очень слабого основания и по одной из аминогрупп образует соли с некоторыми кислотами, например с азотной:
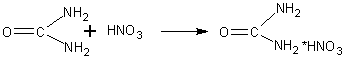
В демонстрационную пробирку помещают 20 мл воды и 3—4 г карбамида. К раствору приливают вдвое меньший объем концентрированной азотной кислоты. Смесь взбалтывают и охлаждают холодной водой из-под крана. Выпадает осадок соли азотной кис-
лоты. Опыт можно проводить аналогично предыдущему, но с меньшими количествами реактивов (берут 1-2 мл раствора карбамида).
Взаимодействие карбамида с щавелевой кислотой. Наглядной является реакция карбамида с щавелевой кислотой, Поскольку щавелевая кислота двухосновная, а в карбамиде основные свойства проявляет одна аминогруппа, то кислота реагирует сразу с двумя молекулами карбамида:
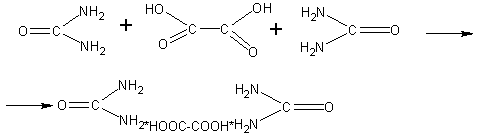
Готовят насыщенные на холоду небольшие количества растворов карбамида и щавелевой кислоты. Сливают в пробирке или колбе равные объемы растворов. Вскоре образуется кристаллический осадок.
Образование биурета. Характерной реакцией карбамида является превращение его при нагревании в биурет:
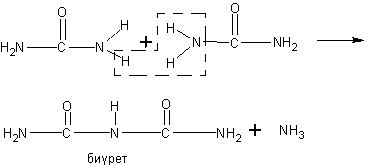
Нагревают в пробирке несколько кристалликов карбамида. Сначала он плавится, затем начинает разлагаться с выделением аммиака, который может быть обнаружен по запаху, при помощи стеклянной палочки, смоченной концентрированным раствором соляной кислоты, или другими способами. В пробирке образуется твердое белое вещество — биурет. Когда пробирка остынет, растворяют биурет в небольшом количестве воды при слабом нагревании. Затем добавляют немного раствора гидроксида натрия и 1-2 капли раствора сульфата меди. Образуется характерное для биурета (и
подобной группировки атомов в белках) красно-фиолетовое окрашивание.
Дата: 2019-05-28, просмотров: 500.