При ознакомлении учащихся с галогенопроизводными углеводородов следует показать малую подвижность атомов галогена, соединенных с углеводородным радикалом, и в связи с этим особенности открытия галогенов в органических веществах.
Взаимодействие галогенопроизводных с нитратом серебра. Учащиеся знают, что при действии раствора нитрата серебра на растворы галогеноводородных кислот и их солей моментально образуется осадок галогенида серебра. Связь атомов галогена с углеводородными радикалами является ковалентной, поэтому подобная реакция здесь если и происходит, то значительно медленнее.
Чтобы раствор нитрата серебра мог хорошо смешиваться с органическими веществами, в опытах пользуются спиртовым, а не водным раствором его. Чтобы галогенопроизводные углеводородов не содержали примеси галогеноводородных кислот (это может исказить результаты опыта), их предварительно очищают. Для этого вещество взбалтывают в делительной воронке с водным раствором
соды, отделяют нижний слой и еще раз промывают его таким же способом водой.
Необходимые для опытов органические вещества, при отсутствии их в лаборатории, могут быть синтезированы учащимися в химическом кружке.
· В пробирку к спиртовому раствору бромэтана С2Н5Вг приливают спиртовой раствор нитрата серебра (слабой концентрации). Осадок не образуется. Приливают спиртовой раствор нитрата серебра к раствору бромида натрия или бромида калия — моментально образуется желтоватый творожистый осадок AgBr. Через некоторое время бромид серебра начинает появляться и в пробирке с бромэтаном (черный фон!). Реакцию можно ускорить нагреванием.
· В четыре пробирки со спиртовыми растворами хлороформа СНСI3, бромэтана С2Н5Вг, иодэтана С2Н5I и хлорида натрия NaCI приливают спиртовой раствор нитрата серебра. В последней пробирке тотчас образуется осадок, вслед за тем осадок появляется в пробирке с иодэтаном, через некоторое время осадок начинает появляться в пробирке с бромэтаном, в пробирке с хлороформом осадок не образуется.
Вытеснение галогенами друг друга из соединений. В цилиндр с хлором наливают немного иодэтана и быстро закрывают цилиндр пробкой. Наблюдают появление фиолетовых паров иода:
2C2H5I + CI2 à 2C2H5CI + I2
Термическое разложение йодоформа. Сравнительно слабой связью атомов иода с углеродом объясняется дезинфицирующее действие йодоформа СНI3. Отщепляющиеся атомы иода в силу своих окислительных свойств разрушают болезнетворные бактерии. Разложение йодоформа можно ускорить нагреванием.
На шпателе или листочке бумаги нагревают высоко над пламенем небольшое количество йодоформа. На белом фоне наблюдают образование паров иода.
Открытие галогенов в органических веществах Из предыдущих опытов следует, что нитрат серебра не может непосредственно применяться для открытия галогенов в органических веществах. Для этой цели здесь существуют следующие способы:
1. Органическое вещество растворяют в спирте и на спирт действуют натрием. Образующийся при реакции спирта с натрием водород вытесняет галоген из органического вещества подобно тому, как галоген замещает водород в молекуле углеводорода.
На примере хлороформа эти реакции можно представить в следующем виде:
С2Н5ОН + Na à C2H5ONa + H; CHCI3 + 6Н à СН4 + ЗНСI
Образующийся хлористый водород уже нетрудно открыть с помощью нитрата серебра.
В пробирку наливают 3-4 мл этилового спирта, прибавляют 0,5 мл хлороформа и бросают 2—3 маленьких кусочка свежеочищенного натрия. Большая часть водорода при этом выделяется в виде газа, его можно поджечь после того, как из пробирки будет вытеснен воздух. Когда весь натрий прореагирует, раствор подкисляют азотной кислотой и прибавляют раствор нитрата серебра. Сразу образуется характерный осадок хлорида серебра.
2. Если в веществе содержится галоген, то можно получить его соединение с медью; образующаяся соль летуча и окрашивает пламя в характерный зеленый цвет (проба Бейльштейна).
Медную проволоку скручивают на конце в спираль и прокаливают по возможности в бесцветном пламени до тех пор, пока пламя от спирали не будет окрашиваться. После этого спираль вносят в испытуемое вещество, например в хлороформ, и затем снова помещают в пламя. Появляющееся зеленое окрашивание свидетельствует о наличии галоидных солей меди и, следовательно, о наличии того или иного галогена в испытуемом веществе
ГЛАВА II
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
При изучении непредельных углеводородов эксперимент ставится преимущественно лишь с двумя веществами — этиленом и ацетиленом.
Многие опыты с этими веществами напоминают работы, выполненные с метаном (горение, взрыв и др.); такие опыты здесь не составляют уже основного содержания эксперимента. Наибольшее значение в этой теме приобретает эксперимент, развивающий представление учащихся о строении вещества, способствующий углублению их понятия о теории строения органических соединений. Сюда относятся опыты, устанавливающие связь строения молекул со свойствами вещества, т.е. иллюстрирующие специфические свойства непредельных соединений.
Этилен
Опыты с этиленом даются здесь в иной последовательности, чем опыты с метаном. Учитель может поставить их, пользуясь заранее
собранным этиленом, и лишь затем показать получение этого вещества на уроке. Если, однако, изучение этилена учитель начинает с получения его, то он без труда сможет изменить предлагаемый ниже порядок опытов.
Горение этилена. Горение этилена и другие опыты с ним могут быть поставлены в нескольких вариантах. Так, например, при изучении нового материала сжигание этилена, а также реакции его с бромом и с раствором перманганата калия можно провести в цилиндрах; при опросе же учащихся и повторении эти опыты можно провести путем поджигания газа у отводной трубки газометра и пропускания газа через соответствующие растворы.
1. Открывают стоящий на столе цилиндр с этиленом и поджигают газ. Газ горит светящим пламенем. По мере сгорания газа пламя уходит в цилиндр и становится малозаметным для учащихся. Чтобы получить большой факел пламени, как и в аналогичном опыте с метаном (рис. 4), в цилиндр вливают воду с целью вытеснения из него этилена. На воздухе горение этилена происходит более интенсивно.
Для доказательства наличия углерода в составе этилена можно держать над пламенем опрокинутый стакан, сполоснутый баритовой или известковой водой. Очевидно, доказательство наличия водорода по образованию воды при горении в данном случае было бы неубедительным, так как учащиеся могут прийти к выводу о том, что появление влаги на стенках стакана обусловливается испарением воды, вливаемой в цилиндр.
2. Если демонстрация опытов начинается с получения этилена, то газ поджигают у отводной трубки прибора (после проверки на полноту вытеснения воздуха). Чтобы газ горел ровным пламенем, в сгибе отводной трубки при вынимании ее из ванны не должна оставаться вода. Если газ был пропущен через осушитель (концентрированную серную кислоту), то в этом опыте легко доказать наличие водорода в составе этилена. Для этого держат над пламенем перевернутый сухой стакан: он покрывается каплями влаги.
При демонстрации горения этилена следует разъяснить учащимся, почему этилен, в отличие от метана, горит светящим пламенем.
Взрыв смеси этилена с кислородом. После демонстрации горения этилена учащиеся иногда спрашивают, образует ли этилен взрывчатую смесь с кислородом и воздухом подобно метану. Для взрыва этилена согласно уравнению реакции берут другие объемные соотношения газов, нежели при взрыве метана. При взрыве с кислородом теоретическое соотношение должно быть 1 ; 3, при взрыве с воздухом —1:15.
С2Н4 + ЗО2 à 2СO2 + 2Н2О
Производят взрыв в склянке так же, как с метаном. Склянка, разделенная метками по одной стороне (для опыта с метаном) на 3 части, с другой стороны должна быть разделена для данного опыта на 4 части. В склянку по способу вытеснения воды набирают вначале кислород, затем этилен. В опыте соблюдают те же предосторожности, что и при взрыве метана! Взрыв получается более сильный, чем у метана.
Опыты горения этилена показали, что в состав его входят водород и углерод. Вес 1 л газа при нормальных условиях равен 1,25 г. Молекулярный вес этилена, следовательно, 22, 4 • 1,25 = 28.
Уже простые соображения показывают, что в молекуле газа должно содержаться 2 атома углерода (12 • 2 = 24) и, следовательно, 4 атома водорода (28 — 24 = 4).
Реакция этилена с бромом. Ознакомлению учащихся с этой реакцией должно быть уделено особое внимание, так как она наиболее типична для непредельных углеводородов и вместе с тем сравнительно легко осуществима в школьных условиях. Выполнение опыта облегчается тем, что реакция идет как с чистым бромом, так и с бромной водой.
Опыт может ставиться с различными целями: в связи с обоснованием структурной формулы этилена; для показа химических свойств вещества; для открытия непредельного соединения; для получения дибромэтана.
1. После того как установлена молекулярная формула этилена, может быть поставлен опыт, на базе которого можно сделать заключение о структурной формуле этого вещества. Учащимся сообщается, что опыт будет заключаться в исследовании реакции этилена с бромом, которая является для изучаемого вещества наиболее характерной.
 Собирают прибор, как показано на рис. 10. Колбу (из прочного стекла) предварительно заполняют этиленом по способу вытеснения воды и сначала закрывают ее в ванне обычной пробкой, а затем быстро заменяют эту пробку на пробку с двумя отверстиями для канальной воронки и отводной трубки. В стакан наливают воду с таким расчетом, чтобы объем ее был не меньше емкости колбы.
Собирают прибор, как показано на рис. 10. Колбу (из прочного стекла) предварительно заполняют этиленом по способу вытеснения воды и сначала закрывают ее в ванне обычной пробкой, а затем быстро заменяют эту пробку на пробку с двумя отверстиями для канальной воронки и отводной трубки. В стакан наливают воду с таким расчетом, чтобы объем ее был не меньше емкости колбы.
В колбу с этиленом постепенно при охлаждении (водяная баня) прикалывают бром и встряхивают ее содержи-
мое. Прибавление брома продолжают до тех пор, пока с ним не прореагирует весь этилен, т.е. пока новые капли брома не будут оставаться без изменений. Наблюдают образование на стенках колбы маслянистых капель нового вещества. Отмечают по делениям объем вступившего в реакцию брома и вычисляют его весовое количество. Затем опускают трубку в сосуд с водой и, если колба достаточно охладилась, открывают зажим. Вода с силой устремляется в колбу и заполняет ее почти целиком.
Учитель сообщает, что, как показывает опыт, в результате этой реакции образуется одно вещество, которое учащиеся видят на стенках колбы, других веществ не найдено. Поэтому, когда этилен вступит в реакцию, в колбе образуется разреженное пространство, куда и устремляется вода под давлением атмосферного воздуха.
Каков же состав нового вещества, получившегося при соединении этилена с бромом? Учащиеся сравнивают количество прореагировавших этилена и брома (в молях) и находят, что на каждую молекулу этилена расходовалась молекула брома. В таком случае уравнение реакции должно быть написано в следующем виде:
С2Н4 + Вг2 à С2Н4Вг2
Если полученное вещество, сообщает преподаватель, собрать и подвергнуть анализу, то формула его С2Н4Вг2 подтверждается. Это вещество — дибромэтан, структурная формула которого
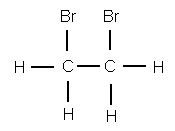
Чтобы представить себе строение этилена, надо, следовательно, убрать из молекулы два атома брома. Тогда освободившиеся от атомов брома валентности углерода смыкаются друг с другом и образуют двойную связь
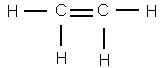
Это и будет структурная формула этилена.
2. Если постановка предыдущего опыта затрудняет учителя, опыт может быть показан в упрощенном виде как иллюстрация химических свойств этилена.
В цилиндр с этиленом наливают бромной воды, закрывают его пробкой или стеклянной притертой пластинкой (не рукой!) и взбалтывают. Окраска брома очень быстро исчезает. Обращают внимание на звук врывающегося в цилиндр воздуха при открывании пробки, что говорит об израсходовании газа на реакцию.
Учитель сообщает, что полученное вещество изучено и оказалось известным учащимся (теоретически) галогенопроизводным этана — дибромэтаном. Составляют уравнение реакции в обычном и в структурном виде и делают заключение о структурной формуле этилена, как описано выше.
Чтобы сделать опыт хорошо видимым, следует пользоваться по возможности концентрированной бромной водой и цилиндрами большого диаметра, тогда изменение окраски воды будет разительным.
Учителя нередко задают вопрос: сколько бромной воды следует приливать в цилиндр с газом? Точного ответа здесь дать нельзя, так как цилиндры могут быть взяты разных объемов, и бромная вода обычно готовится неопределенной концентрации. Большой точности опыт, однако, и не требует. Если бромной воды будет взято меньше, чем полагается по стехиометрическому соотношению, она полностью обесцветится, а остаток этилена на результат наблюдения не повлияет. Если же бромной воды будет взято несколько больше, чем полагается, и бром вступит в реакцию не полностью, все же концентрация его снижается настолько, что вода кажется бесцветной или значительно обесцветившейся. Разумеется, до занятия надо проверить опыт, чтобы установить нужное количество бромной воды.
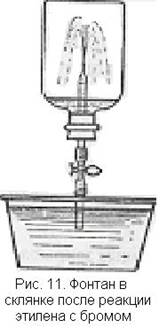 3. Реакция этилена с бромом может быть использована для проведения внешне эффектного опыта. Он основан на том, что при реакции этилена с бромом в замкнутом сосуде образуется разреженное пространство.
3. Реакция этилена с бромом может быть использована для проведения внешне эффектного опыта. Он основан на том, что при реакции этилена с бромом в замкнутом сосуде образуется разреженное пространство.
Толстостенный сосуд емкостью 0,5—1 л наполняют этиленом, в него осторожно помещают 1—2 ампулы с бромом в зависимости от объема склянки и величины ампул и закрывают пробкой, через которую проходит стеклянная трубка с краном. Встряхивают склянку так, чтобы обломились концы ампул. Склянка заполняется парами брома, окраска которых, однако, постепенно исчезает, так как бром вступает в реакцию с этиленом. В сосуде образуется разреженное пространство. Конец стеклянной трубки опускают в чашку с подкрашенной водой и открывают кран (рис. 11). Вода с силой устремляется в склянку и бьет фонтаном.
Дата: 2019-05-28, просмотров: 362.