Эксперимент проводился в школе №6 г. Тырныауз в 10 «А» и 10 «Б» классах примерно с одинаковой успеваемостью (таблица 2).
Сравнительная характеристика учащихся 10 «А» и 10 «Б» классов до проведения эксперимента
| Класс | Количество учащихся | Успеваемость |
| 10 «А» | 22 | 2 - отличника; 14 – хорошистов; 4 – учатся удовлетворительно; 2 – не успевающих. |
| 10 «Б» | 18 | 3 - отличника; 10 – хорошистов; 3 – учатся удовлетворительно; 2 – не успевающих. |
Выборочная совокупность 38 человек. Контрольная выборка - 10 «А» класс – 20 человек, экспериментальная выборка - 10 «Б» - 18. После проведения ряда уроков были организованы две контрольные работы: в виде тестов в 10 «Б» классе и традиционная форма контрольной работы в 10 «А» классе (см. приложение). По результатам данных составлена диаграмма сравнения успеваемости учащихся в параллельных классах (рисунок 1)
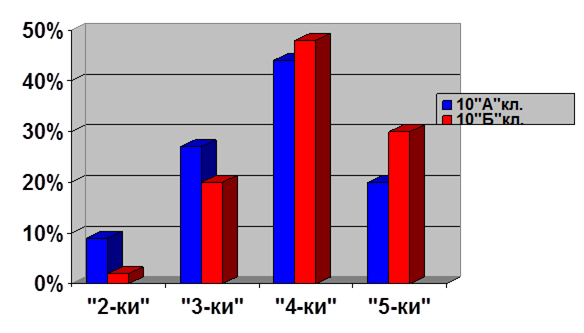
Рисунок 1. Сравнительная характеристика успеваемости учащихся в параллельных классах
Диаграмма показывает, что введение тестового контроля знаний в сочетании с устным опросом дает больше положительных результатов по сравнению с традиционной письменной формой проверки знаний учащихся.
Исходя из результатов проведенной работы перечислим основные достоинства и недостатка тестового контроля знаний.
Достоинства:
· большая объективность и, как следствие, большее позитивное стимулирующее воздействие на познавательную деятельность учащегося;
· исключается воздействие негативного влияния на результаты тестирования таких факторов как настроение, уровень квалификации и др. характеристики конкретного преподавателя [26];
· ориентированность на современные технические средства на использование в среде компьютерных (автоматизированных) обучающих систем;
· универсальность, охват всех стадий процесса обучения;
· тестированный опрос многофункционален. Он позволяет быстрее понять, как дальше работать с данным учеником.
Главное достоинство тестовой проверки в скорости, а традиционной проверки посредством дидактических материалов - в ее основательности.
Недостатки тестового метода контроля знаний учащихся:
· составление тестов - большая кропотливая работа;
· субъективизм в формировании содержания самих тестов, в отборе и формулировке тестовых вопросов;
· недостатком является то, что результаты своей работы учащийся представляет только номера ответа, тут учитель не видит характера хода решения – мыслительная деятельность учащегося и результат может быть только вероятностным.
· возможность угадывания. Если, например, тестовое задание содержит только два ответа, один из которых правильный, то половину ответов на такие тестовые задания можно угадать.
Но не смотря на указанные недостатки тестирования, как метода педагогического контроля, его положительные качества во многом говорят о целесообразности использования такой технологии в курсе изучения химии.
В итоге следует заметить, что использование с 10 класса тестирования учащихся поможет объективно провести аттестацию школы, которая проводится с целью установления соответствия содержания, уровня и качества подготовки учащихся требованиям государственных образовательных программ [27]. Систематическое проведение контрольных мероприятий с помощью составленных на высшем уровне инструментов контроля позволяет школам формировать подготовленных учеников в различных областях знаний, готовых применять накопленный багаж знаний в любую минуту. Именно в таких выпускниках и в настоящее время, и в будущем нуждается наша страна, чтобы с их помощью провести быстрое оздоровление экономики.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Иванова Р.Г., Осокина Г.Н. Изучение химии в 9-10 классах. М.: Просвещение,1983.- 250 c.
2. Амирова А.Х. Обобщение знаний по курсу органической химии.// Химия в школе.-2007.-№4,с 19 – 22
3. Рудзитис Г.Е., Фельдман Р.Г. Химия: Органическая химия: Учебник для 10 класса общеобразовательных учреждений. М.: Просвещение,1995.- 160 с.
4. Кузнецова Н.Е., Титова И.М., Гара Н.Н. Химия: Учебник для учащихся 10 класса общеобразовательных учреждений. – М.: Вентана-Граф, 2007. – 384 с.
5. Аллахвердиева Д.Т. Опыт применения тестов для дидактической экспертизы обучения //Высшее образование в России. №2, 1993. с 102-104.
6. Кошелева Е.А. ЕГЭ и авторские тестовые задания.// Химия в школе.2007.-№8, с 19 - 25
7. Иванова Н.П. Тесты, тесты, тесты… //Приложение к газете «1 сентября».
Математика.1999, №2, с 21-23
8. Щапов А., Тихомирова Н., Ершиков С., Лобова Т. Тестовый контроль в системе рейтинга//Высшее образование в России. 1995. №3, c 100-102.
9. Хубаев Г.Н. О построении шкалы оценок в системах тестирования.// Высшее образование в России. 1996. №1, с 122 – 125
10. Хамитова А.И., Хабибуллина А.Б. ЕГЭ по химии как объективная реальность.// Химия в школе.2007.-№5, с 16 – 18
11. Котляров О.С. Контроль результатов обучения химии.// Химия: приложение к газете «1 сентября».2006.-№24, с 10 – 13
12. Крейнин Е.В., Евергетидова А.С. Глобальный климат: причинно – следственные связи, Киотский протокол и технические решения.// ЭКиП. 2007.май, с 43 – 45
13. Карасевич А.М., Крейнин Е.В. Эколого-энергетические проблемы газового топлива. М.: Страховое ревю, 2004. – 215 с.
14. Новиков Ю.В. Экология, окружающая среда и человек. М.: ФАИР-ПРЕСС, 2000. -320 с.
15. Никоноров А.М., Хоружая Г.А. Глобальная экология. М.: Издательство ПРИОР, 2000. – 284 с.
16. Демина Г.А. Экология, природопользование. Охрана окружающей среды. М.: Аспект – пресс, 1998. - 193 с.17. Подольский И.И., Булкатов А.Н., Петровская Л.К. Метанол как источник энергии. Проблемы безопасности использования.// ЭКиП. 2007. ноябрь, с 28 – 29
18. Караваев М.М. Технология синтетического метанола. М.: Химия, 1984. -278 с
19. Росляков А.Д., Бурлий В.В. Анализ технологий очистки углеводородного сырья от сернистых соединений.// ЭКиП.2007. февраль, с 42 – 44
20. Горковенко М.Ю. Поурочные разработки по химии. – М.: ВАКО, 2008.-320с.
21. Давыдова Г.Е. К изучению экологических проблем в курсе органической химии.// Химия в школе.2007.-№1, с 15 – 19
22. Габрилиан О.С., Остроумов И.Г. Химия. 10 класс: Настольная книга учителя. М.: Дрофа, 2004. – 480 c.
23. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии. М.: Новая волна, 2003. – 278 с.24. Скворцов П.М., Никишов А.И., Рохлов В.С., Теремов А.В. Биология 6 – 11 классы. – М.: АСТ – ПРЕСС, 2000. – 535 с.25. Горбунцова С.В. Тесты и ЕГЭ по основным разделам школьного курса. – М.: ВАКО, 2006. -160 с.
26. В.А. Попов. Размышление учителя над итогами тестирования //Математика в школе. 2000.- №3, с 45-47
27. Чернобельская Г.М. Методика обучения химии в средней школе. Учебник для студентов высших учебных заведений. М.: ВЛАДОС, 2000. – 156 с.
28. Сорокин В.В., Злотников Э.Г. Химия в тестах: Пособие для школьников и абитуриентов. СПб.: Химия, 1996. – 115 с.29. Мамедов Н.М. Устойчивое развитие и экологизация школьного образования. М.: Просвещение, 2003. – 125 с.30. Коверина А.А., Добротин Д.Ю. Учебно - тренировочные материалы для подготовки к единому государственному экзамену. Химия. М.: Интеллект – Центр, 2004. – 85 с.
Приложение
Контрольная работа
Вариант 1.
1) Охарактеризовать по приведенной ниже схеме непредельные углеводороды ряда этилена: сформулировать определение алкенов, дать общую формулу гомологического ряда, указать тип гибридизации, описать их физические и химические свойства.
2) Осуществить цепочку превращений:
циклогексан → бензол → нитробензол → анилин
↓
бромбензол
Указать тип химических реакций, условия их проведения.
3) Массовая доля углерода в алкане равна 83,72 %. Определите молекулярную формулу вещества, составьте структурную формулу изомера данного УВ, содержащего четвертичный атом углерода и назовите его по международной номенклатуре.
Вариант 2.
1) Охарактеризовать по приведенной ниже схеме непредельные углеводороды ряда ацетилена: сформулировать определение алкинов, дать общую формулу гомологического ряда, указать тип гибридизации, описать их физические и химические свойства.
2) Осуществить цепочку превращений:
Этан → этилен→этанол → бутадиен-1,3→ полибутадиен.
Указать тип химических реакций, условия их проведения.
3) Какой объем воздуха (н.у.) потребуется для полного сгорания 210 г пентена? Составить структурные формулы изомеров данного УВ с третичным атомом С и двойной связью при нем, дать название по систематической номенклатуре.
Вариант 3.
1) Охарактеризовать по приведенной ниже схеме арены: сформулировать определение ароматических углеводородов, дать общую формулу гомологического ряда, указать тип гибридизации, описать их физические и химические свойства.
2) Осуществите цепочку превращений:
СН4→ С2Н2→ СН2 = СНBr → СН3 – СН2Br → С4H10
Указать тип химических реакций, условия их проведения. Дать названия соединениям.
3) При сгорании углеводорода массой 4 г образовалось 6,72 л углекислого газа и 3,6 г воды. Определите структурную формулу УВ, если известно, что он взаимодействует с аммиачным раствором оксида серебра.
Ответы:
Вариант 1
№2. 1) С6Н12 → С6Н6 + 3Н2 (дегидрирование)
2) С6Н6 + НО – NO2→ С6Н5 NO2 + H2O(нитрование)
3) С6Н5 NO2 → С6Н5 NН2 +2H2O (восстоновление)
4) С6Н6 +Br2 → С6Н5 Br + HBr (бромирование)
№3: С6Н14 (изомер – 2,2-диметилбутан)
Вариант 2
№2: 1) С2Н6 →СН2 = СН2 + Н2 (дегидрирование)
2) СН2 = СН2 + Н2О →СН3 - СН2 ОН (гидратация)
3) 2 СН3 - СН2 ОН→СН2 = СН - СН = СН2 + 2Н2О + Н2 (дегидрирование и дегидратация)
4) nСН2 = СН - СН = СН2 → ( - СН2 - СН = СН - СН2 -)n (полимеризация)
№3: 2 С5Н10 +15O2 →10СO2 + 10Н2О (изомеры – 2-метилбутен-2 и 2-метилбутен-1)
Вариант 3
№2: 1) 2СН4 →С2Н2 + 3Н2 (пиролиз метана)
2) НС ≡ СН + Н Br→СН2 = СН Br (присоединение)
3) СН2 = СН Br + Н2 →СН3 – СН2 Br(гидрирование)
4)2 СН3 – СН2 Br +2 Na → С4Н10 + 2 NaBr(синтез Вюрца)
№3: Эмпирическая формула вещества – С3Н4
Тестовая контрольная работа.
Вариант 1
1. Алкадиены имеют общую формулу:
а) CnH2n+2 ;
б) CnH2n ;
в) CnH2n-2 ;
г) CnH2n-6.
2. Изомерами являются:
а) гексен и циклогексан
б) бутен и бутилен
в) метибензол и метилбутан
г) пентан и пентин
3. Гомологами являются:
а) 3-метилпентан и гексан
б) октен и октадиен
в) бутин и ацетилен
г) гептан и бромгептан
4. sp-гибридный атом углерода присутствует в молекуле
а) бутадиена-1,3
б) пропина
в) гексена
г) метана
5. Для алкинов характерна изомерия:
а) геометрическая
б) положения заместителя
в) углеродного скелета
г) положение функциональной групп
6. Формула алкана
а) СН4
б) С2Н4
в) С8Н10
г) С4Н6
7. В реакцию дегидрирования способен вступать
а) бензол
б) этин
в) бутан
г) циклогексан
8. Предельные УВ вступают в реакции
а) присоединения
б) гидратации
в) горения
г) замещения
Вариант 2
1. Циклоалканы имеют общую формулу:
а) CnH2n+2 ;
б) CnH2n ;
в) CnH2n-2 ;
г) CnH2n-6.
2. Изомерами являются:
а) орто-бромтолуол и пара-бромтолуол
б) циклооктан и этилбензол
в) бутин и бутадиен
г) метан и этан
3. Гомологами являются
а) гептен и этилен
б) толуол и ксилол
в) 2-метилбутен-1 и 2,2-диметилбутан
г) циклобутан и бутан
4. Тройная связь существует в молекулах
а) алкадиенов
б) аренов
в) алкинов
г) циклоалканов
5. Гексен-2 и гексен-3 являются примерами изомерии:
а) геометрической
б) положением заместителя
в) углеродного скелета
г) положения кратной связи
6. Формула алкадиена
а) С7Н12
б) С7Н14
в) С7Н16
г) С4Н10
7. Ацетилен можно получить из
а) бензола
б) метана
в) бутина
г) карбида кальция
8. Основную часть нефти составляют
а) алкины
б) алкены
в) алкадиены
г) алканы
Вариант 3
1. Арены имеют общую формулу
а) CnH2n+2 ;
б) CnH2n ;
в) CnH2n-2 ;
г) CnH 2 n -6 .
2. Изомерами являются
а) 2-этилгексан и октан
б) пропин и пропен
в) ксилол и толуол
г) пентен и циклопентен
3. Гомологами являются
а) октан и циклоактан
б) гептен и циклогептен
в) бромэтан и бромэтен
г) ацетилен и гексин
4. Водный раствор перманганата калия обесцвечивает
а) метан
б) циклопентан
в) пентен
г) пентин
5. Цис- и транс-пентен-2 являются примерами изомерии
а) положение кратной связи
б) геометрической
в) углеродного скелета
г) положения функциональной группы
6. Четвертичный атом углерода находится в молекуле
а) 2,2-диметилбутана
б) 2-метилпропена
в) 2,3-диметилбутана
г) этилбензола
7. Основной источник промышленного получения бензола –
а) природный газ
б) каменный уголь
в) попутный нефтяной газ
г) нефть
8. По реакции Кучерова получают
а) спирт
б) альдегид
в) галогенпроизводные углеводородов
г) анилин. [20]
Дата: 2019-05-28, просмотров: 304.