Газът, получев в процеса на ПК и паро-кислородна газификация, съдържа заедно с водорода и метан, въглероден оксид и диоксид. Кон-центрацията на въглеродните оксиди в газа, получени при конверсия на различни въглеводородни суровини се колебае от 6 – 15%, а в газ, полу-чен от газификация на мазут достига до 45%.
В резултана на конверсия на въглеродните оксиди с водна пара се получава допълнително количество водород, равно на съдържащия се в газа СО. Реакцията протича без промяна на общия обем от реагенти, съ-провожда се от отделяне на топлина и не зависи от налягането. С пони-жаване на температурата, равоновесието се премества към образуване на водород и въглероден диоксид.
В реални условия на протичана на процеса на ПК на въглеводороди и паро-кислородна газификация на мазута, когато реакционната темпера-тура подмине 800 0С, пректически се достига равновесие на реакцията на конверсия на въглеродния оксид и концентрацията му в газа, постъпващ за конверсиям; тази концентрация обикновено отговаря на равновесната за максимана температура на конверсия на въглеводороди или газифика-ция. В отделни случаи се наблюдава по-ниско съдържание на СО, което може да се случи, ако реакция протича при по-ниска температура в колек-торите след изхода на газа от тръбите на пеща за конверсия на въглево-дороди или на агрегата за газификация. Този ефект е незначителен, по-ради краткото време на престой на газа в системата пред реактора за конверсия на СО.
Знаейки състава на газа постъпващ за конверсия на СО, и констан-тата на равновесие (таблица 12), може чрез уравнението за константите на реакцията и данните от материалния баланс да се пресметне равно-весната концентрация на СО и други компоненти. В таблица 13 са приве-дени данните за материалния баланс на конверсия на въглеродния оксид (изчислено за 100 мола от изходния газ).
Като заместим стойностите на равновесните концентрации на ком-понентите във влажния конвертиран газ в уравнението за константите на конверсия на СО с пара и го решим за „х”, ще пулучим
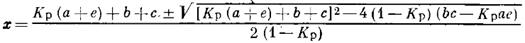
Табл. 12 Константи на равновесие а реакцията СО + Н2О  СО2 + Н2
СО2 + Н2
| Температура, 0С | К1 | Температура, 0С | К1 |
| 200 250 300 350 400 450 500 520 540 560 580 600 620 640 660 680 700 710 720 730 740 750 760 | 2,279.102 8,651.10 3,922.10 2,034.10 1,170.10 7,311 4,878 4,215 3,670 3,220 2,843 2,527 2,259 2,031 1,835 1,666 1,519 1,453 1,391 1,333 1,279 1,228 1,180 | 770 780 790 800 810 820 830 840 850 860 870 880 890 900 910 920 930 940 950 960 970 980 990 | 1,135 1,092 1,053 1,015 9,793.10-1 9,457.10-1 9,139.10-1 8,837.10-1 8,552.10-1 8,282.10-1 8,025.10-1 7,781.10-1 7,549.10-1 7,328.10-1 7,118.10-1 6,918.10-1 6,728.10-1 6,546.10-1 6,372.10-1 6,206.10-1 6,047.10-1 5,896.10-1 5,750.10-1 |
Табл. 13 Материален баланс за изчисляване на равновисието на конверия на въглероден оксид
| Компоненти | Изходящ газ, mol | Реагирало коли- чество, mol | Полу-чено,mol | Конвертиран газ, mol |
| CO H2 CO2 CH4 | a b c 1 – (a + b + c) | x - - - | - x x - | a – x b + x c + x 1 – (a + b + c) |
| Общ сух газ | 1 | х | 2х | 1 + х |
| Н2О | е | х | - | е - х |
| Общ влажен газ | 1 + е | 2х | 2х | 1 + е |
Изчисленията показват, че за достигане на дастатъчно ниска кон-центрация на въглероден оксид в конвертирания газ, конверсията трябва да се провежда при температура не по-висока от 250 0С. С цел повишава-не производителността на процеса, конверсията обикновено се провежда на две степени: на първа се използва високотемпературен желязохромен катализатор, на втора – нискотемпературен катализатор, на който медта е активен компонент. Преди откриването на нискотемпературните катали-затори, конверсията на въглероден оксид се е провеждала на железохро-мен катализатор при 350 – 450 0С в няколко степени. Високата степен на превръщане на СО се достигала за сметка на големия излишък на водна пара и очистване на конвертирания газ от въглероден диоксид между сте-пените. Такава схема е тромава и неикономична, затова с основно значе-ние на изследванията за този стадий е откриването на нискотемперату-рен катализатор.
Двустепенната конверсия на въглероден оксид на първи стадий се провежда при 350 – 400 0С, а на втори – при 220 – 250 0С. В газа, на вход на първа степен, отношението пара:газ се определя от режима на пред-ходния стадий (конверсия на въглеводородите) и трябва да се поддържа не подържа не по-ниско от 0,6:1 при налягане 2МРа и не по-ниско от 0,9:1 при налягане близко до атмосферното. Ако в газа получен на предходния стадий парата е недостатъчно, тя се добавя. Излишъкът на пара е благо-приятен за провеждане на конверсия, но при определени условия той мо-же да способства за отравяне на катализатора.
Обемната скорост също зависи от налягането, при което се осъще-ствява прощеса и се променя от 1000ч-1 при налягане, близко до атмос-ферното, до 2500ч-1 при 2 МРа. Налягането на процеса обикновено зави-си от налягането на предходния стадий. На инсталации за ПК на въглево-дороди, конверсия на въглеродния оксид се води при налягане близко до атмосферното или при 2,0 – 2,5 МРа. На инсталации за газификазия на-лягането може да бъде повишено до 15 МРа. Въпреки, че изменение на налягането не влияе на равновесието на реакцията, повишеното наляга-не се оказва благоприятно влияние на кинетичните фактори, които позво-ляват да се увеличи обемната скорост на газа.
В описаните условия конверсия на въглероден оксид протича с дъл-боко превръщане, близко до равновесното. Във всеки случай съдържа-нието на СО в газа след високотемпературна конверсия е 3 – 4%, а след нискотемпературна конверсия – до 0,5%. В реални условия дълбочината на превръщане на СО на стадия на високотемпературна конверсия е92 – 95%, а на стадия на нискотемпературна конверсия 90 – 92% от равно-весната дълбочина а превръщане.
За стадия на високотемпературна конверсия в началото се е из-ползвал катализатор на основата на Fe3O4. След това той е бил осъвър-шенстван с въвеждане на оксиди на хрома, възпрепятстващи увелича-ването на кристалите на Fe3O4, което увеличава срока на работа на ката-лизатора. Днес за този стадий на процеса се използват само модифика-ции на железохромния катализатор, отличаващи се по начина на произ-водство. Основни характеристики на двата железохромни катализатори № 482 и С-12-1 са следните:
№482 С-12-1
Форма.................................. гранули таблетки
Диаметър, мм..................... 4,5 – 5,5 9,7
Височина, мм...................... 5 – 20 4,9
Съдържание, %
желязо......................... 89 – 90 85,8
хром............................. 7,0 – 7,5 9,4
Активност* по скоростна кон-
станта при 350 0С, см3/гр ката-
лизатор в час..................... 1,0 – 1,3 1,30
Механична якост на
надлъжно напрежение, MN/m2 35 – 40 35
напречно напрежение, MN/m2 82,2 251
Относителна плътност, кг/м3 1150 1200
Относителна повърхност, м2/гр 25 – 30 110
Обем на порите, см3/гр..... 0,32 0,24
в това число с радиус
r < 7,5 нм 0,03 0,12
r > 7,5 нм 0,29 0,12
* активността е измерене на инсталация от проточен тип:
размер на зърната 1 – 2 мм, температура 350 0С, отно-
шение пара:газ = 3:1, обемна скорост 1200 ч-1
Срокът на използване на катализатора се определя основно от ме-ханичната якост; в процеса на работа той постепенно се разрушава, кое-то води до увеличаване на хидравличното съпротивление на слоя. Последното се наблюдава по-малко при използване на таблетирани ката-лизатори, но при тяхното използване се влошава дифузията и мате-риалът от вътрешността на таблетката се използва слабо. За подобрява-не на условията на дифузия се използва катализатор със ситно зърно или таблетки с малки размери. За намаляване на съпротивлението се използ-ват конвертори от радиален тип.
Желязохромният катализатор е малко чувствителен към отравяне от серни съединения, но съдържащите се в него или погълнати серни съединения, при взаимодействие с водород образуват H2S, който може да предизвика отравяне на катализатора в нискотемпературния стадий на конверсия. Затова при извеждане на инсталацията в режим газ от ре-актора, зареденият железохромен катализатор се изважда от схемата до-като в него се съдържа сероводород.
В състава на катализатора за нискотемпературна конверсия се въ-веждат мед, цинк и алуминий. В невъзстановена форма катализаторът е неактивен. В процеса на възстановяване CuO преминава в проста мед, която се явява катализатор на процеса. Цинковиятоксид изпълнява роля на стабилизатор, препятстващ увеличаване на размерите на кристала на медта, което може да намали активната повърхност на катализатора. За тази цел служи и алуминиевия оксид, а също и хромния оксид.
Активността и стабилността на работа на катализатора в голяма степен зависи от метода на производството му. Така например, цинко-медните катализатори с добавка на хромен оксид се приготвят чрез съв-местно утаяване имат висока активност, но не са достатъчно стабилни. Друг метод се състой в смесването на прахове от меден оксид и цинков оксид с концентриран разтвор на (NH4)2Cr2O7 и последващо закаляване и формуване. Катализаторите приготвени по този метод поддържат актив-ност на достатъчни високо ниво в продължение на 1 – 2 години. Такъв е срокът на работа на цинкомедните катализатори на фирмите Gendler, CCI и ICI. Активен и стабилно работещ катализатор ГИАП, се приготвя чрез разтваряне на Сu2CO3 в хромен анхидрид (CrO3) и смесвана разтвора със суспензия на цинков оксид. Получената маса се промотира, суши, закаля-ва и таблетира. В качество на промотор се използва манганов оксид, алу-миний, магнезий и титан.
Нискотемпературният катализатор е много чувствителен към отра-вяне от серни съединения и халогени. Условията на процеса са благопри-ятни за образуване на цинков и меден сулфид, но механизмът на отравя-не е свързан преди всичко с образуване на цинков сулфид и възникващо-то от това уголемяване на медните кристали. Аналогично е действието на йоните на хлора. Отравянето става послойно по ход на газа. Рязкото понижаване активността на катализатора в долните части на слоя се наб-людава при съдържание на сяра от 0,12%. Концентрацията на хлора, дос-татъчна за отравяне на катализатора е под аналитично измеримото ниво (0,1 мг/м3). За да се избегне отравяне на катализаторите, във връхната зона,първ по хода на конвертирания газ, се зарежда поглътител предста-вляващ смес от цинков оксид и активен алуминиев оксид. Използват се също и зеолити.
Друга причина за дезактивация на катализатора може да бъде прег-ряване на слоя, предизвикващо неговото спичане. За високотемператур-ния катализатор не трябва да се допускат температури по-високи от 500 0С, за нискотемпературния – по-високи от 260 0С. Опасност от прегряване може да възникне както при възстановяване, така и в процес на конвер-сия, доколкото реакциите на възстановяване на железния и медния оксид и реакцията на конверсия протичат с отделяне на значително количество топлина.
Количеството топлина отделящо се на стадия на високотемпера-турна конверсия, зависи преди всичко от концентрацията на СО в конвер-тирания газ. В адиабатен реактор повишението на температурата на кон-вертируемия газ в реални е около 10 0С на всеки процент превърнат въг-лероден оксид. Обикновено съдържанието на въглероден оксид в газа, получен от паровата конверсия на въглеводородите не превишава 6% от-несено към влажния газ. В такъв случай високотемпературната конверсия на СО може да се проведе в адиабатен реактор в една степен. При по-ви-соко съдържание на въглероден оксид процесът се провежда в няколко степени с междинно охлаждане на конвертирания газ.
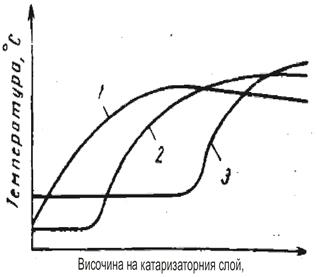
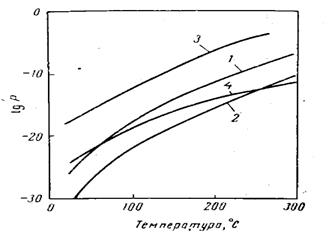
Газът постъпващ за нискотемпературна конверсия, независимо от състава на изходната суровина, съдържа не повече от 2,5% СО. Следо-вателно повишението на температурата не трябва да е повече от 25 0С, което е напълно допустимо, а прегряване е допустимо само при наруше-ние в режима на работа на предходния стадий. Характеристиката на изменение на температурата в катализаторния слой е свързана с разпре-делението по дължината на реакционната зона на реакцията на въглеродния оксид и зависи от активността на катализатора (фигура 8)

Относно кинетиката на конверсията на въглеродния оксид е предло-жен механизъм на реакция на повърхността на оксидния катализатор:
Н2О + () →Н2 + (О)
СО + (О) → С О2 + ()
Н2О + СО →С О + Н2
, където (О) – атомът на кислорода на повърхността на катализатора, () – активния центърна повърхността на катализатора.
За реакции, протичащи в кинетичната област е предложено уравне-нието:
w = k.pH2O.pCO – k-1.pCO2.pH2
B . pH 2 O + pCO 2
, където w е скорост на реакция в mol/s на 1 м3 от катализатора; k – кон-станта на скоростта, В – отношение на скоростта на правата и обратна ре-акция.
Зависимостта на k и В от температурата за железомолибденовия катализатор е следната:
k = - 34000 + 10,2 B = 8800 + 2,32
T 4,57. T
За по-точно отределяне на кинетичните фактори, J . S . Cambell и В. И. Атрощенко предлагат уравнение включващо ролята на дифузията и по-пълно описващо процеса. B . Banerjee предлага емпирична формула за скоростта на реакция w (м3/ч на 1 м3 от катализатора) от различни показа-тели на процеса, отчитащи такива фактори като дифузия, стареене и отравяне на катализатора:
w = 8,26.106. e -4,38.103/ T . P 0,5 P /250 .0,2145. ѱ .( XH 2 O /0,37)0,5.4,5/ d
, където 0,2145 – коефициент, отчитащ стареенето на катализатора и ди-фузията; ХН2О – концентрация на водни пари в газа; ѱ – коефициент, отчитащ отравянето на катализатора със сяра (при изменено съдържание на серни съединения от 0,6 до 20 мг/м3 от сухия газ ѱ се изменя от 0,1 до 0,37); d – диаметър на частиците на катализатора.
Тази зависимост се използва за пресмятане на обема на зарежда-ния катализатор за висикотемпературна конверсия на въглероден оксид при известен срок на употреба на катализатора.
Метаниране
Газът, получен след конверсия на въглероден оксид и очистване от въглероден диоксид съдържа от 0,2 до 0,5% СО и до 1% СО2. Използване на този газ за различни процеси в нефтопреработката и нефтохимията е нерационално, а понякога и невъзможно. С цел очистване на газа от при-меси на въглеродни оксиди се използва реакциата на метаниране:
СО + 3Н2 → СН4 + Н2О + 206 kJ
CO2 + 4H2 → CH4 + 2H2O + 165 kJ
Принципните преимущества на метанирането се състоят в то-ва:
1. За провеждане на процеса не е необходимо на вход да се добавят допълнителни вещества; в газа подлагащ се на очистване се съдържа значително количество водород, което спомага за пъл-ното протичане на реакцията на метаниране.
2. В газа, който се подлага на очистване се съдържа СН4 и Н2O, следователно в процеса на метаниране не се вкарват вещест-ва, несъдържащи се в него до провеждането на този стадий.
3. Метанирането позволява едновременно да се очисти газа от примеси на кислород по реакцията:
Н 2 O + 0.5O2 → H2O + 242 kJ
Последното обстоятелство, което е съществено в този случай е ако охлаждането на газа на предходния стадий се осъществява с пара или впръскване на вода.
Реакцията на метаниране на СО е реакция обратна на ПК на метана и ТД й характеристики са дадени на стр. 12, а стойността на константите на равновесие са дадени в таблица 14:
Табл.14 Константи на равновесие (К 2 ) на реакцията СО + Н2О  СО2 + Н2
СО2 + Н2
| Температура, 0С | К2 | Температура, 0C | К2 |
| 200 250 300 350 400 450 500 520 540 560 580 600 620 640 660 680 700 710 720 730 740 750 760 | 2,279.102 8,651.10 3,922.10 2,034.10 1,170.10 7,311 4,878 4,215 3,670 3,220 2,843 2,527 2,259 2,031 1,835 1,666 1,519 1,453 1,391 1,333 1,279 1,228 1,180 | 770 780 790 800 810 820 830 840 850 860 870 880 890 900 910 920 930 940 950 960 970 980 990 | 1,135 1,092 1,053 1,015 9,793.10-1 9,457.10-1 9,139.10-1 8,837.10-1 8,552.10-1 8,828.10-1 8,025.10-1 7,781.10-1 7.549.10-1 7,328.10-1 7,118.10-1 6,918.10-1 6,728.10-1 6,546.10-1 6,372.10-1 6,206.10-1 6,047.10-1 5,896.10-1 5,570.10-1 |
Константата на равновесие в реакцията на метаниране на СО2 се определя от уравнението:
Кр = рСН4.(рН2О)2
рСО2.(рН2)4
В температурния интервал 200 – 900 0С нейните стойности са след-ните:
Температура, 0С Кр Температура, 0С Кр
200 9,509.108 600 7,868.10-1
250 1,377.107 650 1,930.10-1
300 3,998.105 700 5,424.10-2
350 1,980.104 750 1,714.10-2
400 1,491.103 800 5,995.10-3
450 1,570.102 850 2,292.10-3
500 2,171.10 900 9,478.10-4
550 3,761
Равновесни концентрации на въглеродните оксиди могът да бъдат пресметнати, вземайки предвид уравнението за равновесните константи на реакциите и материалния баланс на процеса.
В условията на метаниране на газове получени в процеса на ПК, из-менението на концентрацията на водорода може да се пренебрегне. В то-зи случай пресмятането на равновесните концентрации на въглеродните оксиди значително се опростява и техните стойности могат да бъдат опре-делени с помощта на уравненията:
рСО = (рСО)2 рСО2 = 4.(рСО2)3
Кр.(рн2)3 Кр.(рН2)4
,където рСО, рСО2 и рН2 са парциалните налягания на компонентите на газа подлаган на метаниране.
Зависимостта на парциалните налягания на оксида и диоксида на въглерода в условията на ТД равновесие от температурата при съдържа-нието им в изходния газ в количество 1% е показана на фигура 9. При голям излишък на водород реакцията на метаниране при температури до 300 0С са практически необратими.
Повишаване на налягането е ТД благоприятно за протичане на реак-цията. Метанирането се провежда обикновено при 280 – 350 0С, налягане-то на процеса се определя от налягането на стадия на очистване от СО2, но ако полученият водород в последствие се компримира е възможно да се използва схема, предвиждаща метаниране при по-високо налягане. Обемната скорост зависи от налягането на процеса и използвания катали-затор и се колебае в границите от 1000 – 1500 ч-1, при атмосферно налягане до 6000 – 8000 ч-1 при 2Mpa.

Съществен фактор при метанирането е отвеждането на отделящата се реакционнна топлина. Тук повишението на температурата на газа е 74 0С на 1% СО и СО2 встъпващи в реакция. Процесът е едностепенен и се провежда в адиабатен реактор. При тази концентрация оксидите на въгле-рода в газа, постъпващ за метаниране се ограничава от горната граница на работната температура на катализатора. Практически общото съдър-жание на въглеродни оксиди в изходния газ не превишава 1%. Отделянето на топлина се съпровожда също с реакция на възстановяване на катали-затора, обаче опасността от прегряване практически отсъства.
Хидрирането на въглеродните оксиди се осъществява с висока ско-рост върху катализатори изготвени на основа на метали от VІІІ група, но при производството на водород метанирането се извършва на никелов катализатор. В състава на катализатора влизат също носител (различни форми на алуминиеви и силициеви оксиди) и промотиращи добавки (нап-ример МgO, Cr2O3). В повечето случаи се използва катализатор във вид на таблетки.
Кинетическите закономерности на реакцията на метаниране на СО са изучени по-обстойно от метанирането на СО2. Предложено е уравнение за скороста на метаниране на СО в отцъствие на СО2.
w = k. (pH2)1/2.(pCO)3/2
(pCH4)
,където k – скоростна константа.
По други данни реакцията е от първи порядък по въглеродния оксид. Забелязано е, че при провеждане на реакция на метаниране скоростта на хидриране на СО2 е по-ниска отколкото при отсъствие на СО. Затова обик-новено в газа след метаниране остатъчното съдържание на СО2 е по-високо от съдържанието на СО. В реални условия провеждането на про-цеса, скоростта на тези реакции се забавя от дифузията и нейната зависи-мост от общото налягане на процеса се изразява с формулата:
w = k.P0,3…0,5
Табл. 15 Характеристика на катализаторите за метаниране
| Състав на катализатора | Относи-телна плътност, кг/м3 | Относи-телна повърх-ност, м2/гр | Пори-стост, % | Граница на издръж-ливост при натиск, N | |
| Съдър-жание на Ni,% | оксиди | ||||
| 50 50 40 18 50 50 50 40 – 50 | Cr2O3 Al2O3 MgO Al2O3 +MgO SiO2 Al2O3 + SiO2 Cr2O3 + Al2O3 CaO + SiO2 + Al2O3 | 1200 1100 1000 1200 1000 1300 1200 900 | 145 140 140 15 150 130 140 100 | 50 55 52 53 50 45 50 57 | 44 98 284 147 196 167 88 196 |
След нискотемпературната конверсия на въглеродния оксид, газът постъпващ за метаниране не съдържа вредни за катализатора примиси. Действието на различните абсорбенти върху катализатора за метаниране е следното:
Адсорбент Действие
Воден разтвор на калиев Блокира порите на катали-
карбонат затора за метаниране при
изпарение на разтвора
Воден разтвор на калиев Същото действие, но ди-
карбонат + 3% диетанол етаноламина е безвреден
амин
Сулфолан, вода, диизо- Сулфоланът се разлага и
Пропаноламин предизвиква сярно отравяне
Моно- и диетаноламина Няма отровно действие
във воден разтвор
Метанол Същото
Друга причина за дезактивация на катализатора може да бъде него-вото прегряване от попадане на големи количества въглеродни оксиди вследствие от нарушаване на работния режим на стадия конверсия на оксидите на въглерода и промивка на конвертирания газ от СО2. Ако част от газа постъпващ за метаниране байпасира стадия на конверсия на СО е възможно отравяне на катализатора за метаниране със серни съединения. То е аналогично на отравянето на катализатора от частична-та конверсия.
Дата: 2019-05-28, просмотров: 316.