І. Въведение
Водородът е най-простият, най-лекият и най-често срещан в природата елемент. Навсякъде е в свързано състояние – във водата, в сложните молекули на въглеводородите – нефта, в природния газ. Има три изотопа: протий, деутерий и тритий, като най-разпространен е първият. Водородът изобилства в Слънчевата система като съставлява 71% от нейната маса или 91% от всички атоми.
Притеглен от гравитационните сили на Слънцето водородът се превръща в хелий чрез реакции на ядрен синтез, процесът който осигурява енергия за живот на Земята.
Молекулярният водород е газ без цвят и миризма и е практически неразтворим във вода. Противно на всички останали газове той се стопля при разширение, но само до определено налягане. Водородът е 14,5 пъти по-лек от въздуха и 16 пъти по-лек от кислорода и съгладно закона на Грем, той дифундира 4 пъти по-бълзо от кислорода във въздуха. Коефициентът му на топлопроводност е 7 пъти по-голяма от тази на въздуха.Водородът се втечнява при -253 0С, а изкристализира при -259 0С.
В химично отношение при обикновени температури водородът не е много активен. Енергично се свързва само с флуора, с хлора - фотохимично, а с кислорода при нагряване. При подходящи високи температури взаимодейства с много елементи като получените съединения се наричат хидриди.
Водородът е едно изключително перспективно гориво – при изгаряне отделя 120 МКал/кг, като продукт от изгарянето е само вода. В космическите совалки отдавна го използват за снабдяване с енергия, а получената вода астронавтите използват за пиене. Създаването на ДВГ работещ с водород би подобрило значително екоравновесието на земята.
Поради опасността от експлозия и неудобството при съхранение и транспорт, водородът все още не е намерил широко приложение като гориво за ДВГ. Най-използван метод на съхранение е в балони, като с увеличение на допустимото налягането, намаля масовото съдържание на водорода в съхранявания газ(300атм – 13% mass, 500атм – 11% mass, 900атм – 9% mass). Надежда за развитието на водорода като гориво е, че той се разтваря много добре в няко метали (600 до 3000 обема в паладий) и при загряване се освобождава. Друга насока в изследванията е използване на въглеродни нанотръбички или стъклени микросфери за съхраняване на водорода. От друга страна разтварянето на водорода в желязото е причина за намаляне на механичните му показатели (т. н. „водородна слабост”), което е причина за аварийни ситуации. В инсталации за производство на водород се използват скъпи, висококачествени стомани.
Съществуват следните методи за получаване на водород:
· Термохимични – наричат се още реформинг процеси и в момента намират най-широко приложение. Използват термокаталитично преобразуване на въглеводороди като природен газ, метанол, газолин и дори въглища във взаимодействие с водни пари.
· Електрохимични – при пропускане на електрически ток през воден разтвор на електролит се получава водород
· Фотоелектрохимични – водородът се получава, когато към потопен във вода електрод, през който протича ток, се насочи светлина.
· Фотобиологични - фотобиологичните системи принципно използват естествената фотосинтетична активност на бактерии и зелени водорасли, които синтезират водород.
В настоящето водородът е основна суровина, без който е немислимо съществуването на торовата промишленост, производството на горива, в хранителната промишленост – за произходство на хидрирани мазнини, за получаване на някои метали(W, Mo) в чист вид от техните оксиди поради неговото редукционно действие.
Водородът в нефтохимическата промишленост се получава основно при процесите на реформинг и крекинг и се използва за хидроочистка на средно и високо дестилатните фракции от серни и азотни съединения. Без него е немислимо производството на дизелови горива. В хидрокрекинг процесите се използва за получаване на изключително висококачествени бензини. Инсталациите за реформинг са източник на водород, поради протичащите в тях процеси на дехидрогенизация и циклизация на въглеводородите, но някои нефтопреработвателни заводи строят специални инсталации за производство на водород.
В торовата промишленост водородът се използва за синтез на амоняк, от който се произвеждат едни от най-високотонажните минерални торове – амониева селитра и карбамид.
Цел на настоящата дипломна работа е да се обследва процеса на реформинг на природния газ и получаване на водород като съставна част на азото-водородния синтез газ в цех АМ – 76 на „Неохим” АД.
ІІ. Теоретична част
В днешни дни основен метод за производство на водород е паро-каталитическата конверсия на въглеводородите, в частност природения газ. Нефтопреработвателната и нефтохимическа индустрия разполага с значителни ресурси на водородсъдържащи газове, които обаче не могат да се използват, заради ниското съдържание на водород в тях и присъствието на вредни примеси. Този метод е добре разработен технологично и апаратурно.
За метода на паро-кислородната газификация нефтените остатъци важи същото, но при него са нужни по-големи експлуатационни разходи и капиталовложения. Що се отнася до другите методи за получаване на водород като основен продукт (крекинг на въглеводороди, метало-паров метод, електролиза на водата, термохимични методи), те не са намерили приложение в промишлеността и затова няма да бъдат разгледани в тази дипломна работа.
Водородът в процесите на частично дехидриране (каталитически риформинт на бензина, дехидриране на бутана и бутилена), се явава страничен макар и ценен продукт.
Подготовка на суровината за каталитична конверсия
Катализатоторите използвани при парова конверсия на въглеводородите, нискотемпературна конверсия на въглеродния оксид и метаниране лесно се отравят от серни съединения. В изходната суровина може да се съдържат като примеси сероводород, меркаптани, сулфиди, тиофен и др.
В процеса на парова конверсия на въглеводородите на никеловия катализатор съединенията на сярата се хидрират с образуване на сероводород. Той взаимодейства с никеловия катализатор по реакцията:
mNi + nH2S →NiimSn + nH2
Отравянето на катализаторите, използвани за нискотемпературна конверсия на въглеродния оксид става в резултат на неговото взаимодействие с сероводород по реакцията:
ZnO + H2S →ZnS + H2O
Cu + H2S → CuS + H2
В суровината трябва да отсъстват примеси на ненаситени въглеводороди, наличието на които създава опасност от отложения на кокс върху катализатора.
В качеството на суровина за парова конверсия се използват различни газове, но най-често метан. В нефтопреработването, използваните за процеса на конверсия газове са странични продукти с променлив състав. Затова е целесъобразно на стадия на подготовка да се осигури стабилен по състав газ, чрез нискотемпературна конверсия на хомолозите на метана в метан по реакцията:
CnH2n+2 + (n-1)/2H2O → (3n+1)/4CH4 + (n-1)/4CO2
Табл. 1
М-8-10 Al-Co-Mo Al-Ni-Mo
Размер на частиците, мм
диаметър.................. 2,8 - 3,0 4,0 – 4,1 4,0 – 4,5
височина................... 4 – 8 5,0 – 5,5 4,0 – 4,5
Относителна плътност,
кг/м3.................................. 690 640 640 - 670
Активна повърхност,
м2/гр................................. 242 150 100 - 120
Активност*, % mass......... 99 98,4 95
* Активността характеризира дълобочината на превръщане на
C 2 H 5 SH , съдържащ се в природния газ, при 350 0С и обемна
Скорост 2000 ч-1 при количество на добавяния водород 5%
Табл. 2
| Поглъти-тел | Произход (фирма, страна) | Форма и размер на частиците,(мм) | Относи-телна плътност, кг/м3 | Пори- стост, % | Активна повърхност, м2/гр | Серопоглъ-щаемост при 400 0С |
| ГИАП-10 ГИАП-10-2 B-ZnO G-72C 32-4 29-2 R-5-10 | 6-03-322-72 6-03-328-72 BASF(Герм) Gerdler(САЩ) ICI(Англия) ICI(Англия) ICI(Англия) | Таблетки d = 4 -5 h = 3 – 4 Същото Гранули d=4 h=5-10 Сфери r=2-3 Сфери r=3 Таблетки d=5 h=5 Таблетки d=4 h=4-6 | 1400 – 1500 2110 1400 1230 1190 1930 1600 | 45 -55 36,9 44,8 58,6 43,3 30,3 - | 32,8 45,0 18,7 35,6 34,9 35,7 20,0 | 25,0 19,6 26,3 21,4 20,2 20,7 22,0 |
В схемата на инсталации, предвиждащи провеждане на конверсия на въглеводороди при 2,2 – 2,4 MPa, на стадия на очистка на серните съединения е целесъобразно да се използва алумоникелмолибденосиликатен катализатор и поглътител ГИАП-10. Тогава и за двата стадия условията на очистка са еднакви: температура 350 – 400 0С, обемна скорост 1000 ч-1, налягане 2,3-2,5 MPa. Такива условия са благоприятни за хидриране на ненаситените въглеводороди, които се превръщат в съответните наситени въглеводороди по реакция:
CnH2n + H2 → CnH2n+2 + Q
Термодинамически в дадения температурен интервал е възможно също да протичат реакции на хидрокрекинг на наситените въглеводороди с образуване на метан:
CnH2n+2 + (n - 1)H2 →n CH4 + Q
В таблица 3 са дадени константите на равновесие и топлинните ефекти на реакцията на хидриране на ненаситените въглеводороди и хидрокрекинг на етан и пропан.
Както се вижда от таблицата, хидрирането на ненаситените въглеводороди в интервала 300 – 400 0С практически протича до край. Такива термодинамично благоприятни условия има и за хидрокрекинг на наситените въглеводороди, но хидрокрекинг на наситените въглеводоро-ди C2 – C5 не протича на катализатори съдържащи сяра и при наличие на серни съединения в газа.
Табл. 3
| Темпера- тура, 0С | Реакция на хидриране | Реакции на хид- ро крекинг | ||||
| C2H4 | C3H6 | н-C4H8 | изо-C4H8 | C2H6 | C3H8 | |
| 200 300 400 500 600 700 800 900 1000 | 5,1.108 9,8.105 8,3.104 1,1.104 3,9.102 3,1.10 4,1 7,8.10-1 6,1.10-2 | 1,4.106 2,8.104 3,5.103 6,8.102 2,5.10 2,3 3,7.10-1 9,1.10-2 1,0.10-2 | 9,2.106 3,2.104 4,1.103 8,0.102 3,2.10 2,8 4,3.10-1 1,0.10--1 1,0.10-2 | 1,0.106 5,1.103 6,5.102 1,1.102 6,7 7,9.10-1 1,4.10-1 4,1.10-2 6,3.10-3 | -- 1,5.106 2,03.105 4,47.104 1,33.104 4,97.103 2,22.103 -- -- | -- 4,62.1011 1,04.1010 5,90.108 5,98.107 9,15.106 1,97.106 -- -- |
| Q, kJ/mol | 137 | 126 | 127 | 119 | 68 | 127 |
Провеждани са опити за едновременно очистване на нефтозаводските газове от серни съединения и хидриране на ненаситените въглево-дороди в лабораторни условия с използване на алумокобалтомолибденов и алумоникелмолибденов катализатор и поглътител ГИАП-10. Условията и резултатите от опита са следните:
Продължителност на изпитанието, ч 3000
Налягане, MPa.................................... 2,0
Температура, 0С................................. 380 - 400
Обемна скорост, ч-1............................ 1000 – 1500
Съдържание на H2 в суровината, % 35 – 60
Съдържание на ненавитени въгле-
Водороди, %
в суровината............................... 5 – 20
в изходящите газове.................. отсъства
Съдържание на меркаптани, мг/нм3
в суровината.............................. 5,3 – 28
в изходящите газове................. 0,1 – 0,9 0,1 – 0,3
(на Al–Co–Mo) (на Al-Ni-Mo)
Лабораторните опити погазали, че хидриране на ненаситените въглеводороди протича до край, в същото време хидрокрекинг на наситените въглеводороди не се наблюдава.
Реакцията на хидрокрекинг на серните съединения е екзотермична, но впредвид малките количества на тези съединения в суровината, топлинния ефект може да бъде пренебрегнат. При значително съдържание на ненаситени съединения в суровината, в резултат на тяхното хидрира-не, се повишава температурата на процеса. Например, при съдържание на 2,5% етилен, температурата на газа на изход от реактора се повишава с 25 0С. В такъв случай, ако се хидрира газ, съдържащ повече от 4% ненаситени въглеводороди, за да се избегне прегряване на катализатора е необходимо да се обезпечи отвеждане на топлината от реактора.
Продължителността на работа на катализатора, използван за очистване на суровината от серни съединения и ненаситени въглеводороди, обикновено е 2 – 3 години. Срокът на използване на поглътителя зависи от съдържанието на H2S в газа. Ако сяроуловяемостта на поглътителя е недостатъчна или концентрацията на серни съединения е висока, в схемата се предвижда включване на два последователно действащи апарата с поглътител.
Нефтозаводските газове след моноетаноламиновата очистка от сероводород съдържат 50 – 100 мг/м3 серни съединения. В този случай про серопоглъщаемост 20% от масата, срокът на използвана за едно зареждане с поглътител е 3 – 6 хил. часа, т.е. доста по-малко от срока на използване на хидриращите катализатори. Затова е нерационално да се използват така наречените бифункционални катализатори, представляващи полгътител с добавка от хидриращ агент и предназначени за гидрогенолиза на серните съединения и едновременно поглъщане на сяроводо-рода. Освен това, на бифункционалните катализатори хидрирането на ненаситените въглеводороди не протича с достатъчна дълбочина.
Табл. 4
| Въглеро- ден екви- валент | Разход на пара, м3/м3 | Състав на газа, %(об.) | Добов на газ, м3/м3 | Количество отделяща се топлина, kJ/m3 | ||||
| CO2 | CO | H2 | CH4 | сух | влажен | |||
| 1,0 1,2 1,4 1,6 1,8 2,0 2,2 2,4 2,6 2,8 3,0 | 2,0 2,4 2,8 3,2 3,6 4,0 4,4 4,8 5,2 5,6 6,0 | 4,95 7,69 9,77 11,41 12,73 13,81 14,72 15,50 16,16 16,74 17,25 | 0,06 0,07 0,08 0,09 0,09 0,09 0,09 0,08 0,08 0,08 0,07 | 19,95 17,18 15,08 13,43 12,12 11,03 10,13 9,36 8,70 8,12 7,62 | 75,04 75,06 75,06 75,07 75,06 75,06 75,06 75,06 75,06 75,06 75,06 | 1,24 1,44 1,64 1,84 2,04 2,24 2,44 2,64 2,84 3,04 3,24 | 3,12 3,62 4,12 4,62 5,12 5,62 6,12 6,62 7,12 7,62 8,12 | 422,8 542,0 663,5 784,9 904,2 1025,8 1147,2 1268,0 1385,8 1507,2 1628,7 |
Табл. 5 Уравнения на равновесния състав на конвертирания газ и парциалните налянагия на неговите компоненти при конвесия на метана
| Компоненти | Обем на газовата смес, м3 | Парциално налягане на компонентите в конвертирания газ, MPa | |
| Начален | След конверсията | ||
| CH4 H2O CO CO2 H2 | 1 a - - - | 1 – α a – α – β α – β β 3α + β | ( 1 – α ) . Р 1 + a +2α (a – α – β).P 1 + a + 2α (α – β).P 1 + a + 2α β.P 1 + a + 2α (3α + β).P 1 + a + 2α |
| Общо | 1 + a | 1 + a + 2α = V | P |
Легенда: a – обем на подадената пара за единица от обема CH4; α – част на реагиралия CH4; β – част на реагиралия CO; Р – налягане в систе-мата; V – общ обем на конвертирания газ.
Замествайки съответно на парциалните налягания на компонентите в уравненията на константите на равновесие на реакциите се получава:
K 1 = [(α – β).(3α + β)3].P2
(1 – α ).( a – α – β ).(1 + a + 2 a )2 (5)
K 2 = β.(3α + β)
( α – β ).( a – α – β ) (6)
Хомолозите на метана C2 – C10 са по-неустойчиви при еднакви температурни условия отколкото метана, което е видно от данните за константите на равновесие на реакциите на конверсия на метана, етана и пропана с водна пара, приведени в табл. 6. Термодинамичните разчети са показали, че при 300 0С и по-висши хомолози на метана присъвстват в конвертирания газ в нищожни количества.
Табл. 6 Константи на равновесие на реакцията на кон версия на метана, етана и пропана в водна пара
| Температура, 0С | KCH4 | KC2H6 | KC3H8 |
| 327 427 527 627 727 827 | 5,058.10-7 2,687.10-4 3,120.10-2 1,306 26,56 3,133.102 | 3,805.10-7 1,467.10-2 43,281 2,268.104 3,505.106 2,184.108 | 5,686.10-8 0,2015 1,775.104 1,331.108 1,716.1011 6,084.1013 |
Термодинамичните изчисления на паровата конверсия на алифатните въглеводороди, започваща от 300 0С, може да бъде водена използвайки уравненията за парова конверсия на метана (2) и окиси на въглеро-да (3), а също и уравнението за парова конверсия на хомолозите на метана в метан (1). Предвид последните уравнения за стехиометричните съотношения на компонентите и техните парциални налягания при паровата конверсия на алифатните въглеводороди приемат значенията, приведени в табл.7.
Табл. 7 Уравнение за равновесния състав на конвертирания газ и парциалните налягания на неговите компоненти при конверсия на алифатните въглеводороди
| Компо-ненти | Обем на газовата смес, м3 | Парциално налягане на компонентите, MPa | |
| Начален | След конверия | ||
| CnH2n+2 CH4 H2O CO CO2 H2 | 1 - (n-1)/2 + [(3n + 1)a]/4 - - - | - (3n + 1)/4.(1 – α) (3n + 1)/4.(a – α – β) (3n + 1)/4.(α – β) (3n + 1)/4.β + (n – 1)/4 (3n + 1)/4.(3α + β) | - (3n + 1)/4.(1 – α).P/V (3n + 1)/4.(a – α – β).P/V (3n + 1)/4.(α – β).P/V [(3n + 1)/4.β + (n – 1)/4].P/V (3n + 1)/4.(3α + β).P/V |
| Общо | 1 + (n – 1)/2 + + (3n + 1)/4.a | (n – 1)/4 + (3n + 1)/4. .(1 + a + 2α) = V | P |
Замествайки парциялните налягания със значенията им от таблицата, в уравненията за константите на равновисие ще получим
K 1 = (α – β).(3α + β) 3 . [(3 n – 1)/4. P / V ]2
(1 – α ).( a – α – β ) (7)
K 2 = [(n – 1)/(3n +1) + β](3α + β)
( α – β ).( a – α – β ) (8)
Уравнения (5) и (6) са частен случай на уравнения (7) и (8), когато n=1.
Последните уравнения позволяват да се изчисляват състава и добива на конвертиран газ не само за процеса на пълна конверсия на въглеводородите, когато преобладаващи компонент стават H2, CO, CO2, а съдържанието на CH4 неголямо, но и за частична конверсия на въглеводородите, когато преобладаващ продукт на реакциите се явява CH4.
С помощта на горните уравнения и таблици с метода за последователното приближение се извършват дигитални изчисления за условията на протичане на реакциите на парова конверсия за съвременните схеми за производство на водород. Във връзка с това, че в реални условия рав-новесието на реакциите на конверсия на метана с пара не се достига, за практически изчисления на K1 се приема температура, по-ниска от темпе-ратурата на изход от реактора. При провеждане на процеса под налягане 2 – 3MPa разликата е 20 -30 0С.
Паровата конверсия на въглеводородите се провежда така, че на катализатора да не се отлага водород. Закоксуването с въглерод върху катализатора може да доведе до неговото разрушение и увеличаване на съпротивлението на катализаторния слой. Затова едновременно с описаните по-горе изчисления се правят и разчети на термодинамичното равновесие на реакциите с възможно образуване на въглерод в системата по една от следващите реакции:
CnH2n+2 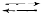 nC +(n + 1)H2 – Q
nC +(n + 1)H2 – Q
CO + H2 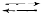 C + H2O + Q
C + H2O + Q
2 CO 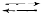 C + CO 2 + Q
C + CO 2 + Q
Константите на равновесие на реакциите на разпадане на въглеводородите приведени в приложение в табл. 8. Константите на равновесие на последните две реакции K3 и K4 са следните:
Температура K3 = PCOPH 2 K4 = ( PCO )2
PH2O PCO2
300 1,43.10-5 3,60.10-7
500 2,01.10-2 4,51.10-3
700 2,00 1,32
900 2,97.101 3,90.101
1100 2,25.102 4,72.102
Табл. 8 Константи на равновесие на реакциите на разпадане на въглеводородие
| Тем- пера- тура, 0С | KCH4 | KC2H6 | KC3H8 | KC2H4 | KC3H6 | KC2H2 |
| 200 400 600 800 1000 1200 1400 | 9,3.103 2,0.10 6,9.10-1 8,5.10-2 2,0.10-2 7,1.10-3 3,2.10-3 | 1,4.10 3,3.10-3 3,3.10-5 1,9.10-6 2,6.10-7 6,3.10-8 2,1.10-8 | 32.10-2 1,0.10-6 1,5.10-9 1,1.10-10 9,8.10-12 1,7.10-12 4,7.10-13 | 5,5.10-8 3,5.10-7 9,1.10-7 1,7.10-6 2,5.10-6 3,5.10-6 4,4.10-6 | 3,2.10-10 2,5.10-10 2,2.10-10 2,0.10-10 1,9.10-10 1,8.10-10 1,7.10-10 | 2,5.10-23 1,4.10-14 1,7.10-11 6,3.10-9 3,6.10-7 6,9.10-6 6,6.10-5 |
За определяне на термодинамичните условия за отложение на въглерод по реакция CO + H2 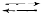 C + H2O намираме константата на равновесие по формулата:
C + H2O намираме константата на равновесие по формулата:
K 3 = PCOPH2
PH 2 O
Използвайки парциалните налягания на реакцията на конверсия от табл. 7 ще получим за K3 следното уравнение:
K3 = (α – β)(3α + β)(1 + a + 2α) .V
(a – α – β) P
Минималният разход на пара в процеса на парова конверсия на нефтени газове и бензини, под който е възможно закоксуване, се определя като се решат съвместно последното уравнение с уравнения (7) и (8). Тогава ще получим:
K 3 = (α – β)(3α + β)(3n + 1) . V
( a – α – β ) P
Тези уравнения обаче не се отнасят за конверсия на газове, съдържащи ненаситени и ароматни въглеводороди, които на вход в реакторната зона могат да се разпаднат с отделяне на въглерод.
Процесът на парова конверсия се извършва с топлообмен през стените на реактора. Количеството на подаваната топлинна енергия може да се изчисли след като са определени добива и състава на конвертирания газ. Сметките се правят възоснова на първия закон на термодинамиката по уравнението на топлинния баланс:
q = Q н ’ + t ’.( c ’ + ac ’) – V .( Q н ’’ + c ’’ t ’’)
, където q – топлината подадена отвън в процеса на парова конверсия (ПК) на 1 м3 изходящ газ, kJ/m3; Qн’ – топлината на изгаряне на изходния газ, kJ/m3; Qн’’ – топлината на изгаряне на влажния конвертиран газ, kJ/m3; t’ и t’’ – температура на парогазовата смес на вход в реактора и температура на конвертирания газ на изход от реактора, 0С; c’ – средна топлоемкост на изходния газ и водната пара при постоянно налягане и температура на вход в реактора, kJ/(m3.0C); c’’ – средна топлоемкост на влажния конвертиран газ при постоянно налягане и температура на изход от реактора, kJ/(m3.0C); V – обем на влажния конвертиран газ, получен за 1 м3 от изходния газ, м3; a – обем на водната пара, подавана за 1 м3 от изходния газ, м3.
Режим на процеса
Режимът на паро-каталитичната конверсия на въглеводородите трябва да осигурява получаване на технически водород със съдържание 95 – 98% H2. При по-ниска концентрация се повишават разходите на инсталацията за хидрокрекинг. Производството на водород с висока концентрация изисква големи капита-ловложения и не е оправдано икономически. Технически водород с концентра-ция около 95% водород може да се получи при съдържание в сухия конвертиран газ 2 – 2,5% метан, тъй като в следващите процеси на очистване от CO2 след конверсията на въглеродния оксид и метаниране съдържанието на метана в газа нараства до 4 – 5%. Степента на конверсия на метана в такъв случай е 0,9. Технически водород със съдържание 98% Н2 се получава при съдържание в конверти-рания газ на 1 – 1,3% СН4 или степен на конверсия на метана 0,95.
Водород със съответната концентрация може да бъде получен чрез изменение на налягането, температурата и отношението пара/метан. Връзката между тези параметри е илюстрирана на фигура 1 и 2.
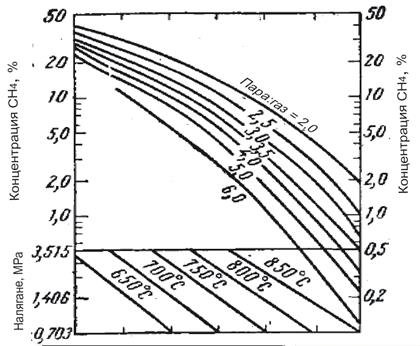
Фиг. 1 Зависимост на конц. СН4 в сухия газ от температурата, на негането, отношението пара/метан в условията на достигнато термодинамично равновесие
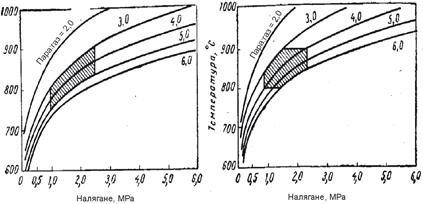
Фиг.2 Режими на процеса на ПК на метана, осигуряващи в условията на ТД равновесие получаване на 95% Н2 и 96% Н2 (съответно първата и втора графика; защрихованите об ласти са условията, при които се работи в съществуващи те инсталации)
Както се вижда от фигурите, режимът може да се променя в широки диапазони, но техническите възможности на оборудването, а също и режимите на другите стадии на производство и отделянето на въглерод при определени гранични условия, значително стесняват този диапазон. Резултатите от пресмятането за минимален разход на пара, под които се отделя въглерод, са показани във фи-гура 3.
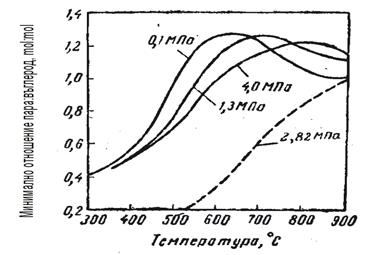
Табл. 11 Характеристика на катализаторите за конверсия на въглеводороди, произвеждани в Русия
| Показатели | ГИАП-3 | ГИАП-3-6н | ГИАП-5 | ГИАП-16 | ГИАП-15 |
| Химичен състав, % NiO ……………………. Al2O3 ………………….. CaO …………………... MgO …………………... SiO2 …………………… Fe2O3 …………………. TiO2 …………………… Гранула-пръстен с размер, мм Гранула-пръстен с размер, мм Гранула-цилиндър с размер, мм Относителна плътност, кг/м3 Относителна повърхност, м2/гр Пористост, %............................ Средна механична якост, МN/m2 | 4,5 95,0 - - - - - 11х11х3 15х15х5 20х20х7 8х9 1400 8 33 – 39 60 - 90 | 7,0 86,0 - - - - - 8х9 12х12 1650 8 33 90 | 23 – 26 24 – 30 10 – 15 11 – 17 18 – 25 ≤4 ≤2 10х10х4 14х14х6 19х19х8 - 800 – 900 30 – 50 31 50 | 25 46 14 15 - - - 15х17х11 - 1100 44 33 70 | 6 – 10 88 – 92 - - - - ≤2 12х12х6 - 1200 0,5 25 55 |
За да се предотврати отделяне на въглерод към катализатора се добавят алкални метали, катализиращи газификацията на въглерода. В този случай добавката на алкален метал е по-оправдана, отколкото при каталицаторите за пълна конверсия, доколкото до 500 0С алкалите почти не се унасят. От алкалните и алкалоземни метали, най-често се препо-ръчва добавка на калий, макар че има и препоръки за Ba, Mg и Са. Изпол-зват се също катализатори съдържащи 10 – 30% Ni на Al2O3. В такъв ка-тализатор се добавя 5 – 25% Zn или Cr и се промотира с вече споменати-те добавки.
Основните производители на катализатори са фирми като Gendler (САЩ), ICI(Англия), BASF(Германия). Фирма Gendler произвежда катали-затор G-56 с различно съдържание на никел в пръстеновидна форма. Фирма ICI има катализатор 57-1, предназначен за ПК на природен газ и нефтозавод-ски газове, несъдържащи ненаситени въглеводороди, при налягане до 3 МРа и температура до 850 0С. Съставът на катализаторите от фирма ICI е следния:
марка............ 57-1 46-1 марка........... 57,1 46-1
Ni ……………. 32 21 Al2O3 ……….. 54 32
CaO …………. 14 11 MgO ………… - 13
SiO2 …………. 0,1 16 K2O …………. - 7
Табл. 13 Материален баланс за изчисляване на равновисието на конверия на въглероден оксид
| Компоненти | Изходящ газ, mol | Реагирало коли- чество, mol | Полу-чено,mol | Конвертиран газ, mol |
| CO H2 CO2 CH4 | a b c 1 – (a + b + c) | x - - - | - x x - | a – x b + x c + x 1 – (a + b + c) |
| Общ сух газ | 1 | х | 2х | 1 + х |
| Н2О | е | х | - | е - х |
| Общ влажен газ | 1 + е | 2х | 2х | 1 + е |
Изчисленията показват, че за достигане на дастатъчно ниска кон-центрация на въглероден оксид в конвертирания газ, конверсията трябва да се провежда при температура не по-висока от 250 0С. С цел повишава-не производителността на процеса, конверсията обикновено се провежда на две степени: на първа се използва високотемпературен желязохромен катализатор, на втора – нискотемпературен катализатор, на който медта е активен компонент. Преди откриването на нискотемпературните катали-затори, конверсията на въглероден оксид се е провеждала на железохро-мен катализатор при 350 – 450 0С в няколко степени. Високата степен на превръщане на СО се достигала за сметка на големия излишък на водна пара и очистване на конвертирания газ от въглероден диоксид между сте-пените. Такава схема е тромава и неикономична, затова с основно значе-ние на изследванията за този стадий е откриването на нискотемперату-рен катализатор.
Двустепенната конверсия на въглероден оксид на първи стадий се провежда при 350 – 400 0С, а на втори – при 220 – 250 0С. В газа, на вход на първа степен, отношението пара:газ се определя от режима на пред-ходния стадий (конверсия на въглеводородите) и трябва да се поддържа не подържа не по-ниско от 0,6:1 при налягане 2МРа и не по-ниско от 0,9:1 при налягане близко до атмосферното. Ако в газа получен на предходния стадий парата е недостатъчно, тя се добавя. Излишъкът на пара е благо-приятен за провеждане на конверсия, но при определени условия той мо-же да способства за отравяне на катализатора.
Обемната скорост също зависи от налягането, при което се осъще-ствява прощеса и се променя от 1000ч-1 при налягане, близко до атмос-ферното, до 2500ч-1 при 2 МРа. Налягането на процеса обикновено зави-си от налягането на предходния стадий. На инсталации за ПК на въглево-дороди, конверсия на въглеродния оксид се води при налягане близко до атмосферното или при 2,0 – 2,5 МРа. На инсталации за газификазия на-лягането може да бъде повишено до 15 МРа. Въпреки, че изменение на налягането не влияе на равновесието на реакцията, повишеното наляга-не се оказва благоприятно влияние на кинетичните фактори, които позво-ляват да се увеличи обемната скорост на газа.
В описаните условия конверсия на въглероден оксид протича с дъл-боко превръщане, близко до равновесното. Във всеки случай съдържа-нието на СО в газа след високотемпературна конверсия е 3 – 4%, а след нискотемпературна конверсия – до 0,5%. В реални условия дълбочината на превръщане на СО на стадия на високотемпературна конверсия е92 – 95%, а на стадия на нискотемпературна конверсия 90 – 92% от равно-весната дълбочина а превръщане.
За стадия на високотемпературна конверсия в началото се е из-ползвал катализатор на основата на Fe3O4. След това той е бил осъвър-шенстван с въвеждане на оксиди на хрома, възпрепятстващи увелича-ването на кристалите на Fe3O4, което увеличава срока на работа на ката-лизатора. Днес за този стадий на процеса се използват само модифика-ции на железохромния катализатор, отличаващи се по начина на произ-водство. Основни характеристики на двата железохромни катализатори № 482 и С-12-1 са следните:
№482 С-12-1
Форма.................................. гранули таблетки
Диаметър, мм..................... 4,5 – 5,5 9,7
Височина, мм...................... 5 – 20 4,9
Съдържание, %
желязо......................... 89 – 90 85,8
хром............................. 7,0 – 7,5 9,4
Активност* по скоростна кон-
станта при 350 0С, см3/гр ката-
лизатор в час..................... 1,0 – 1,3 1,30
Механична якост на
надлъжно напрежение, MN/m2 35 – 40 35
напречно напрежение, MN/m2 82,2 251
Относителна плътност, кг/м3 1150 1200
Относителна повърхност, м2/гр 25 – 30 110
Обем на порите, см3/гр..... 0,32 0,24
в това число с радиус
r < 7,5 нм 0,03 0,12
r > 7,5 нм 0,29 0,12
* активността е измерене на инсталация от проточен тип:
размер на зърната 1 – 2 мм, температура 350 0С, отно-
шение пара:газ = 3:1, обемна скорост 1200 ч-1
Срокът на използване на катализатора се определя основно от ме-ханичната якост; в процеса на работа той постепенно се разрушава, кое-то води до увеличаване на хидравличното съпротивление на слоя. Последното се наблюдава по-малко при използване на таблетирани ката-лизатори, но при тяхното използване се влошава дифузията и мате-риалът от вътрешността на таблетката се използва слабо. За подобрява-не на условията на дифузия се използва катализатор със ситно зърно или таблетки с малки размери. За намаляване на съпротивлението се използ-ват конвертори от радиален тип.
Желязохромният катализатор е малко чувствителен към отравяне от серни съединения, но съдържащите се в него или погълнати серни съединения, при взаимодействие с водород образуват H2S, който може да предизвика отравяне на катализатора в нискотемпературния стадий на конверсия. Затова при извеждане на инсталацията в режим газ от ре-актора, зареденият железохромен катализатор се изважда от схемата до-като в него се съдържа сероводород.
В състава на катализатора за нискотемпературна конверсия се въ-веждат мед, цинк и алуминий. В невъзстановена форма катализаторът е неактивен. В процеса на възстановяване CuO преминава в проста мед, която се явява катализатор на процеса. Цинковиятоксид изпълнява роля на стабилизатор, препятстващ увеличаване на размерите на кристала на медта, което може да намали активната повърхност на катализатора. За тази цел служи и алуминиевия оксид, а също и хромния оксид.
Активността и стабилността на работа на катализатора в голяма степен зависи от метода на производството му. Така например, цинко-медните катализатори с добавка на хромен оксид се приготвят чрез съв-местно утаяване имат висока активност, но не са достатъчно стабилни. Друг метод се състой в смесването на прахове от меден оксид и цинков оксид с концентриран разтвор на (NH4)2Cr2O7 и последващо закаляване и формуване. Катализаторите приготвени по този метод поддържат актив-ност на достатъчни високо ниво в продължение на 1 – 2 години. Такъв е срокът на работа на цинкомедните катализатори на фирмите Gendler, CCI и ICI. Активен и стабилно работещ катализатор ГИАП, се приготвя чрез разтваряне на Сu2CO3 в хромен анхидрид (CrO3) и смесвана разтвора със суспензия на цинков оксид. Получената маса се промотира, суши, закаля-ва и таблетира. В качество на промотор се използва манганов оксид, алу-миний, магнезий и титан.
Нискотемпературният катализатор е много чувствителен към отра-вяне от серни съединения и халогени. Условията на процеса са благопри-ятни за образуване на цинков и меден сулфид, но механизмът на отравя-не е свързан преди всичко с образуване на цинков сулфид и възникващо-то от това уголемяване на медните кристали. Аналогично е действието на йоните на хлора. Отравянето става послойно по ход на газа. Рязкото понижаване активността на катализатора в долните части на слоя се наб-людава при съдържание на сяра от 0,12%. Концентрацията на хлора, дос-татъчна за отравяне на катализатора е под аналитично измеримото ниво (0,1 мг/м3). За да се избегне отравяне на катализаторите, във връхната зона,първ по хода на конвертирания газ, се зарежда поглътител предста-вляващ смес от цинков оксид и активен алуминиев оксид. Използват се също и зеолити.
Друга причина за дезактивация на катализатора може да бъде прег-ряване на слоя, предизвикващо неговото спичане. За високотемператур-ния катализатор не трябва да се допускат температури по-високи от 500 0С, за нискотемпературния – по-високи от 260 0С. Опасност от прегряване може да възникне както при възстановяване, така и в процес на конвер-сия, доколкото реакциите на възстановяване на железния и медния оксид и реакцията на конверсия протичат с отделяне на значително количество топлина.
Количеството топлина отделящо се на стадия на високотемпера-турна конверсия, зависи преди всичко от концентрацията на СО в конвер-тирания газ. В адиабатен реактор повишението на температурата на кон-вертируемия газ в реални е около 10 0С на всеки процент превърнат въг-лероден оксид. Обикновено съдържанието на въглероден оксид в газа, получен от паровата конверсия на въглеводородите не превишава 6% от-несено към влажния газ. В такъв случай високотемпературната конверсия на СО може да се проведе в адиабатен реактор в една степен. При по-ви-соко съдържание на въглероден оксид процесът се провежда в няколко степени с междинно охлаждане на конвертирания газ.
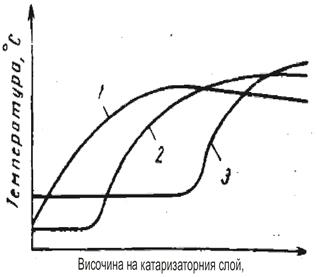
Газът постъпващ за нискотемпературна конверсия, независимо от състава на изходната суровина, съдържа не повече от 2,5% СО. Следо-вателно повишението на температурата не трябва да е повече от 25 0С, което е напълно допустимо, а прегряване е допустимо само при наруше-ние в режима на работа на предходния стадий. Характеристиката на изменение на температурата в катализаторния слой е свързана с разпре-делението по дължината на реакционната зона на реакцията на въглеродния оксид и зависи от активността на катализатора (фигура 8)

Относно кинетиката на конверсията на въглеродния оксид е предло-жен механизъм на реакция на повърхността на оксидния катализатор:
Н2О + () →Н2 + (О)
СО + (О) → С О2 + ()
Н2О + СО →С О + Н2
, където (О) – атомът на кислорода на повърхността на катализатора, () – активния центърна повърхността на катализатора.
За реакции, протичащи в кинетичната област е предложено уравне-нието:
w = k.pH2O.pCO – k-1.pCO2.pH2
B . pH 2 O + pCO 2
, където w е скорост на реакция в mol/s на 1 м3 от катализатора; k – кон-станта на скоростта, В – отношение на скоростта на правата и обратна ре-акция.
Зависимостта на k и В от температурата за железомолибденовия катализатор е следната:
k = - 34000 + 10,2 B = 8800 + 2,32
T 4,57. T
За по-точно отределяне на кинетичните фактори, J . S . Cambell и В. И. Атрощенко предлагат уравнение включващо ролята на дифузията и по-пълно описващо процеса. B . Banerjee предлага емпирична формула за скоростта на реакция w (м3/ч на 1 м3 от катализатора) от различни показа-тели на процеса, отчитащи такива фактори като дифузия, стареене и отравяне на катализатора:
w = 8,26.106. e -4,38.103/ T . P 0,5 P /250 .0,2145. ѱ .( XH 2 O /0,37)0,5.4,5/ d
, където 0,2145 – коефициент, отчитащ стареенето на катализатора и ди-фузията; ХН2О – концентрация на водни пари в газа; ѱ – коефициент, отчитащ отравянето на катализатора със сяра (при изменено съдържание на серни съединения от 0,6 до 20 мг/м3 от сухия газ ѱ се изменя от 0,1 до 0,37); d – диаметър на частиците на катализатора.
Тази зависимост се използва за пресмятане на обема на зарежда-ния катализатор за висикотемпературна конверсия на въглероден оксид при известен срок на употреба на катализатора.
Метаниране
Газът, получен след конверсия на въглероден оксид и очистване от въглероден диоксид съдържа от 0,2 до 0,5% СО и до 1% СО2. Използване на този газ за различни процеси в нефтопреработката и нефтохимията е нерационално, а понякога и невъзможно. С цел очистване на газа от при-меси на въглеродни оксиди се използва реакциата на метаниране:
СО + 3Н2 → СН4 + Н2О + 206 kJ
CO2 + 4H2 → CH4 + 2H2O + 165 kJ
Принципните преимущества на метанирането се състоят в то-ва:
1. За провеждане на процеса не е необходимо на вход да се добавят допълнителни вещества; в газа подлагащ се на очистване се съдържа значително количество водород, което спомага за пъл-ното протичане на реакцията на метаниране.
2. В газа, който се подлага на очистване се съдържа СН4 и Н2O, следователно в процеса на метаниране не се вкарват вещест-ва, несъдържащи се в него до провеждането на този стадий.
3. Метанирането позволява едновременно да се очисти газа от примеси на кислород по реакцията:
Н 2 O + 0.5O2 → H2O + 242 kJ
Последното обстоятелство, което е съществено в този случай е ако охлаждането на газа на предходния стадий се осъществява с пара или впръскване на вода.
Реакцията на метаниране на СО е реакция обратна на ПК на метана и ТД й характеристики са дадени на стр. 12, а стойността на константите на равновесие са дадени в таблица 14:
Табл.14 Константи на равновесие (К 2 ) на реакцията СО + Н2О  СО2 + Н2
СО2 + Н2
| Температура, 0С | К2 | Температура, 0C | К2 |
| 200 250 300 350 400 450 500 520 540 560 580 600 620 640 660 680 700 710 720 730 740 750 760 | 2,279.102 8,651.10 3,922.10 2,034.10 1,170.10 7,311 4,878 4,215 3,670 3,220 2,843 2,527 2,259 2,031 1,835 1,666 1,519 1,453 1,391 1,333 1,279 1,228 1,180 | 770 780 790 800 810 820 830 840 850 860 870 880 890 900 910 920 930 940 950 960 970 980 990 | 1,135 1,092 1,053 1,015 9,793.10-1 9,457.10-1 9,139.10-1 8,837.10-1 8,552.10-1 8,828.10-1 8,025.10-1 7,781.10-1 7.549.10-1 7,328.10-1 7,118.10-1 6,918.10-1 6,728.10-1 6,546.10-1 6,372.10-1 6,206.10-1 6,047.10-1 5,896.10-1 5,570.10-1 |
Константата на равновесие в реакцията на метаниране на СО2 се определя от уравнението:
Кр = рСН4.(рН2О)2
рСО2.(рН2)4
В температурния интервал 200 – 900 0С нейните стойности са след-ните:
Температура, 0С Кр Температура, 0С Кр
200 9,509.108 600 7,868.10-1
250 1,377.107 650 1,930.10-1
300 3,998.105 700 5,424.10-2
350 1,980.104 750 1,714.10-2
400 1,491.103 800 5,995.10-3
450 1,570.102 850 2,292.10-3
500 2,171.10 900 9,478.10-4
550 3,761
Равновесни концентрации на въглеродните оксиди могът да бъдат пресметнати, вземайки предвид уравнението за равновесните константи на реакциите и материалния баланс на процеса.
В условията на метаниране на газове получени в процеса на ПК, из-менението на концентрацията на водорода може да се пренебрегне. В то-зи случай пресмятането на равновесните концентрации на въглеродните оксиди значително се опростява и техните стойности могат да бъдат опре-делени с помощта на уравненията:
рСО = (рСО)2 рСО2 = 4.(рСО2)3
Кр.(рн2)3 Кр.(рН2)4
,където рСО, рСО2 и рН2 са парциалните налягания на компонентите на газа подлаган на метаниране.
Зависимостта на парциалните налягания на оксида и диоксида на въглерода в условията на ТД равновесие от температурата при съдържа-нието им в изходния газ в количество 1% е показана на фигура 9. При голям излишък на водород реакцията на метаниране при температури до 300 0С са практически необратими.
Повишаване на налягането е ТД благоприятно за протичане на реак-цията. Метанирането се провежда обикновено при 280 – 350 0С, налягане-то на процеса се определя от налягането на стадия на очистване от СО2, но ако полученият водород в последствие се компримира е възможно да се използва схема, предвиждаща метаниране при по-високо налягане. Обемната скорост зависи от налягането на процеса и използвания катали-затор и се колебае в границите от 1000 – 1500 ч-1, при атмосферно налягане до 6000 – 8000 ч-1 при 2Mpa.

Съществен фактор при метанирането е отвеждането на отделящата се реакционнна топлина. Тук повишението на температурата на газа е 74 0С на 1% СО и СО2 встъпващи в реакция. Процесът е едностепенен и се провежда в адиабатен реактор. При тази концентрация оксидите на въгле-рода в газа, постъпващ за метаниране се ограничава от горната граница на работната температура на катализатора. Практически общото съдър-жание на въглеродни оксиди в изходния газ не превишава 1%. Отделянето на топлина се съпровожда също с реакция на възстановяване на катали-затора, обаче опасността от прегряване практически отсъства.
Хидрирането на въглеродните оксиди се осъществява с висока ско-рост върху катализатори изготвени на основа на метали от VІІІ група, но при производството на водород метанирането се извършва на никелов катализатор. В състава на катализатора влизат също носител (различни форми на алуминиеви и силициеви оксиди) и промотиращи добавки (нап-ример МgO, Cr2O3). В повечето случаи се използва катализатор във вид на таблетки.
Кинетическите закономерности на реакцията на метаниране на СО са изучени по-обстойно от метанирането на СО2. Предложено е уравнение за скороста на метаниране на СО в отцъствие на СО2.
w = k. (pH2)1/2.(pCO)3/2
(pCH4)
,където k – скоростна константа.
По други данни реакцията е от първи порядък по въглеродния оксид. Забелязано е, че при провеждане на реакция на метаниране скоростта на хидриране на СО2 е по-ниска отколкото при отсъствие на СО. Затова обик-новено в газа след метаниране остатъчното съдържание на СО2 е по-високо от съдържанието на СО. В реални условия провеждането на про-цеса, скоростта на тези реакции се забавя от дифузията и нейната зависи-мост от общото налягане на процеса се изразява с формулата:
w = k.P0,3…0,5
Табл. 15 Характеристика на катализаторите за метаниране
| Състав на катализатора | Относи-телна плътност, кг/м3 | Относи-телна повърх-ност, м2/гр | Пори-стост, % | Граница на издръж-ливост при натиск, N | |
| Съдър-жание на Ni,% | оксиди | ||||
| 50 50 40 18 50 50 50 40 – 50 | Cr2O3 Al2O3 MgO Al2O3 +MgO SiO2 Al2O3 + SiO2 Cr2O3 + Al2O3 CaO + SiO2 + Al2O3 | 1200 1100 1000 1200 1000 1300 1200 900 | 145 140 140 15 150 130 140 100 | 50 55 52 53 50 45 50 57 | 44 98 284 147 196 167 88 196 |
След нискотемпературната конверсия на въглеродния оксид, газът постъпващ за метаниране не съдържа вредни за катализатора примиси. Действието на различните абсорбенти върху катализатора за метаниране е следното:
Адсорбент Действие
Воден разтвор на калиев Блокира порите на катали-
карбонат затора за метаниране при
изпарение на разтвора
Воден разтвор на калиев Същото действие, но ди-
карбонат + 3% диетанол етаноламина е безвреден
амин
Сулфолан, вода, диизо- Сулфоланът се разлага и
Пропаноламин предизвиква сярно отравяне
Моно- и диетаноламина Няма отровно действие
във воден разтвор
Метанол Същото
Друга причина за дезактивация на катализатора може да бъде него-вото прегряване от попадане на големи количества въглеродни оксиди вследствие от нарушаване на работния режим на стадия конверсия на оксидите на въглерода и промивка на конвертирания газ от СО2. Ако част от газа постъпващ за метаниране байпасира стадия на конверсия на СО е възможно отравяне на катализатора за метаниране със серни съединения. То е аналогично на отравянето на катализатора от частична-та конверсия.
Табл. 16 Материален баланс за пресмятане на паро-кислородната газификация на нефтените остатъци
| Компоненти | Обем, м3 за 1 кг суровина | |
| Изходни компоненти | Конвертиран газ | |
| Н2О О2 N2 CO CO2 H2 CH4 H2S COS + CS2 | 1,243.(a + W) 0,935.C` + δ (0,935.C` + δ)(1 - СО2)/ СО2 - - - - - - | 1,243.(a+W)–1,867.C`.β+2.δ - (0,935.C`+δ).(1-СО2)/СО2+0,8N 1,867.C`(1 – β) 1,867.C`.β 11,2.H` + 1,867. C`.β - 2δ 0,015 0,63.S 100.S |
След заместване на обема на компонентите Н2, СО2, СО, Н2О от таблицата в уравнението на константата на равновесие за реакцията на конверсия на СО с водни пари ще получим:
K2 = CH2.CCO2
CCO.CH2O
K2 = β.(11,2.H` + 1,867.C`.β – 2.δ)
(1 – β ).[1,243.(a + W) – 1,867.C`. β + 2. δ ]
Топлинният баланс на процеса на газификация се описва с урав-нението:
Q н + q т + qH 2 O + qO 2 = 1,867. C `.(1 – β).(12600 + t 2 . cCO ) + (11,2. H ` +
1,867. C `.β – 2.δ).(11100 + t 2 .cH 2 ) + [1.243.( a + W ) + 2.δ]. t 2 cH 2 O +
1,867. C `.β. t 2 . cCO 2 + qc + q
,където Q н е топлината от изгаряне на суровината, kJ/kg; q т е количество топлина, въвеждано със суровината в реактора, kJ/kg; qH 2 O е количество топлина, което се въвежда с парата, kJ/kg; qO 2 е количеството топлина, което се въвежда с кислорода в реактора, kJ/kgl; t 2 e температурата на из-ход от реактора, 0С; cCO, cH 2, cH 2 O, cCO 2 са средни топлинни капацитети на компонентите при постоянно налягане и температура на изход от реактора, kJ/(m3.0C); q – загуба на топлина в околната среда, kJ; qc – топлината на изгаряне и енталпията на саждите, метана, сероводорода, серните окиси, въглеродния сулфид и азота, пресметнати по уравнението:
qc = 1347 + 0,005.Q н + 18200 .S
Решавайки съвместно уравнението на равновесие на реакцията на конверсия на СО с водни пари и топлинния баланс ще намерим β и δ.
Szargan, P. е изучавал процеса на паро-кислородна газификация на течно гориво в промишлен реактор. Реакционните зони в газгенератора, според неговите изследвания, са показани на фигура 10.
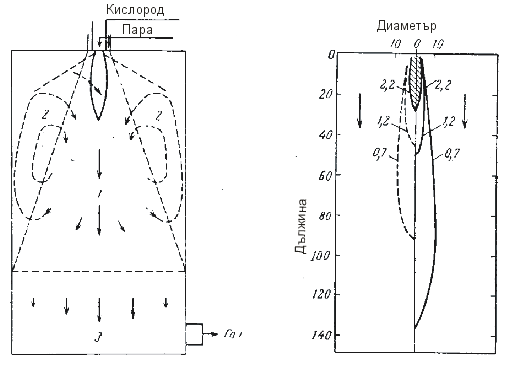
а б
Фиг. 10 а) Реакционни зони на факелния процес на газификация на течно гориво: 1 – зона на факела; 2 – зона на циркулация; 3 – зона на завършване на реакцията.
б) Изменение концентрацията на кислорода във факела при газификация на течни горива (прекъсната линия – екпериментални данни, непрекъсната линия – теоретични данни)
В горните зони течното гориво се разпръсква механично с форсун-ки и пневматично от паро-кислородната смес в горелката. Малките капки се изпаряват в атмосфера на горещ газ в зона 1 и 2. Потокът на окислителя засмуква изпареното гориво и газ от зона 2 в зона 1. В пламъка част от парите на горивото и газа изгарят, при което се достига температура по-висока от 2500 0С.
В противоположност на типичното направление на пламъка, този пламък е преобърнат, тъй като свободният кислород се намира отвътре, а горещият газ се засмуква отвън.
На фиг. 10 - б) е показано изменението на концентрацията на кисло-рода във факела за газификация на течни горива с отдалечаване от усти-ето. В пламъка, при концентрация на кислорода 2,2 м3 на 1 кг гориво, тем-пературата достига до 3000 0С. Заедно с продуктите от пълното горене СО2 и Н2О се образуват и продукти от дисоциация: СО, Н2, О2, а също и атомен кислород, водород и хидрооксиден радикал. Свободен и атомен кислород има не само на границите на пламъка, но и на разстояние, пре-вишаващо 1,6 пъти дължината на пламъка (концентрация на О2 > 1,2 м3/кг), а атомният водород и радикалът –ОН – на разстояние 2,2 (концентрация на О2 > 0,9 м3/кг). Дължината на пламъка се определя основно от сечение-то на изходната дюза на форсунката. Налягането в реактора не влияе на дължината на пламъка.
Обяснявайки химизма на процеса на газификация на течни горива и сравняването му с механизма на частично окисление на газообразно го-риво, авторите считат, че процесът протича в два стадия. Първо протича пълно изгаряне на въглеводородите, при което се изразходва всичкия кис-лород. Във втория стадий става конверсия на останалите въглеводороди с пара и въглероден диоксид. Предложен и механизъм на частично окисление на метана във факела с отчитане образуването на ацетилен в качеството му на междинен продукт. Съобразно с този механизъм проце-сът протича на три стадия: на първия става верижна реакция на окисле-ние на метана и се образуват предимно въглеводороди С2 и вода, на вто-рият стадии има окисление на ацитилена и водорода, а на третия – пълно окисление на всички междинни продукти до въглероден оксид и водород.
Л.Н. Алейнова и колектив експериментално определят основните стадии на непълно горене на метана. Авторите считат, че процесът се състои от три стадия. Първият се характеризира с пълно отреагиране на кислорода и натрупване на СО, водород, СО2, вода и малки количества ацетилен; на вторият стадий се натрупва ацетилен и спира натрупването на водни пари и СО2; на третият стадий става конверсия на въглеводоро-ди, разграждане на ацетилена до отделните елементи и газификация на саждите.
Отличителна особеност на газификацията на течни горива е отделя-не на сажди. Газификацията се води при условия, водещи до образуване на сажди, въпреки че при достигане на ТД равновесие, въглеродът в продуктите на реакцията трябва да отсъства. Получаването на сажди зависи от относителния разход на кислород и водна пара, температурата и налягането на процеса, качеството на разпръскане на горивото и смес-ването му с окислителя. Получаването на сажди намаля с увеличаване от-носителния разход на кислород и водна пара. Установено е, че при отно-сителен разход на кислород, равен на 0,6 м3 на 1 кг мазут, се отделя 7% (масови) сажди (изчислено по мазута), при относителен разход 0,8 м3/кг – 0,5% (масови).
Образуването на дисперсен въглерод се обяснява с това, че заедно с процесите на непълно и пълно изгаряне при газификация протичат процеси на разцепване на въглеводородите. В съответствие с основните положения в теорията на П. А. Теснер, образуването на сажди се предшества от образуването на радикал, от който се образува зародиша на саждената частица. От съотношението кислород:гориво зависи не само добива на сажди, но и тяхната относителна повърхност.
Електронно-микроскопски изследвания на сажди, получени от паро-кислородна газификация на мазут, показали, че първичните частици имат сферична форма и диаметър 20 - 50ηm. Има и по-големи частици, които, както предполагат авторите, се образуват от механично съединяване на първичните. От това изследване се прави извод, че саждите в процеса на газификация на течни горива се образуват от паровата фаза, а не от теч-на при коксуване на капки от гориво, както се е предполагало по-рано.
Електронно-микроскопските изследвания показали също, че първич-ните частици изгарят отвън и с повишение на температурата стават силно пористи. Някои частици се окисляват до търкостенни черупки, защото окислението при тях протича първо във вътрешността на частицата.
Изборът на режим на газификация на течните и газообразни въгле-водороди се определя не само от условията на ТД равновесие, отколкото от техническите възможности за водене на процеса. Давлението се под-бира в зависимост от технико-икономическите разчети. Широко разпрост-ранение са получили инсталации за газификация при налягане 2,0 – 4,2 MРa; максималното налягане на процеса може да достигне 10 Mрa.
В зависимост от условията на ТД равновисие, ниска концентрация на метан в газа може да се достигне при температура по-висока от 1000 0С. Но скоростта на реакция при такава температура без катализатор е малка, а при това се наблюдава значително саждообразуване. Затова процесът се провежда при температура по-ниска от 1300 0С. С повишава-не на налягането трябва да се повиши и температурата на процеса, например по следния начин:
Налягане, МРа............................ 3 6 10
Температура, 0............................ 1300 1350 1400
Отношението пара:суровина се приема също от емпиричните данни от 0,3 до 0,5, при което колкото по-тежка е суровината, толкова по-висок е разхода на пара. Подгряването на изходните компоненти позволява малко да се намали разхода на кислород и да се подобрят условията на проце-са.
Температурата на подгряване на суровината се колебае в широки граници от 80 до 300 0С. Минималната температура е ограничена от вис-козността на суровината: суровината трябва да бъде подгрята минимум до 20 – 30 0С, като при тази температура визкозитета става достатъчен за по-даване и разпръскване във форсунките. В тях суровината се разпръсква добре при вискозитет 3 – 4 условни градуса. Максимално допустима тем-пература на нагряване на суровината се ограничава от условията на отде-ляне на кокс по стените на подгревателя на суровината. Суровината ряд-ко се подгрява в подгреватели с пряк огън, а с водна пара с ниско наляга-не и температура 110 – 120 0С.
Най-сложно се явява подгряването на кислорода във връзка с ръста на неговата реакционна активност по отношение на металите. Температу-рата на кислорода, подаван в реоктора, се избира в границите от 20 – 300 0С. Безопасното подгряване на кислород до 300 0С може да се обезпечи при използване на прегрята водна пара.
Разходът на кислород зависи също и от загубите на топлина в реак-ционната зона, а последните зависят от производителността и конструк-тивното оформление на газгенератора и е в границите 0,1 – 4% от топли-ната на изгаряне на изходната суровина. В съвремените високопроизводи-телни промишлени газгенератори загубата на топлина в реакционната зона не превишава 0,3 – 0,5%.
В таблица 17 са приведени показатели на процеса паро-кислородна газификация на природен газ, бензинови пари и тежко котелно гориво при налягане около 3 МРа, а в талица 18 – газификация на различни суровини про налягане 6 МРа по данни на фирма Shell. В таблица 19 е даден мате-риален баланс от газификацията на мазут.
Табл. 17 Показатели на процеса паро-кислородна газификация на въглеводороди при налягане 3 МРа
| Показатели | Приро-ден газ | Бен-зин | Тежко котелно гори-во |
| Разход за 1 кг от суровината кислород (95%-ен)............... водна пара (с температура на насищане 246 0С)........... Температура на подгряване, 0С суровина.............................. кислород.............................. водна пара.......................... Добив на газ, м3 за 1 кг суровина Състав на газа, % СО2 ………………………….. СО …………………………… Н2 ……………………………. СН4 ………………………….. N2 + Ar ………………………. H2S + COS …………………. | 0,98 0,05 236 236 246 3,73 2,8 34,5 61,0 0,3 1,4 - | 0,83 0,35 300 300 300 3,29 3,9 41,7 52,7 0,3 1,4 7.10-3 | 0,75 0,40 236 236 246 2,95 4,3 46,9 46,2 0,3 1,4 0,9 |
Табл. 18 Показатели за процеса паро-кислородна газификация на Различни суровини при налягане 6 МРа
| Показатели | Природен газ | Лек бензин от пър-вична дестилация | Мазут | Крекинг-остатък | Вакуум остатък | Остатък от деас-фалтизация | Мазут | Крекинг-остатък |
|
Температура, 0С, на вход в реактора суровина............... кислород............... пара....................... Разход на кислород за 1 кг суровина (95%) м3/кг....................... пара, кг.................. газ (сух), м3........... Състав на газа, % СО2........................ СО......................... Н2.......................... СН4....................... N2.......................... Ar.......................... H2S....................... COS..................... Производство на пара в котел-утилизатора, кг/кг............................ Налягане на насите- ната пара, МРа........ Добив на сажди, % (тегл.) | Без циркулация на сажди | С циркула- ция на саж- ди | ||||||
| 300 245 313 0,983 0,20 3,63 3,88 33,82 60,13 0,60 0,72 0,85 - - 3,54 10,5 0,02 | 250 245 313 0,879 0,40 3,21 5,21 41,29 51,45 0,60 0,58 0,86 0,01 - 3,06 10,5 3,0 | 245 245 313 0,750 0,45 2,94 4,91 46,19 46,02 0,60 0,65 0,80 0,80 0,03 2,72 10,5 3,0 | 245 245 313 0,763 0,45 2,98 4,86 46,89 45,81 0,60 0,63 0,81 0,38 0,02 2,81 10,5 3,0 | 245 245 313 0,745 0,50 2,90 5,55 46,54 45,03 0,60 0,68 0,81 0,76 0,03 2,80 10,5 3,0 | 300 245 313 0,771 0,55 2,80 6,09 46,99 43,26 0,60 0,62 0,80 1,57 0,07 2,80 10,5 3,0 | 245 245 313 0,776 0,45 3,01 5,10 46,61 45,42 0,60 0,65 0,81 0,78 0,03 2,85 10,5 3,0 | 245 245 313 0,786 0,47 3,06 5,15 47,01 45,41 0,60 0,63 0,81 0,37 0,02 2,90 10,5 3,0 | |
Табл. 19 Материален баланс на паро-кислородната газификация на мазута
| Компоненти | Коли- чество | Тук се включват елементите | ||||
| С | Н | О | N | S | ||
| Приход, кг | ||||||
| Мазут........................... Водна пара................. Кислород..................... | 100,0 46,0 100,9 | 87,3 - - | 9,8 5,1 - | 0,8 40,9 100,9 | 0,7 - - | 1,4 - - |
| Общо...... | 246,9 | 87,3 | 14,9 | 142,6 | 0,7 | 104 |
| Н2................................. СО……………………… СО2 ……………………. Н2О ……………………. Н2S.............................. COS............................. N2................................. CH4.............................. Сажди.......................... | 12,0 178,0 26,9 24,1 1,4 0,1 0,7 0,4 3,3 | - 76,4 73 - - 0,02 - 0,3 3,3 | 12,0 - - 2,7 0,1 - - 0,1 - | - 101,6 19,6 21,4 - 0,02 - - - | - - - - - - 0,7 - - | - - - - 1,3 0,1 - - - |
| Общо....... | 246,9 | 87,3 | 14,9 | 142,6 | 0,7 | 1,4 |
Табл. 20 Физични константи на газове, влизащи в състава на нефтозаводските газове
| Газ | Плътност при 0 0С и 0,1 МРа, кг/м3 | Молекулна маса | Т. кип. при 0,1 МРа, К | Газова кон-станта R, J/(kg.K) | Специфична топлина на кипене, kJ/kg | Критични константи | |
| Ткр, К | Ркр, МРа | ||||||
| Н2................. СН4............... С2Н6.............. С2Н4.............. С3Н8.............. С3Н6.............. n-C4H10 …….. n-C4H8 ……… n-C5H12 …….. | 0,09 0,717 1,356 1,260 2,005 1,914 1,703 - - | 2,0159 16,04 30,07 28,05 44,09 42,08 58,12 56,104 72,146 | 20,38 111,67 184,53 169,37 231,1 225,45 272,65 266,66 309,21 | 4124,2 518,2 276,7 296,6 188,5 197,5 143,0 - - | 451,8 510,4 489,9 483,2 448,0 427,0 386,5 404,0 483,2 | 33,08 190,1 308,27 282,5 369,81 365,0 425,01 417,0 470,2 | 1,30 4,62 4,89 5,14 4,26 4,59 3,80 4,02 3,35 |
І. Въведение
Водородът е най-простият, най-лекият и най-често срещан в природата елемент. Навсякъде е в свързано състояние – във водата, в сложните молекули на въглеводородите – нефта, в природния газ. Има три изотопа: протий, деутерий и тритий, като най-разпространен е първият. Водородът изобилства в Слънчевата система като съставлява 71% от нейната маса или 91% от всички атоми.
Притеглен от гравитационните сили на Слънцето водородът се превръща в хелий чрез реакции на ядрен синтез, процесът който осигурява енергия за живот на Земята.
Молекулярният водород е газ без цвят и миризма и е практически неразтворим във вода. Противно на всички останали газове той се стопля при разширение, но само до определено налягане. Водородът е 14,5 пъти по-лек от въздуха и 16 пъти по-лек от кислорода и съгладно закона на Грем, той дифундира 4 пъти по-бълзо от кислорода във въздуха. Коефициентът му на топлопроводност е 7 пъти по-голяма от тази на въздуха.Водородът се втечнява при -253 0С, а изкристализира при -259 0С.
В химично отношение при обикновени температури водородът не е много активен. Енергично се свързва само с флуора, с хлора - фотохимично, а с кислорода при нагряване. При подходящи високи температури взаимодейства с много елементи като получените съединения се наричат хидриди.
Водородът е едно изключително перспективно гориво – при изгаряне отделя 120 МКал/кг, като продукт от изгарянето е само вода. В космическите совалки отдавна го използват за снабдяване с енергия, а получената вода астронавтите използват за пиене. Създаването на ДВГ работещ с водород би подобрило значително екоравновесието на земята.
Поради опасността от експлозия и неудобството при съхранение и транспорт, водородът все още не е намерил широко приложение като гориво за ДВГ. Най-използван метод на съхранение е в балони, като с увеличение на допустимото налягането, намаля масовото съдържание на водорода в съхранявания газ(300атм – 13% mass, 500атм – 11% mass, 900атм – 9% mass). Надежда за развитието на водорода като гориво е, че той се разтваря много добре в няко метали (600 до 3000 обема в паладий) и при загряване се освобождава. Друга насока в изследванията е използване на въглеродни нанотръбички или стъклени микросфери за съхраняване на водорода. От друга страна разтварянето на водорода в желязото е причина за намаляне на механичните му показатели (т. н. „водородна слабост”), което е причина за аварийни ситуации. В инсталации за производство на водород се използват скъпи, висококачествени стомани.
Съществуват следните методи за получаване на водород:
· Термохимични – наричат се още реформинг процеси и в момента намират най-широко приложение. Използват термокаталитично преобразуване на въглеводороди като природен газ, метанол, газолин и дори въглища във взаимодействие с водни пари.
· Електрохимични – при пропускане на електрически ток през воден разтвор на електролит се получава водород
· Фотоелектрохимични – водородът се получава, когато към потопен във вода електрод, през който протича ток, се насочи светлина.
· Фотобиологични - фотобиологичните системи принципно използват естествената фотосинтетична активност на бактерии и зелени водорасли, които синтезират водород.
В настоящето водородът е основна суровина, без който е немислимо съществуването на торовата промишленост, производството на горива, в хранителната промишленост – за произходство на хидрирани мазнини, за получаване на някои метали(W, Mo) в чист вид от техните оксиди поради неговото редукционно действие.
Водородът в нефтохимическата промишленост се получава основно при процесите на реформинг и крекинг и се използва за хидроочистка на средно и високо дестилатните фракции от серни и азотни съединения. Без него е немислимо производството на дизелови горива. В хидрокрекинг процесите се използва за получаване на изключително висококачествени бензини. Инсталациите за реформинг са източник на водород, поради протичащите в тях процеси на дехидрогенизация и циклизация на въглеводородите, но някои нефтопреработвателни заводи строят специални инсталации за производство на водород.
В торовата промишленост водородът се използва за синтез на амоняк, от който се произвеждат едни от най-високотонажните минерални торове – амониева селитра и карбамид.
Цел на настоящата дипломна работа е да се обследва процеса на реформинг на природния газ и получаване на водород като съставна част на азото-водородния синтез газ в цех АМ – 76 на „Неохим” АД.
ІІ. Теоретична част
В днешни дни основен метод за производство на водород е паро-каталитическата конверсия на въглеводородите, в частност природения газ. Нефтопреработвателната и нефтохимическа индустрия разполага с значителни ресурси на водородсъдържащи газове, които обаче не могат да се използват, заради ниското съдържание на водород в тях и присъствието на вредни примеси. Този метод е добре разработен технологично и апаратурно.
За метода на паро-кислородната газификация нефтените остатъци важи същото, но при него са нужни по-големи експлуатационни разходи и капиталовложения. Що се отнася до другите методи за получаване на водород като основен продукт (крекинг на въглеводороди, метало-паров метод, електролиза на водата, термохимични методи), те не са намерили приложение в промишлеността и затова няма да бъдат разгледани в тази дипломна работа.
Водородът в процесите на частично дехидриране (каталитически риформинт на бензина, дехидриране на бутана и бутилена), се явава страничен макар и ценен продукт.
Паро-каталитична конверсия на въглеводородите
Производството на водород по този метод се състои в три етапа: подготовка на суровината, конверсия и отделяне на оксидите на въглерода от конвертирания газ. На стадия на подготовка суровината се очиства от ненаситени въглеводороди, органични съединения на сярата, в някои случаи се провежда стабилизация, посредством частична конверсия на хомолозите на метана. На стадия на отделянето на въглеродните оксиди от конвертирания газ се извършва конверсия на въглеродния оксид с водна пара, очистка на газа от въглероден диоксид и отделяне на остатъчните оксиди на въглерода чрез метаниране. Изброените етапи, с изключение на отделянето на въглеродния диоксид, са каталитични процеси близки по апаратурно оформление.
Подготовка на суровината за каталитична конверсия
Катализатоторите използвани при парова конверсия на въглеводородите, нискотемпературна конверсия на въглеродния оксид и метаниране лесно се отравят от серни съединения. В изходната суровина може да се съдържат като примеси сероводород, меркаптани, сулфиди, тиофен и др.
В процеса на парова конверсия на въглеводородите на никеловия катализатор съединенията на сярата се хидрират с образуване на сероводород. Той взаимодейства с никеловия катализатор по реакцията:
mNi + nH2S →NiimSn + nH2
Отравянето на катализаторите, използвани за нискотемпературна конверсия на въглеродния оксид става в резултат на неговото взаимодействие с сероводород по реакцията:
ZnO + H2S →ZnS + H2O
Cu + H2S → CuS + H2
В суровината трябва да отсъстват примеси на ненаситени въглеводороди, наличието на които създава опасност от отложения на кокс върху катализатора.
В качеството на суровина за парова конверсия се използват различни газове, но най-често метан. В нефтопреработването, използваните за процеса на конверсия газове са странични продукти с променлив състав. Затова е целесъобразно на стадия на подготовка да се осигури стабилен по състав газ, чрез нискотемпературна конверсия на хомолозите на метана в метан по реакцията:
CnH2n+2 + (n-1)/2H2O → (3n+1)/4CH4 + (n-1)/4CO2
Дата: 2019-05-28, просмотров: 343.